复合磁性纳米粒子用于食源性致病菌特异性检测及灭活
郭寒琼,吴浩天,齐畅,方远*,王晓敏
(1.天津科技大学 食品科学与工程学院食品营养与安全国家重点实验室,天津 300457;2.天津中医药大学 中西医结合学院,天津 301617)
食源性致病菌可以通过污染空气、水和食物等方式与人类接触,由其导致的感染会引起各种疾病,如恶心、呕吐、腹痛和腹泻等急性胃肠炎症,重者可出现呼吸、循环、神经等系统并发症[1]。因此,构建一个简单有效的细菌即时检测(point-of-care testing,POCT)和消除平台具有重要意义。目前,大多数已开发的策略仅专注于对食源性致病菌的灵敏检测而没有后续的细菌灭活功能,或者仅专注于对病原菌的高效灭活而没有早期预警功能,这些独立的检测和灭菌方法可能会造成细菌的二次传播[2-5]。
抗生素作为治疗细菌感染的传统药物在保护人类健康方面发挥着重要的作用[6-8]。然而,抗生素的过量和超范围使用往往会导致耐药细菌菌株的出现,给人类健康带来了极大的风险[9-10]。近年来,基于高温的光热疗法(photothermal therapy,PTT)因其系统毒性低、产生耐药性的可能性较小而被认为是一种有前途的灭活细菌的新方法[11-13]。另一方面,基于比色法[14]、荧光[15]和电化学发光[16]的各种生物传感器已经被构建用于细菌检测。然而,比色法和荧光法通常需要外部光源或电源,不利于现场的快速检测。相比之下,依赖于化学反应的化学发光(chemiluminescence,CL)可以不受激发光源的影响,能够显著提高信噪比,从而提高了检测灵敏度[17-19]。
因此,本研究开发一种集化学发光检测和光热灭活于一体的食源性致病菌检测及灭活平台。以革兰氏阳性的金黄色葡萄球菌(Staphylococcus aureus)为研究对象,对实验过程中H2O2浓度、实验温度以及孵育时间进行优化,从而获得反应的最佳条件。在此条件下,基于Fe3O4@Van-S.aureus 复合物对鲁米诺-过氧化氢(luminol-H2O2)化学发光体系的抑制作用对S.aureus 进行检测。原理如图1 所示。
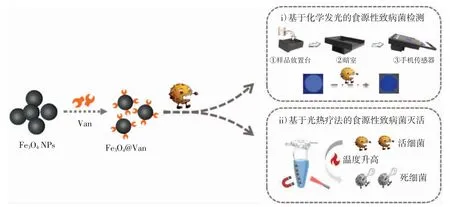
图1 Fe3O4@Van 检测及杀菌原理示意图Fig.1 Schematic diagram of detection and sterilization of Fe3O4@Van
如图1 所示,Fe3O4@Van 与S.aureus 细胞壁肽聚糖之间形成氢键,形成Fe3O4@Van-S.aureus 复合物,S.aureus 所分泌的过氧化氢酶可有效降低溶液体系中的化学发光强度,以化学发光强度作为输出信号实现对致病菌的灵敏检测。同时,因Fe3O4@Van 在近红外区域具有宽广的吸收,用808 nm 激光照射磁分离后的Fe3O4@Van 与细菌复合物产生大量热能,从而实现对致病菌的杀死,可有效防止检测完成后的二次污染。
1 材料与方法
1.1 材料与试剂
牛奶、矿泉水:市售。FeCl3·6H2O、H2O2、聚乙二醇、醋酸钠、N-(3-二甲基氨基丙基)-N'-乙基碳二亚胺盐酸盐[N-(3-dimethylaminopropyl)-N'-ethylcarbodiimide hydrochloride,EDC]、N-羟基琥珀酰亚胺(N-hydroxysuccinimide,NHS)、吗啉乙磺酸(2-morpholinoethanesulphonic acid,MES):国药集团化学试剂有限公司;乙二醇:天津江天化工技术股份有限公司;牛血清蛋白、鲁米诺、万古霉素:上海阿拉丁试剂有限公司;金黄色葡萄球菌及其他种类的对照细菌:广东省微生物菌种保藏中心;胰蛋白胨、琼脂、酵母提取液:北京索莱宝科技有限公司;牛肉膏:赛默飞世尔科技(中国)有限公司。所用试剂均为分析纯。
1.2 仪器与设备
电子分析天平(BT25S):赛多利斯科学仪器(北京)有限公司;离心机(H1650-W):湖南湘仪实验室仪器开发有限公司;808 nm 激光器(220VAC):海特光电有限责任公司;恒温培养箱(DHP-2042 BS):美国Thermo 有限公司;紫外可见分光光度计(UV-2600):日本SHIMADZU 公司;超微弱化学发光检测仪(RFL-1):西安瑞迈分析仪器有限公司;红外热成像仪(Fotric 225S):美国FOTRIC 公司。
1.3 方法
1.3.1 Fe3O4NP s 和Fe3O4@Van 的制备
Fe3O4NPs 的制备参考文献[20]的方法,稍作修改。将FeCl3·6H2O(1.35 g)溶解于含有乙二醇溶液(40 mL)的烧杯中,搅拌5 min。随后将醋酸钠(1.8 g)和聚乙二醇(0.5 g)加入烧杯中并在室温下搅拌30 min。随后将烧杯中的液体转移到反应釜中,置于200 ℃的烘箱中加热6 h。待液体冷却后,使用超纯水和乙醇分别洗涤3 次,获得Fe3O4NPs。
将1 mL 的Fe3O4NPs(2 mg/mL)溶液用MES 缓冲液(pH5.5)洗涤3 次,加入EDC(4 mg)和NHS(4 mg)后于室温下振荡30 min,然后加入万古霉素(1 mg)振荡孵育12 h,最后通过MES 缓冲液(pH7.4)洗涤3 次,置于4 ℃冰箱备用。
1.3.2 Fe3O4NPs 和Fe3O4@Van 的表征
将Fe3O4@Van 滴到硅片上,在室温下进行干燥。将干燥后的硅片转移至粘有导电胶的载物台上,溅射镀金,使用扫描电子显微镜观察Fe3O4@Van 形貌。
将Fe3O4NPs 和Fe3O4@Van 溶液(350 μL)分别置于紫外分光光度计中,记录其在200~900 nm 的吸收光谱。
利用Zeta 电位纳米粒度分析仪记录Fe3O4NPs、Fe3O4@Van 和万古霉素的电位分布状况。
1.3.3 Fe3O4@Van 的光热性能分析
将Fe3O4@Van 置于48 孔板中,在距离孔板1 cm的位置利用808 nm 激发器添加一束功率密度为1 W/cm2的激光。利用红外热成像仪实时监测溶液温度的变化,随激光辐照时间延长,溶液温度不断上升并逐渐到达峰值。然后关闭激发器,记录溶液的降温数据。将Fe3O4@Van 溶液在808 nm 激光辐照/关闭各5 min,循环5 次,通过热学成像仪每隔30 s 记录温度数据并绘制温度循环曲线图。
1.3.4 致病菌检测原理验证
将稀释至不同浓度的S.aureus 菌液(1 mL)与Fe3O4@Van 孵育3 min,待细菌与Fe3O4@Van 充分结合后加入H2O2继续孵育10 min。随后吸取0.5 mL 上述混合溶液添加至含有鲁米诺的化学发光体系中,利用超微弱化学发光检测仪记录对应化学发光强度。
1.3.5 条件优化
1.3.5.1 H2O2浓度优化
选取H2O2浓度为0.1、0.2、0.5、0.8、1.0、1.5 mmol/L,固定孵育时间为10 min、实验温度为25 ℃进行实验。使用超微弱化学发光检测仪记录每组化学发光强度,以化学发光强度的比值为评价标准确定H2O2的最佳使用量,每组实验重复3 次。
1.3.5.2 实验温度优化
在Fe3O4@Van-S.aureus 复合物中添加H2O2后,将上述混合溶液分别置于4、25、37、45、50 ℃下固定孵育时间为10 min。随后使用超微弱化学发光检测仪记录每组化学发光强度,以化学发光强度的比值为评价标准确定最适宜的实验温度,每组实验重复3 次。
1.3.5.3 孵育时间优化
将Fe3O4@Van 与S.aureus 振荡孵育后,将上述Fe3O4@Van-S.aureus 复合物与H2O2分别孵育1、2、5、10、15 min。随后使用超微弱化学发光检测仪记录每组化学发光强度,以化学发光强度的比值为评价标准确定最佳孵育时间,每组实验重复3 次。
1.3.6 细菌的检测
通过对实验体系中H2O2浓度、实验温度以及孵育时间进行优化,确立反应的最优条件。固定H2O2浓度为0.8 mmol/L,实验温度为25 ℃,孵育时间为10 min。
在该反应条件下,Fe3O4@Van 分别与不同浓度(10、50、102、5 ×102、103、5 ×103、104、5 ×104、105CFU/mL)的S.aureus 孵育。将Fe3O4@Van-S.aureus 复合物与H2O2在室温下孵育10 min 后,吸取上述混合溶液添加至化学发光体系中,利用超微弱化学发光检测仪记录对应化学发光强度。重复上述操作3 次,确定化学发光强度与细菌浓度的关系,实现对S.aureus 的定量检测。
1.3.7 实际样品的加标回收实验
取5 mL 无菌牛奶于离心管中,离心10 min(8 000 r/min),离心后弃去上层的乳脂肪泡沫,此过程重复3 次。随后将离心管中剩余液体混合均匀进行稀释处理;矿泉水样品预处理:取1 mL 市售矿泉水过膜,然后用超纯水稀释100 倍待使用。所有样品均预先经高压灭菌(121 ℃,20 min),再进行样品加标实验。
通过测量菌悬液在600 nm 处的吸光度确定菌液浓度。对培养至对数期的菌悬液进行梯度稀释,使得待测样液中所含细菌数量分别为1×103、1×104、1×105CFU/mL。随后使用超微弱化学发光检测仪记录混合溶液的化学发光强度,将实际样品中加标回收的检测值与线性范围内S.aureus 的理论值进行数据分析,最后根据公式计算样品加标回收率,重复上述操作3 次。
1.3.8 光热抗菌
利用涂布平板法来探究Fe3O4@Van 在808 nm 激光照射下的光热抗菌能力,通过计算细菌菌落存活数量来评估Fe3O4@Van 对S.aureus 的破坏效果。实验过程按以下4 组方式进行处理:1) 超纯水处理的菌体不加激光照射;2)超纯水处理的菌体加激光照射(808 nm,1.0 W/cm2);3)经磁分离后Fe3O4@Van 偶联的菌体加激光照射(808 nm,1.0 W/cm2);4)经磁分离后Fe3O4@Van偶联的菌体不加激光照射。以上4 组经过不同处理后,取适量菌悬液于固体营养琼脂培养基上,用灭菌涂布棒进行涂布,随后置于37 ℃恒温恒湿培养箱中培养12 h,通过平板菌落计数法计算4 种处理方式中Fe3O4@Van 的抗菌效率。
1.4 数据处理
定量数据以平均数±标准差表示,每组样本不低于3 个。统计学比较采用方差分析和独立样本t 检验。P<0.05 表示统计学上差异显著。
2 结果与分析
2.1 材料表征
实验材料合成后,使用扫描电子显微镜以及Zeta电位纳米粒度分析仪来验证Fe3O4@Van 的成功制备,结果见图2。

图2 验证Fe3O4@Van 的成功制备Fig.2 Verification of Fe3O4@Van preparation
由图2A 可知,Fe3O4@Van 在扫描电子显微镜图像中显示出了饱满的球状形态,经统计平均粒径为499.8 nm。由图2B 可知,Fe3O4NPs 和万古霉素的表面分别携带负电和正电,由于Fe3O4NPs 与万古霉素发生电位中和反应,Fe3O4@Van 表面的负电荷低于Fe3O4NPs。以上数据证实了Fe3O4@Van 的成功制备。
随后使用紫外可见分光光度计分别对Fe3O4NPs和Fe3O4@Van 进行表征,验证Fe3O4NPs 和Fe3O4@Van的光学性质,结果见图3。

图3 Fe3O4 NPs 和Fe3O4@Van 的紫外特征吸收光谱Fig.3 Characteristic UV absorption spectra of Fe3O4 NPs and Fe3O4@Van
Fe3O4NPs 和Fe3O4@Van 的紫外可见吸收光谱在400~900 nm 范围内均显示出了强烈的宽吸收,表明两者均具有出色的光热转换潜力,可高效杀灭细菌。
2.2 实验原理验证
S.aureus 是一种常见的革兰氏阳性菌,使用超微弱化学发光检测仪对Fe3O4@Van 在检测S.aureus 过程中的化学发光强度进行监测,对Fe3O4@Van 的检测原理进行了验证。细菌数量与化学发光强度的对应关系见图4。

图4 细菌数量与化学发光强度的对应关系Fig.4 Changes in chemiluminescence intensity with the number of bacteria
由图4 可知,随着实验体系中细菌数量的增加,所分泌的过氧化氢酶逐渐增加,对含有H2O2和luminol化学发光体系的抑制作用就越强。
2.3 Fe3O4@Van 光热性能研究
通过近红外的激光(808 nm)照射研究Fe3O4@Van的光热性能,结果见图5。

图5 Fe3O4@Van 溶液的光热性能Fig.5 Photothermal properties of Fe3O4@Van solution
从图5A 中可以看出,Fe3O4NPs 和Fe3O4@Van 的温度随着激光照射时间的延长而增加。所制备的Fe3O4@Van 可以抵抗长时间的激光照射,在5 个加热/冷却过程的循环后溶液的最高温度并未发生明显变化(图5B),表明其具有优异的光热稳定性。
2.4 条件优化
为了提高实验体系的灵敏度,以金黄色葡萄球菌为代表,在其添加量为103CFU/mL 时对H2O2浓度、实验温度以及复合物与H2O2的孵育时间进行了优化。
2.4.1 H2O2浓度优化
由于细菌分泌的过氧化氢酶会分解溶液中的H2O2,外源加入H2O2的浓度会影响实验体系的化学发光强度,因此对实验中外源H2O2浓度进行优化,结果见图6。

图6 H2O2 浓度优化Fig.6 Optimization of H2O2 concentration
由图6 可知,当H2O2浓度为0.8 mmol/L 时,检测体系中化学发光强度的比值达到最大值,此时检测效果最佳。因此,选用H2O2浓度为0.8 mmol/L 开展后续实验。化学发光强度比值用1-(I/I0)来表示,其中I 表示在含有不同浓度H2O2的检测体系中加入浓度为103CFU/mL 的金黄色葡萄球菌时,所对应的化学发光强度值;I0则表示在含有不同浓度H2O2的检测体系中未添加细菌时所对应的化学发光强度值。
2.4.2 实验温度优化
由于实验过程中涉及了活细菌和不同的材料,进一步考察实验温度对检测过程的影响,结果见图7。

图7 实验温度优化Fig.7 Optimization of test temperature
从图7 可以看出,在不同实验温度下溶液中的化学发光强度比值接近,说明实验温度对于细菌检测的影响并不明显。因此为了检测过程的方便及快速,最终选择接近于室温的25 ℃作为检测时的实验温度。化学发光强度比值用1-(I/I0)来表示,其中I 表示在不同温度下,当检测体系中含有浓度为103CFU/mL 的金黄色葡萄球菌时所对应的化学发光强度值;I0则表示在不同温度下,当检测体系中未添加细菌时所对应的化学发光强度值。
2.4.3 孵育时间优化
Fe3O4@Van 与细菌形成巨大的复合物后,复合物中的细菌仍会逐步分解H2O2,复合物与H2O2的孵育时间也会影响实验的化学发光强度。孵育时间优化的结果见图8。

图8 孵育时间优化Fig.8 Optimization of incubation time
从图8 可以看出,化学发光强度比值随着孵育时间的延长,整体呈现上升趋势。在10 min 时到达平台期,为了保证最佳的检测效果,同时节省实验时间,因此本实验选用的孵育时间为10 min。化学发光强度比值用1-(I/I0)来表示,其中I 表示在不同孵育时间下,当检测体系中含有浓度为103CFU/mL 的金黄色葡萄球菌时所对应的化学发光强度值;I0则表示在不同孵育时间下,当检测体系中未添加细菌时所对应的化学发光强度值。
综上所述,选用H2O2浓度为0.8 mmol/L、实验温度为25 ℃和孵育时间为10 min 进行后续的细菌检测和灭活实验。
2.5 细菌检测
不同浓度的细菌分泌的过氧化氢酶也有所差异,通过化学发光监测降解H2O2的速度可以间接计算细菌的数量。化学发光强度与S.aureus 数量的线性关系见图9。

图9 化学发光强度与S.aureus 数量的线性关系Fig.9 Linear relationship between chemiluminescence intensity and the number of S.aureus
将Fe3O4@Van 与不同浓度的S.aureus 孵育,随后将Fe3O4@Van-S.aureus 的复合沉淀物分散在H2O2中。细菌所分泌的过氧化氢酶可分解体系中的H2O2,待反应完全后,吸取上述混合溶液加入化学发光体系中,利用超微弱化学发光检测仪记录对应化学发光强度。在一定范围内,细菌数量越多,所产生的过氧化氢酶就越多,对化学发光体系的抑制作用就越强。因此,可以根据此变化建立化学发光强度与细菌浓度的变化关系。如图9A 所示,S.aureus 浓度在10~105CFU/mL 之间与化学发光强度存在良好的线性关系,其R2=0.985 6。同时可使用智能手机记录化学发光的变化情况,对应细菌数量下的化学发光强度变化(图9B)。
随后考察了该检测方法对于不同菌种的特异性。细菌特异性检测见图10。

图10 细菌特异性检测Fig.10 Bacterial specificity
由图10 可知,只有当S.aureus、耐甲氧西林金黄色葡萄球菌(MRSA)等革兰氏阳性菌存在时才会使得化学发光强度明显降低,而当大肠杆菌(E.coli)、耐卡那霉素大肠杆菌(KREC)以及沙门氏菌(Salmonella)等革兰氏阴性菌存在时对化学发光强度的影响并不明显。这是由于Fe3O4@Van 中所修饰的万古霉素对革兰氏阳性菌具有特异性识别能力,在实际检测过程中可有效区分革兰氏阴性与阳性细菌,实现对革兰氏阳性细菌的特异性检测。
2.6 实际样品中的细菌检测
为了进一步评估Fe3O4@Van 在实际样品中检测S.aureus 的准确性和可靠性,对牛奶以及矿泉水进行加标回收实验,结果见表1。
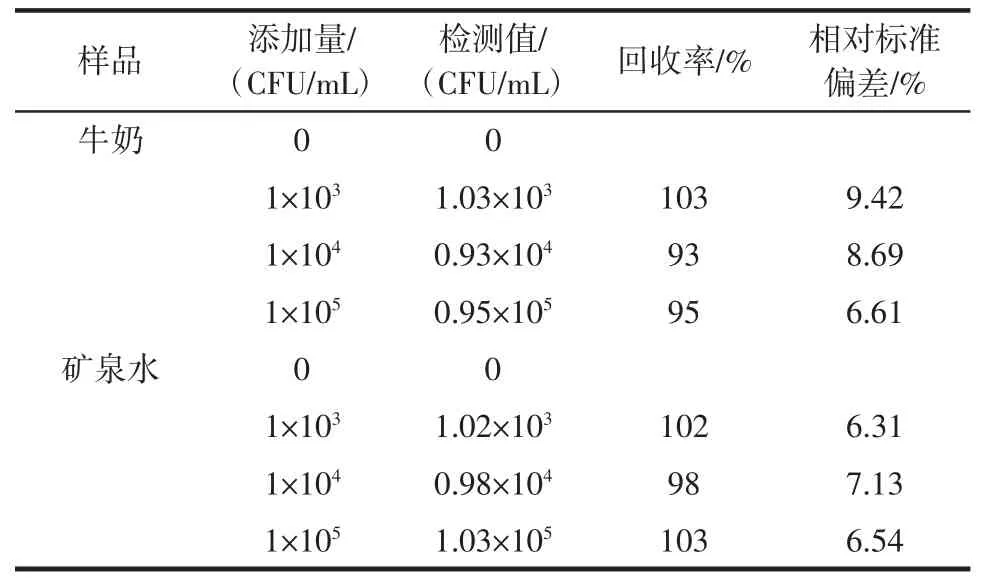
表1 牛奶和矿泉水中S.aureus 的检测Table 1 Detection of S.aureus in milk and mineral water
由表1 可知,Fe3O4@Van 对牛奶中S.aureus 的回收率为93%~103%,对矿泉水中S.aureus 的回收率为98%~103%。以上实验数据表明本方法对检测牛奶以及矿泉水等实际样品中的S.aureus 具有较好的可行性。
2.7 光热杀菌
为了检验Fe3O4@Van 的光热杀菌效果,采用传统的平板涂布法通过菌落计数的方式探究其对S.aureus 的抗菌能力。Fe3O4@Van 对S.aureus 的抗菌能力见图11。

图11 Fe3O4@Van 对S.aureus 的抗菌能力Fig.11 Inhibitory effect of Fe3O4@Van on S.aureus
由图11A 可知,S.aureus 在有/无近红外808 nm激光照射下,其菌落数量并无明显差异,说明实验条件温和,激光照射本身并不影响S.aureus 的生物活性。在无近红外808 nm 激光照射的情况下,经磁分离得到的S.aureus+Fe3O4@Van 复合物经培养后可以在营养琼脂平板上观察到大量的菌落,其菌落数量与空白组相差无几,表明Fe3O4@Van 对S.aureus 的生长几乎没有抑制作用。但经过近红外808 nm 激光照射后,S.aureus+Fe3O4@Van 组中的S.aureus 几乎全部被杀死。由图11B 可知,通过统计分析不同处理后的菌落数量,计算得出Fe3O4@Van 对S.aureus 的光热抗菌效率为98.6%,表明具备优异光热性能的Fe3O4@Van 可以实现对S.aureus 的灭活,可有效避免细菌的二次污染。
3 结论
本研究在Fe3O4NPs 的基础上进一步修饰革兰氏阳性菌特异性识别分子万古霉素,形成Fe3O4@Van,从而增强Fe3O4@Van 与细菌的结合能力,通过优化H2O2浓度、实验温度以及孵育时间确定了以Fe3O4@Van 的化学发光强度为信号对S.aureus 检测的最佳条件,研究结果显示,Fe3O4@Van 对S.aureus 检测的最优条件:H2O2浓度为0.8 mmol/L、实验温度为25 ℃以及孵育时间10 min。在该条件下,常见的食源性致病菌S.aureus在浓度10~105CFU/mL 之间与化学发光强度存在良好的线性关系。在对牛奶以及矿泉水的加标回收实验中回收率为93%~103%,表明其在实际样品中具有较好的应用性。同时,具备优异光热性能的Fe3O4@Van 可实现对S.aureus 的原位杀死,抗菌效率高达98.6%。本平台的成功构建为食品安全检测与质量控制研究提供了新的策略。

