IL-13a1及IL-13Ra2在特应性皮炎患者皮损中的表达*
倪慕兰 李燕维 刘 斌
福建中医药大学附属福鼎医院病理科,福建省福鼎市 355200
特应性皮炎(Atopic dermatitis,AD)是一种常见的慢性复发性的皮肤炎症性病变。其发病机制尚未明确,目前认为主要与遗传和异常免疫应答有关。近年来研究发现AD患者血清IL-13水平升高,可能在AD的发病过程中起关键作用[1]。IL-13发挥生物学功能是通过与相应受体相结合形成受体复合物后,促使下游基因转录,参与调节免疫应答。本研究采用免疫组化方法,检测IL-13的特异性受体(IL-13Ra1和IL-13Ra2)在AD患者皮损区、非皮损区和正常人皮肤组织中的表达,以进一步探讨其在发病机制中的作用及临床意义。
1 对象与方法
1.1 研究对象 依据Hanifin-Rajkal诊断标准,选取我院门诊确诊的35例AD患者作为观察对象,其中21例为进行期,14例为静止期。男18例,女17例;年龄12~85岁,平均年龄(27±12.7)岁。所选病例在皮肤活检时至少2个月以上未用过免疫抑制剂、糖皮质激素、抗组胺药等相关治疗。对照组15例正常人皮肤标本选用非皮肤病变手术切除皮肤组织,其中男8例,女7例;年龄20~64岁,平均年龄(32±11.3)岁。
1.2 取材及标本处理 每例AD患者于典型皮损区以及至少距离5cm外观无异常处(作为非皮损区)分别取活检;15例正常人皮肤组织标本选用整形手术等非皮肤病变手术切除皮肤组织。选取组织均经10%中性福尔马林固定,常规脱水浸蜡,石蜡包埋。
1.3 实验方法 石蜡包埋标本常规切片HE染色后由两位高年资病理医师进行重新核定。3μm厚连续切片,采用EnVision两步法染色,具体操作步骤严格按试剂说明书进行,用PBS代替一抗作阴性对照,用已知阳性组织切片作阳性对照。兔抗人IL-13Ra1多克隆抗体及兔抗人IL-13Ra2多克隆抗体均购自abcam公司。免疫组化EnVision试剂盒及其他试剂购自DAKO公司。
1.4 判定标准 IL-13Ra1及IL-13Ra2均以细胞膜或细胞浆出现棕黄色颗粒为阳性表达。采用双盲法依据阳性细胞比例和染色强度进行半定量评估:先按阳性细胞比例将无、1%~25%、26%~50%、51%~75%、76%~100%分别计为0~4分;再按染色强度将无、弱、中、强分别计为0~3分,其中不着色0分,黄色1分,棕黄色2分,黄褐色3分;将两项得分相乘后得0~2分为(-),3~5分为(+),6~9分为(++),10~12分以上为(+++);其中-~+判定为阴性,++~+++判定为阳性。
1.5 统计学方法 用SPSS26.0软件进行统计学分析和处理。组间表达差异采用χ2检验或Fisher精确检验。以P<0.05为差异有统计学意义。
2 结果
2.1 IL-13Ra1和IL-13Ra2在正常人及AD患者皮肤组织中的表达 二者在正常人皮肤及AD患者非皮损区仅于基底层部分角质形成细胞的胞浆内见少量表达(见图1),在AD患者皮损区的基底层角质形成细胞的胞浆内强表达,且IL-13Ra1和IL-13Ra2阳性表达范围扩大到表皮全层以及真皮乳头层(见图2~3)。统计学分析结果显示:IL-13Ra1在AD患者皮损区中阳性率为88.6%(31/35),IL-13Ra2在AD患者皮损区中阳性率为80.0%(28/35),二者非皮损区和正常人皮肤相比呈显著表达高(P<0.01);在非皮损区和正常人皮肤之间无明显差异(P>0.05)。见表1。
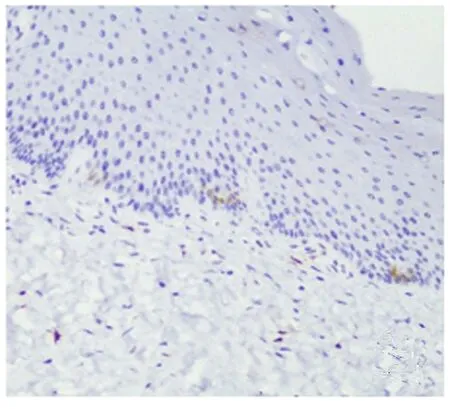
图1 IL-13Ra1在正常人皮肤基底层部分角质形成细胞胞浆内低表达(IHC×200)

图2 IL-13Ra1在AD患者皮损区的表皮全层以及真皮乳头层强表达(IHC×200)

图3 IL-13Ra2在进行期AD患者皮损区的表皮全层以及真皮乳头层强表达(IHC×200)

表1 IL-13Ra1及IL-13Ra2在AD患者皮损区、非皮损区和正常人皮肤组织中的表达[n(%)]
2.2 进行期和静止期AD患者皮损区IL-13Ra1和IL-13Ra2的表达 IL-13Ra2在进行期AD皮损区阳性表达率为95.2%(20/21),而静止期AD皮损区为57.1%(8/14),IL-13Ra2在进行期AD的表达高于静止期(P<0.05);而IL-13Ra1在进行期和静止期AD皮损区中表达无明显差异(P>0.05)。见表2。

表2 IL-13Ra1及IL-13Ra2在进行期和静止期AD患者皮损区中的表达
3 讨论
AD可发生于各个年龄段,其中以儿童发病率最高,主要表现为反复发作的瘙痒、皮肤干燥和湿疹[2]。进行期AD患者常有明显的瘙痒症状,且病情反复迁延难愈,从而严重影响生活质量和身心健康。AD的发病机制尚未明确,已报道辅助性T淋巴细胞亚群Th1/ Th2功能失衡导致的异常免疫应答是其发病的重要原因,也就是Th2 型炎症是AD的基本特征[3]。进一步研究指出IL-13作为一种由活化的CD4+Th2分泌的多效细胞因子,与其受体结合后激活细胞内下游信号通路,抑制Th1 细胞分化、诱导IgE合成,在AD患者皮损形成中的起关键作用。在进行期AD患者的皮损中,IL-13优先使得Th2 细胞聚集,参与AD发病;在静止期,IL-13则与IFN-r产生协同作用,使得慢性炎症细胞在真皮层聚集,从而导致AD的慢性化[4]。
IL-13生物学功能的基础是与特异性受体结合,即与IL-13Ra1或IL-13Ra2结合并与IL-4Ra、IL-2Rr共同组成受体复合物。目前对IL-13特异性受体的报道相对较少,IL-13Ra1和IL-13Ra2属于促红细胞生成素受体家族中的异源二聚体受体,与IL-13特异性结合后,激活STAT6信号途径促使下游基因转录,诱导Th2细胞极化,参与AD发病和疾病进展[5]。Wongpiyabovorn等[6]在6例AD患者皮肤角质形成细胞中IL-13受体mRNA的过表达,并检测出STAT6通路的激活和多种促Th2分化因子的产生,从而导致免疫失衡介导AD皮损的形成。本研究通过特异性抗体,采用免疫组化方法明确了IL-13Ra1和IL-13Ra2受体蛋白在皮肤中表达的表达模式:少量表达在正常皮肤和AD患者非皮损区基底层角质形成细胞胞浆内,而在AD患者皮损区的基底层角质形成细胞的胞浆内强表达,并且表皮全层以及真皮乳头层均检测出受体表达。IL-13Ra1和IL-13Ra2受体蛋白在皮损区表达强度的增加和表达范围的扩大,提示IL-13受体蛋白其在AD皮损形成中发挥重要的作用。在进一步的实验分析中,笔者发现IL-13Ra2在进行期AD皮损区阳性表达高于静止期,提示IL-13Ra2与AD疾病活动相关。IL-13Ra2是一种调节型的受体,当受到IFN-r等刺激因子后可以迅速地转运到细胞膜上,增强IL-13的信号转化,从而促进Th2型炎症的发生[7]。由此推测,IL-13Ra2可作为免疫学指标反映病人的疾病活动性,也提出作为AD进行期药物治疗的一个新靶点的可能。
在药物治疗上,除了传统的糖皮质激素和免疫制剂外,AD生物制剂的免疫靶向治疗也越来越热门。目前IL-4Ra拮抗剂Dupilumab已经美国食品药品管理局获批用于中重度AD、哮喘等过敏性疾病。临床试验显示,Dupilumab可显著改善中—重度青少年AD患者的症状,且具有可接受的安全性[8]。针对IL-13Ra1和IL-13Ra2的生物制剂(Lebrikizumab和Tralokinumab)也在进一步的研发中[9]。本试验明确了IL-13Ra1和IL-13Ra2受体在AD皮损区高表达,不仅证实了特异性受体在AD发生过程中起着重要作用,而且也为高选择的特异性的拮抗IL-13生物制剂治疗中重度AD提供一定的理论基础。

