影响骨质疏松症并脊柱转移瘤RFA联合PVP术后复发的因素研究*
张 显
河南大学第一附属医院,河南省开封市 475000
脊柱是恶性肿瘤转移的好发部位,乳腺癌、肺癌、前列腺癌、胃肠道肿瘤等恶性肿瘤均容易发生脊柱转移,据统计,30%~70%的恶性肿瘤患者存在脊柱转移[1]。脊柱转移瘤临床表现为进行性加剧的腰背痛,脊柱不稳,随着病情进展可伴随椎体病理性骨折,脊髓受压导致感觉和运动功能障碍、大小便失禁甚至瘫痪,严重影响患者的生活质量和生命安全。脊柱转移瘤患者常出现成骨细胞和破骨细胞活动异常,尤以破骨细胞活动加快为主,导致骨质吸收增多,致骨量丢失而出现骨质疏松[2]。经皮椎体成形术(Percutaneous vertebroplasty, PVP)可以改善患者椎体的病变情况,缓解疼痛,射频消融术(Radio frequency ablation, RFA)是将射频电极针插入椎体肿瘤内部,能够通过高温将椎体内的癌细胞灭活[3]。2种手术方法联合使用,能够改善患者脊椎病变,缓解疼痛,被广泛应用于骨质疏松并脊柱转移瘤的治疗中,然而文献报道中存在术后复发的情况[4]。因此,研究RFA联合PVP治疗骨质疏松并脊柱转移瘤术后复发的危险因素,对于提高其治疗效果具有重要意义。鉴于此,本研究特对210例骨质疏松并脊柱转移瘤RFA联合PVP术后患者的资料进行回顾,统计分析影响术后复发的危险因素,进而提出预防建议,以降低复发率。
1 资料与方法
1.1 临床资料 本研究经医院伦理委员会批准,回顾2016年9月—2019年9月在医院采用RFA联合PVP术治疗的210例骨质疏松并脊柱转移瘤患者的资料。纳入标准:原发肿瘤明确,病理活检显示骨质疏松并脊柱转移瘤;影像学检查显示转移病灶位于胸椎、腰椎、骶椎;术前、术后及随访资料完整者。排除标准:多发性骨髓瘤、淋巴转移瘤患者;预期寿命<6个月患者;原发病灶不明确患者;伴有神经症状甚至截瘫、严重畸形、脊柱失稳患者。210例患者中男121例,女89例;年龄38~76岁,平均年龄(58.37±9.51)岁;骨质疏松病程2~15年,平均骨质疏松病程(8.24±1.30)年;原发肿瘤类型:乳腺癌82例,肺癌61例,结直肠癌40例,其他27例;原发肿瘤手术134例,原发肿瘤未手术76例;原发肿瘤分化程度:低分化49例,中分化64例,高分化97例;受累椎体位置:胸椎97例,腰椎54例,骶椎50例,胸腰椎9例;受累椎体个数:单个134例,多个76例。所有患者均为RFA联合PVP术后患者,根据X线、MRI检查结果显示的肿瘤位置,在可视条件下,将骨穿刺针经脊椎弓根穿刺到肿瘤部位后,抽出穿刺针针芯,固定骨穿刺外管作为操作通道,将射频消融仪器的电极沿着通道植入患者肿瘤位置(RFA参数:发生器功率为150W,工作温度为70℃,持续工作时间为15min)。
1.2 方法 骨质疏松并脊柱转移瘤患者RFA联合PVP术后复发判断方法:复发判断方法[5]:经MRI和CT扫描,病灶继续侵犯相邻椎体;原发椎体内出现转移性脊髓损伤;侵犯硬膜囊前方或侧前方;侵犯相邻脏器或血管。将术后复发的记为复发组,否则记为未复发组。危险因素分析方法:归纳可能影响骨质疏松并脊柱转移瘤患者RFA联合PVP术后复发的因素,包括性别、年龄、体质量指数(BMI)、骨质疏松病程、遵医嘱接受抗骨质疏松治疗、原发肿瘤类型(乳腺癌、肺癌、结直肠癌、其他)、原发肿瘤手术、原发肿瘤分化程度(低分化、中分化、高分化)、受累椎体位置(胸椎、腰椎、胸腰椎、骶椎、颈椎、尾椎)、受累椎体个数(单个、多个)、椎体内病灶、瘤体位置靠近椎体后壁、内脏转移、脊柱外骨转移、术中出血、手术时间、术后并发症、术后运动功能障碍,将其作为自变量(X),对其进行赋值,结果见表1;将术后复发作为因变量(Y),复发为1,未复发为0,分析影响因素。

表1 骨质疏松并脊柱转移瘤患者RFA联合PVP术后复发的自变量赋值结果
1.3 观察指标 (1)术后复发率;(2)对比复发组和未复发组自变量构成比;(3)术后复发的危险因素及比值比(OR)。
1.4 统计学方法 用SPSS26.0软件分析所得数据,计数资料以n(%)表示,以χ2检验两样本差异,以Logistic回归分析探讨影响因素,P<0.05为差异有统计学意义。
2 结果
2.1 骨质疏松并脊柱转移瘤患者RFA联合PVP术后复发率统计 随访6个月,分别于术后1~2个月复发6例,术后3~4个月复发13例,术后5~6个月复发4例,本组病例中共有23例患者复发,复发率为10.95%(23/210)。
2.2 复发组和未复发组自变量构成比对比 复发组未遵医嘱接受抗骨质疏松治疗、原发肿瘤低分化、多个受累椎体、内脏转移、脊柱外骨转移、术后并发症构成比均高于未复发组(P<0.05),见表2。

表2 复发组和未复发组自变量构成比对比[n(%)]
2.3 Logistic回归分析 经Logistic回归分析可知,原发肿瘤低分化、内脏转移、多个受累椎体、未遵医嘱接受抗骨质疏松治疗、脊柱外骨转移、术后并发症均是影响骨质疏松并脊柱转移瘤RFA联合PVP术后复发的独立危险因素,见表3。
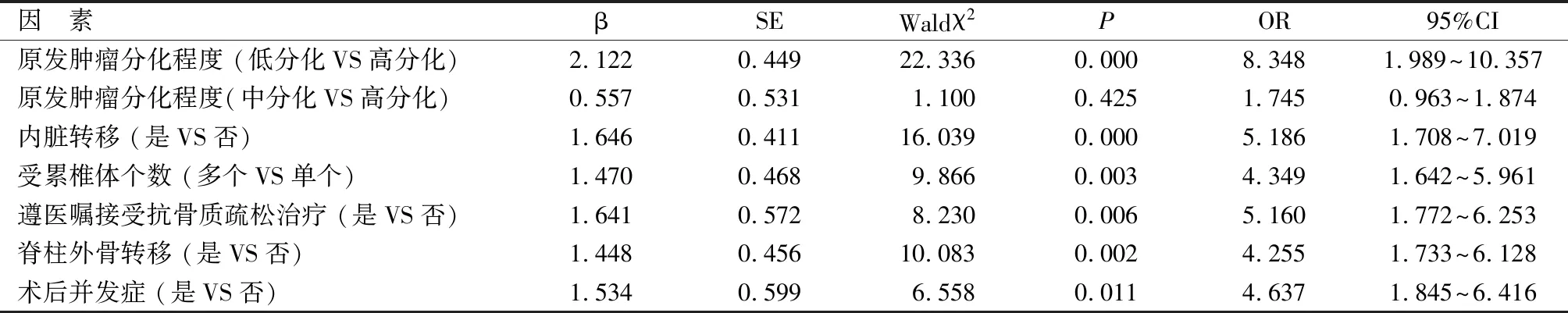
表3 Logistic回归分析
3 讨论
3.1 骨质疏松并脊柱转移瘤患者RFA联合PVP术后复发情况、危害及危险因素分析的意义 本研究表明,随访6个月,本组病例中共有23例患者复发,复发率为10.95%。陈水木[6]研究报道,脊柱转移瘤患者RFA联合PVP术后复发率为11.11%,与本研究结果相似,表明骨质疏松并脊柱转移瘤患者术后存在一定的复发风险。骨质疏松并脊柱转移瘤患者多属恶性肿瘤晚期,随着病情进展可伴随椎体病理性骨折,脊髓受压导致感觉和运动功能障碍,加剧患者腰背痛,严重影响患者生活质量[7]。因此,了解骨质疏松并脊柱转移瘤患者RFA联合PVP术后复发的危险因素,从术前、术中以及术后进行严格控制,提高手术质量以及做好术后防护措施,可以降低骨质疏松并脊柱转移瘤患者术后复发率,对减少患者痛苦以及医疗费用支出具有重要意义。
3.2 原发肿瘤低分化、多个受累椎体、未遵医嘱接受抗骨质疏松治疗的影响及防控建议 本研究结果显示,复发组原发肿瘤低分化、多个受累椎体、未遵医嘱接受抗骨质疏松治疗为术后复发的独立危险因素。原发肿瘤低分化表明肿瘤呈现的恶性程度高,生长速度快,身体中残留的癌细胞可能没有完全杀灭,当机体免疫力下降时,癌细胞即可侵袭正常组织器官,导致患者复发。骨质疏松并脊柱转移瘤患者多个受累椎体累及范围广泛,呈跳跃性椎体和附件同时受累,椎体压缩呈楔形,肿瘤位置较为隐匿,可能会导致射频电极不能近距离接触肿瘤,影响癌细胞灭活效果,引起术后复发。骨质疏松症病程漫长,治疗过程用药复杂、次数频繁,缺乏快速疗效,导致部分患者依从性差,不能遵医嘱接受抗骨质疏松治疗,进而导致骨代谢异常,病变发展至脊髓,容易导致肿瘤侵袭,引起复发。因此,针对原发肿瘤低分化、多个受累椎体、未遵医嘱接受抗骨质疏松治疗等因素,务必对患者肿瘤病情进行综合评估,依据患者病情制定治疗方案,术前给予营养支持,增强患者机体免疫功能,仔细检查肿瘤分布位置,充分灭活椎体内残留癌细胞,并要求患者严格遵医嘱接受抗骨质疏松治疗,从而有效预防肿瘤复发。
3.3 内脏转移、脊柱外骨转移的影响及防控建议 本研究结果显示,复发组内脏转移、脊柱外骨转移为术后复发的独立危险因素。骨质疏松并脊柱转移瘤患者术后重要器官转移可能会导致转移病灶无法控制,癌细胞进入内脏实质,增殖成继发肿瘤,导致患者复发。骨质疏松并脊柱转移瘤患者机体肿瘤细胞经血行转移至骨组织引起骨损害,破坏骨组织,释放出骨组织中贮存的多种生长因子,使肿瘤细胞不断增生,从而导致患者复发。因此,针对内脏转移、脊柱外骨转移患者应采取综合性治疗,在手术治疗的基础上给予相关药物治疗,并对原发肿瘤进行分子靶向治疗,同时肿瘤内科、脊柱外科以及介入外科等科室应当进行联合会诊治疗,预防内脏转移和脊柱外骨转移,从而防止复发。
3.4 术后并发症的影响及防控建议 本研究结果显示,复发组术后并发症为术后复发的独立危险因素。骨质疏松并脊柱转移瘤患者RFA联合PVP术后可能会出现伤口渗血、脊髓损伤、脊柱疼痛加重等并发症,而脊柱血运非常丰富,肿瘤清除困难,肿瘤可能会侵及血管周围和正常脏器等组织器官,可能会引起术后复发。因此,根据骨质疏松并脊柱转移瘤患者病情预期可能会出现的并发症,并制定相应的处理方案,术后定期复查,有效预防并发症的发生,防止肿瘤复发。
综上所述,骨质疏松并脊柱转移瘤患者RFA联合PVP术后仍然存在一定的复发风险,原发肿瘤低分化、多个受累椎体、未遵医嘱接受抗骨质疏松治疗、内脏转移、脊柱外骨转移、术后并发症均是影响RFA联合PVP术后复发的独立危险因素,建议术前全面评估患者病情,选择合适治疗方案,术后给予药物治疗提高机体免疫力,务必遵医嘱接受抗骨质疏松治疗,定期检查,增强预防意识。

