SSTR亚型与胃肠胰神经内分泌肿瘤病理特征及预后关系分析
陈贤翔
漳州正兴医院,福建省漳州市 363000
神经内分泌肿瘤(NENs)起源于神经内分泌细胞和肽能神经元,具有一定的分泌特征,可产生一系列多肽激素,能从惰性、生长缓慢进展至高转移性、明显恶性特征的一种高度异质性肿瘤[1]。NENs以消化系的肿瘤类型最为常见,胃肠及胰腺发病者占65%~75%[2]。过去因技术限制认为NENs罕见,并以“类癌”称呼,但随着医疗水平不断发展,病理学诊断技术提升及对该疾病的认识加深,近几年NENs的检出率逐年升高,有研究报道过去30年其发病率增加了5倍[3]。探寻影响其不良预后的危险因素,制定科学的治疗方案,对提高肿瘤患者的生存率至关重要。生长抑素受体(SSTR)是生长抑素和细胞膜上的G蛋白偶联而成,具有抑制激素分泌和抑制细胞增殖的特性[4]。SSTR共5种亚型,其中SSTR2和SSTR5多在胃肠及胰腺中表达[5]。近年有关胃肠胰神经内分泌肿瘤(GEP-NENs)的研究日益增加,但多集中于病理特征与预后的相关性,针对SSTR亚型与胃肠胰NENs病理特征及对患者预后影响的关系研究相对较少。本研究旨在分析SSTR2和SSTR5与GEP-NENs病理特征及预后关系。
1 资料与方法
1.1 一般资料 选取2016年1月—2021年1月期间我院收治的胃肠胰神经内分泌肿瘤62例。纳入标准:患者均经病理或活检确诊[6];研究开始前未进行任何形式的治疗措施;临床资料及随访资料详细记录且完整。排除标准:伴有其他器官恶性肿瘤者;有严重心肺疾病或胃肠功能障碍者;确诊时存在严重感染者;存在血液系统疾病或免疫缺陷史。患者中男46例、女16例,年龄24~75岁,平均年龄(51.29±11.86)岁;肿瘤直径0.3~9.5cm,平均直径(1.45±0.47)cm,肿瘤发于胃部患者18例,胰腺22例,直肠13例,十二指肠9例。
1.2 方法
1.2.1 SSTR2、SSTR5阳性检测。采集患者新鲜病理组织,采用石蜡切片、5%双氧水—甲醇水溶液室温孵育20min,采用山羊血清封闭10min,于湿盒中加入SSTR2、SSTR5的抗体,室温孵育1.5h,滴入生物素标记的辣根酶二抗孵育0.5h,DAB显色,苏木素对比染色细胞核,按照75%、95%、100%梯度进行乙醇脱水,每个梯度2min,再以二甲苯透明,中性树脂封片后即可镜检;阳性判断标准[7]:低倍镜观察大体着色情况,再高倍镜下随机计数5个视野(×200),每个视野计数200个肿瘤细胞,根据阳性细胞数及着色强度计算阳性表达率,(1)阳性细胞数<5%为0分,5%~25%为1分,26%~50%为2分,51%~75%为3分,76%~100%为4分;(2)无色0分,淡黄色1分,棕黄色2分,棕褐色3分;由2位病理医师在未知肿瘤级别情况下阅片;两者计分相乘为阳性等级,≤4分为阴性,5~12分为阳性,阳性表达率=阳性表达患者例数/总例数×100%。
1.2.2 临床病理特征收集。收集患者病理特征资料,包括性别、年龄、肿瘤直径、肿瘤部位、分化程度、脉管神经侵犯情况、淋巴结转移、远处转移、TNM分期。
1.2.3 治疗方案。62例GEP-NENs患者中,23例行外科手术加术后化疗,30例行内镜下微创手术,8例行化疗,1例因经济原因选择姑息保守支持治疗,因手术方式及化疗方案的差异未进行预后生存分析。
1.2.4 预后随访。自纳入研究日起以电话方式进行随访,月度为单位,2个月随访1次,随访终止日期至2022年12月,随访时间24~60个月,以随访截止日及全因死亡或失访为随访终点,随访患者中肿瘤死亡15例。
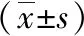
2 结果
2.1 SSTR2、SSTR5与GEP-NENs病理特征的关系 SSTR2、SSTR5表达率在不同性别、年龄、肿瘤部位、是否脉管神经侵犯、是否远处转移患者中比较,差异无统计学意义(P>0.05),SSTR2阳性率在肿瘤直径>2cm、低分化、淋巴结转移、TNM分期中Ⅲ+Ⅳ期患者中的占比低于肿瘤直径≤2cm、高及中分化、淋巴结未转移、TNM分期中Ⅰ+Ⅱ期患者(P<0.05),SSTR5阳性率在肿瘤直径>2cm、低分化、淋巴结转移、TNM分期中Ⅲ+Ⅳ期患者中的占比低于肿瘤直径≤2cm、高及中分化、淋巴结未转移、TNM分期中Ⅰ+Ⅱ期患者(P<0.05),见表1。

表1 SSTR2、SSTR5与GEP-NENs病理特征关系[n(%)]
2.2 影响GEP-NENs预后的Cox比例风险回归分析 将患者肿瘤死亡设置为因变量,患者一般资料作为分类变量,数据录入SPSS26.0软件进行多因素Cox比例风险回归分析,结果显示,肿瘤直径>2cm、低分化程度及SSTR2、SSTR5的阳性低表达是影响患者肿瘤死亡的独立风险因素(P<0.05),见表2。

表2 影响GEP-NENs预后的Cox比例风险回归分析
3 讨论
NENs是异质性肿瘤,可由任何器官的神经内分泌细胞引起,全身均有生长的可能性,最常见于胃、肠及胰腺[8]。GEP-NENs临床表现复杂多样,可有消化道梗阻症状,或表现为腹痛、恶心和贫血等非特异性症状,或可无症状带瘤多年,多数患者因其无特异性症状而延误最佳就诊时机,增加了肿瘤转移风险,导致预后极差[9-10]。SSTR可介导生长抑素和癌细胞受体,激活细胞毒效应,杀死肿瘤细胞[11]。探究SSTR与GEP-NENs病理特征及预后的关系对提高患者生存周期、改善预后具有重要意义。
本研究发现SSTR2、SSTR5阳性率与患者肿瘤直径、分化程度、淋巴结转移、TNM分期等病理特征关系紧密,提示SSTR2、SSTR5低表达可能会促进肿瘤细胞增殖、迁移。分析其原因,SSTR激活后可直接或间接抑制细胞增殖、诱导其凋亡,还可激活蛋白酪氨酸磷酸酶,使酪氨酸磷酸酶去磷酸化失活,抑制MAPK信号通路进而抑制细胞增殖。此外SSTR能抑制激素分泌,下调血管生成因子,促进肿瘤旁血管收缩从而达到抑制细胞生长的目的,而且肿瘤直径越大、分化程度越低、恶性程度越严重,则SSTR阳性率越低[12]。有研究[13]显示,生长抑素与SSTR亚型的亲和力不同,其中SSTR2的亲和力最强,除了在正常组织中分布较为广泛外,在多种类型的实体瘤中亦可过度表达,80%~90%的肺神经内分泌肿瘤都表达SSTR,且主要是SSTR2,分化好的肺神经内分泌瘤相比于未分化的SSTR2表达密度高。易维等[14]通过对颅咽管瘤患者的研究发现,SSTR2的表达与肿瘤的恶性程度与复发率紧密相关。本研究中SSTR2和SSTR5在中高分化程度、Ⅰ+Ⅱ期的阳性率明显高于低分化程度及Ⅲ+Ⅳ期,预示着SSTR2和SSTR5的表达可能作为GEP-NENs的潜在预后指标。因此,本研究将患者不良预后设置为因变量,患者一般资料作为分类变量,通过Cox比例风险回归分析探究影响GEP-NENs预后的因素,结果显示,肿瘤直径>2cm、低分化程度及SSTR2、SSTR5的阳性低表达是影响患者肿瘤死亡的独立风险因素。有研究[15]显示,所有GEP-NENs患者中,SSTR2、SSTR5是其独立预后的影响因素,且SSTR的阳性表达与EP-NENs的发生、发展及预后密切相关。
综上所述,SSTR2和SSTR5在GEP-NENs中表达与患者肿瘤直径、肿瘤分化程度、淋巴结转移及TNM分期有一定关系,且SSTR2和SSTR5阳性率低是影响患者不良预后的独立风险因素,可作为判断GEP-NENs患者预后的重要临床指标,SSTR2和SSTR5在GEP-NENs的表达与预后的作用为生长抑素及类似物对肿瘤的治疗提供可靠的证据。

