基于中性粒细胞外诱捕网探讨硫化氢对脓毒症心肌病的影响及作用机制
刘紫晨
石河子大学医学院第一附属医院,新疆石河子市 832000
脓毒症心肌病是继发于脓毒症的严重器官功能障碍,其发病机制复杂多样,包括炎症反应失衡、线粒体功能损伤、氧化应激、钙调节障碍、自噬调节紊乱和内皮功能障碍等[1]。组织器官遭受急性感染或损伤时,中性粒细胞作为先天性免疫的重要组成部分,早期会大量聚集在病灶处发挥独特的免疫作用[2]。中性粒细胞参与感染所致的机体损伤时,所涉及的机制多种多样,除吞噬、脱颗粒,诱导ROS产生外,还介导形成诱捕网,该网状结构被称为中性粒细胞外诱捕网 (Neutrophil extracellular traps,NETs),已有研究表明细菌释放的内毒素和机体产生炎症细胞因子在脓毒症心肌抑制期间起着关键作用[3-5],NETs作为一种潜在的抗菌机制,在脓毒症心肌病中的作用值得深入探讨及研究。
硫化氢(H2S)是一种气体生物介质,具有调节心血管、神经、免疫等系统的重要功能[6-7]。NaHS是一种外源性H2S供体,可以提高内源性H2S水平。既往研究表明,在大鼠脓毒症模型中,腹腔注射NaHS可以增加内源性H2S的合成,可通过抑制内质网应激相关自噬改善脓毒症引起的心功能障碍[8-9],但是体内H2S气体信号能否通过调控NETS影响脓毒症心肌病尚未明确。因此,本研究拟通过给予外源性H2S(NaHS)对CLP诱导的脓毒症大鼠进行干预处理,进一步展开心肌损伤相关酶CK-MB和LDH检测、心肌病理组织学染色、血清H2S含量测定和中性粒细胞外诱捕网形成相关因子(Gasdermin D, GSDMD)、髓过氧化物酶 (Myeloperoxidase, MPO)、瓜氨酸化组蛋白3 (Citrulline, CitH3)指标变化情况检测,基于NETs进一步探究H2S在脓毒症心肌损伤中作用。
1 材料与方法
1.1 材料
1.1.1 动物。清洁级雄性SD大鼠48只,6~8周龄,体质量(200±25)g,购自新疆恒朝生物科技有限公司,实验动物生产许可证编号:SCXK(豫)2020-0005,实验大鼠在我院动物中心进行饲养,由专人添加食物与水,饲养环境温度为20~25℃,环境湿度为50%~70%,室内通风良好,进食、饮水及笼内活动不设限。本实验的动物实验方案均得到石河子大学动物保护与使用委员会(中国石河子)的批准。
1.1.2 药物与试剂。NaHS购自宏昌生物科技有限公司,批号:240-778-0;GSDMD抗体(货号:TA4012 )来自上海Abmart公司、MPO抗体(货号:22225-1-AP1)、CitH3(货号:13754-1-AP)来自武汉三鹰公司; RIPA组织裂解液(货号:R0010)、Alexa Fluor 594标记的羊抗兔IgG荧光二抗(货号:K1034G-AF594)购自北京索莱宝生物技术公司;HRP标记山羊抗兔二抗(货号:GB23303)、抗β-actin抗体(货号:GB11001)购自武汉赛维尔生物技术有限公司;高敏型ECL化学发光检测试剂盒(货号:E412-01/02)购自南京诺唯赞公司;石蜡、苏木素、伊红购自国药集团;LDH乳酸脱氢酶试剂盒(货号:A0202-2)、CK-MB试剂盒(货号:H197-1-2)、内源性硫化氢检测(H2S)试剂盒(货号:BC2050)购自北京索莱宝生物公司。
1.2 方法
1.2.1 分组与模型。将48只SD大鼠适应性喂养1周,1周后按照体质量随机分为假手术组、 脓毒症模型组(模型组)、H2S给药组、H2S抑制剂组。模型组、H2S给药组、H2S抑制剂组采用盲肠结扎穿孔法制作大鼠脓毒症心肌病模型[10],具体方法如下:大鼠术前半天不予饲喂饲料,但不限制饮水。通过腹腔内注射10%的戊巴比妥钠(350mg/kg)进行麻醉,待大鼠麻醉后开腹暴露盲肠,在距离盲肠远端1/3处用4.0缝线结扎盲肠,用14号针对盲肠进行穿孔,并从穿孔处挤出少量粪便。然后将盲肠放回腹腔,逐层关腹。术后立即通过皮下注射生理盐水 (50ml/kg) 进行液体复苏。假手术组行盲肠结扎术,不进行穿孔,余操作与模型组一致。为保持实验的一致性,所有CLP手术均由具有手术执业资格的个体医生进行。
1.2.2 药物处理与取样。选取造模成功大鼠纳入实验,脓毒症模型组:采用盲肠结扎穿孔法(CLP)制备SIC大鼠模型;H2S给药组:CLP术后1h予以腹腔注射NaHS(8.9μmol/kg),按2ml/kg给药;H2S抑制剂组:CLP术前30min腹腔注射PAG(40mg/kg),按2ml/kg给药,术后1h予以腹腔注射NaHS(8.9μmol/kg);假手术组:予以同等剂量的0.9%氯化钠溶液腹腔注射。待术后各组大鼠实验观察点结束,即术后12h后麻醉取腹主动脉血4ml,使用离心机离心后取上清液,分装后置于-80℃冰箱,用于后续检测。各组大鼠采用三倍剂量的戊巴比妥钠安乐死后,留取心脏标本,用于制作染色病理切片及后续检测。取5ml中性粒细胞分离液加入15ml离心管中,然后缓慢加入4ml大鼠外周血,室温500g离心30min。可见离心管中两层环形盘状白色悬浮细胞层,下层为中性粒细胞层,缓慢吸出中性粒细胞悬液分装冷藏备用。
1.2.3 心肌组织HE染色。将包埋好的心肌石蜡包块使用切片机将组织切至5μm厚度,60℃烤片30min进行脱蜡,采用双蒸水水洗后行苏木素—伊红染色,梯度酒精脱水,透明,滴加适量中性树胶后加盖玻片封片,待切片干燥后在光学显微镜下观察并拍照保存。
1.2.4 心肌酶生化指标检测。取已经分装好的血清,操作步骤均按照对应试剂盒说明书方法操作。分别检测乳酸脱氢酶(LDH)和肌酸激酶同工酶(CK-MB)的变化水平。
1.2.5 内源性H2S水平检测。按照试剂盒中试剂标序分别加入各组,室温下混匀,随后静置30min,使用酶标仪检测各孔665nm波长下的吸光度,进一步计算得出H2S水平。
1.2.6 免疫荧光检测MPO含量。将已切好的切片60℃烘烤30min后进行脱蜡处理,使用枸橼酸钠缓冲液体系进行抗原修复,再用0.1% Triton X-100孵育20min破膜渗透,之后在10%山羊血清孵育20min,减少非特异性抗体结合位点,接着在室温下使用兔抗MPO室温下孵育4h,最后在暗盒中用羊抗兔IgG抗体孵育30min,DAPI封片,在荧光显微镜下观察和拍摄图像。
1.2.7 Western blot检测血清GSDMD、MPO、CitH3蛋白表达。取出中性粒细胞悬液,加入RIPA组织裂解液裂解30min,12 000r/min离心取上清液,测定蛋白浓度。蛋白加loading buffer后煮沸上样,进行凝胶电泳,使用湿转法转膜后,BSA封闭液封闭2h,使用GSDMD、MPO、CitH3(1∶10 00)抗体孵育置于4℃冰箱过夜处理,第2天回收洗净一抗后使用对应二抗室温孵育1h,随后滴加ECL发光液与膜作用后进行显影。
2 结果
2.1 HE染色 大鼠心肌HE病理染色结果显示,12h后假手术组所有大鼠心肌细胞排列整齐,长轴与心肌纤维方向一致;模型组可见心肌间质纤维结构紊乱,伴有不同程度的水肿、变性;与模型组相比,H2S给药组心肌纤维未见明显受损,病理损伤程度明显减轻;而H2S抑制剂组大鼠心肌的损伤程度较H2S给药组明显加重。见图1。
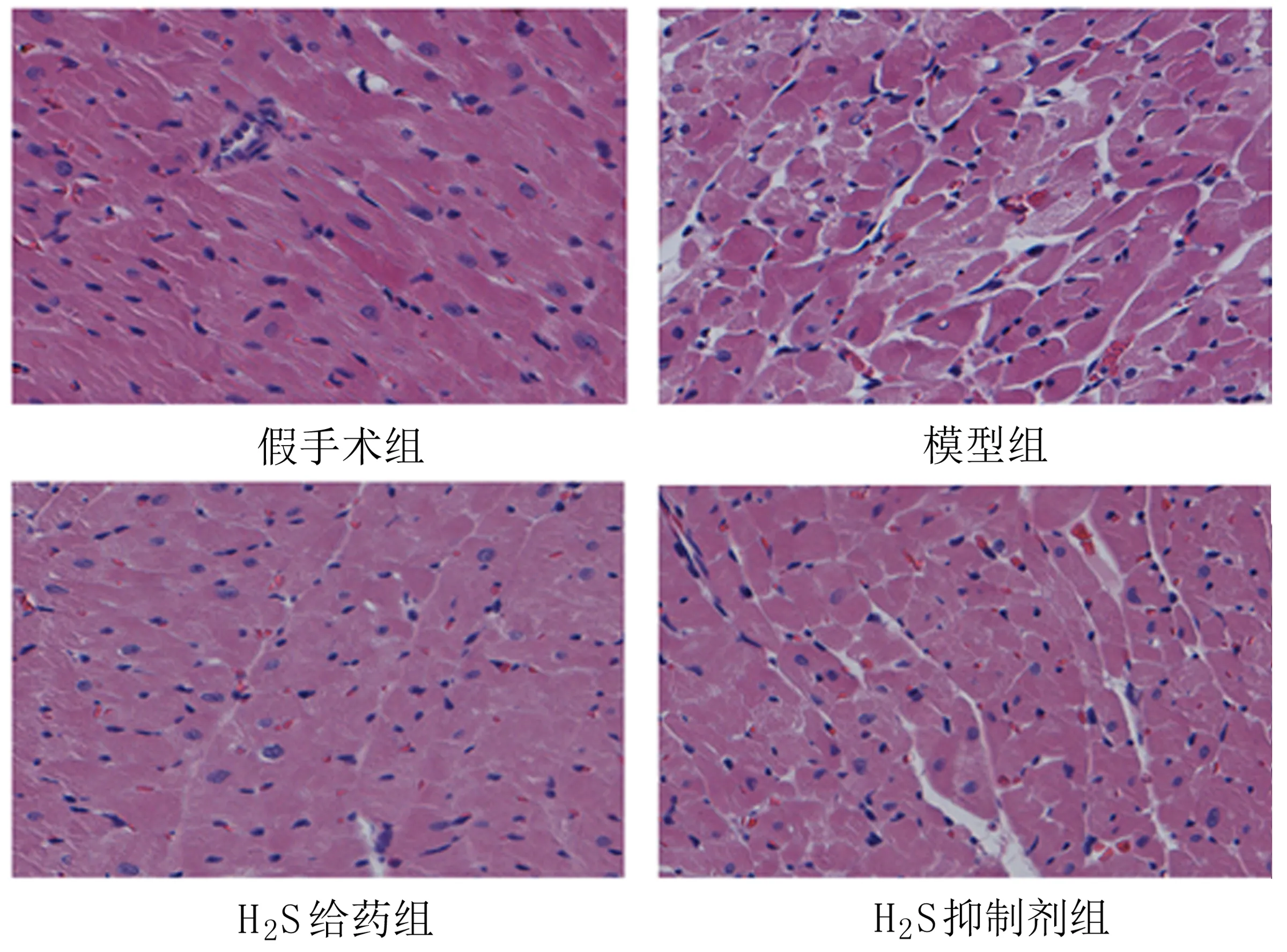
图1 各组大鼠心肌HE染色结果(400×)
2.2 CK-MB、LDH检测 血清CK-MB和LDH是评价心肌损伤的重要指标。通过试剂盒检测发现与假手术组相比,模型组CK-MB和LDH明显上升,予以腹腔注射NaHS后,二者的含量有所下降,同时,在补充H2S抑制剂后CK-MB和LDH含量较H2S给药组上升(P<0.05)。见图2。
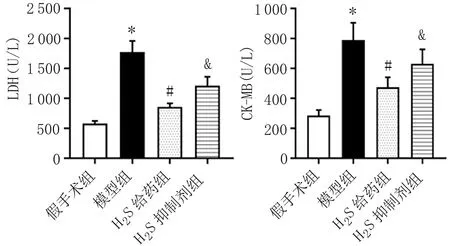
图2 各组大鼠血清LDH、CK-MB水平
2.3 H2S水平检测 经过统计分析发现,与假手术组相比,模型组大鼠血清H2S水平显著下降,与模型组对比,H2S给药组大鼠H2S含量有所升高,在予以补充H2S抑制剂PAG后,H2S含量下降(P<0.05)。见图3。
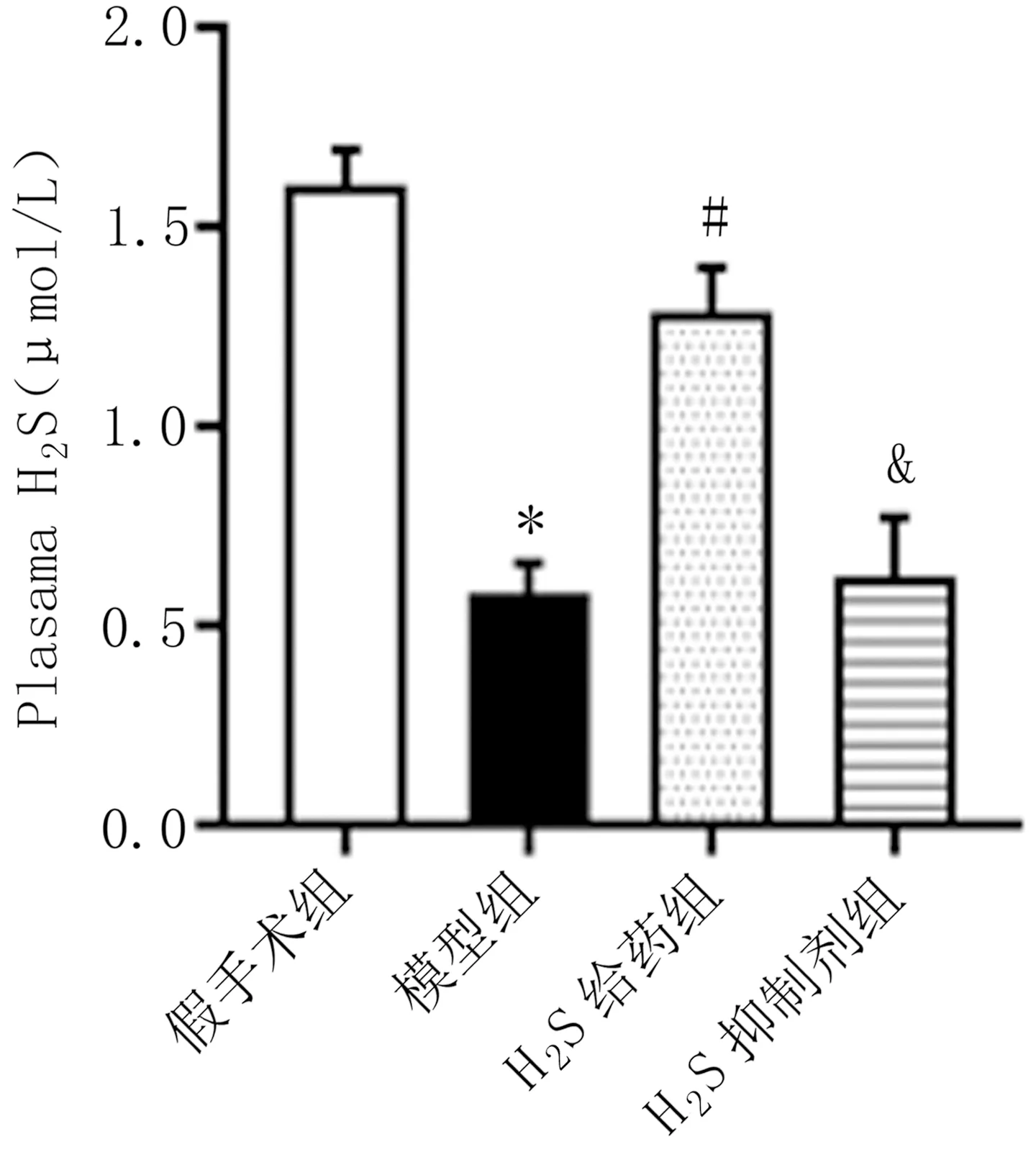
图3 各组大鼠血清H2S水平
2.4 MPO荧光定量 在大鼠心肌组织切片的MPO荧光切片中,笔者发现与假手术组相比,模型组MPO荧光密度增强,表达量明显上升,但给予外源性H2S补充剂NaHS后,发现MPO表达量明显下降,最后,在给予PAG抑制H2S含量后MPO荧光强度提升。见图4。
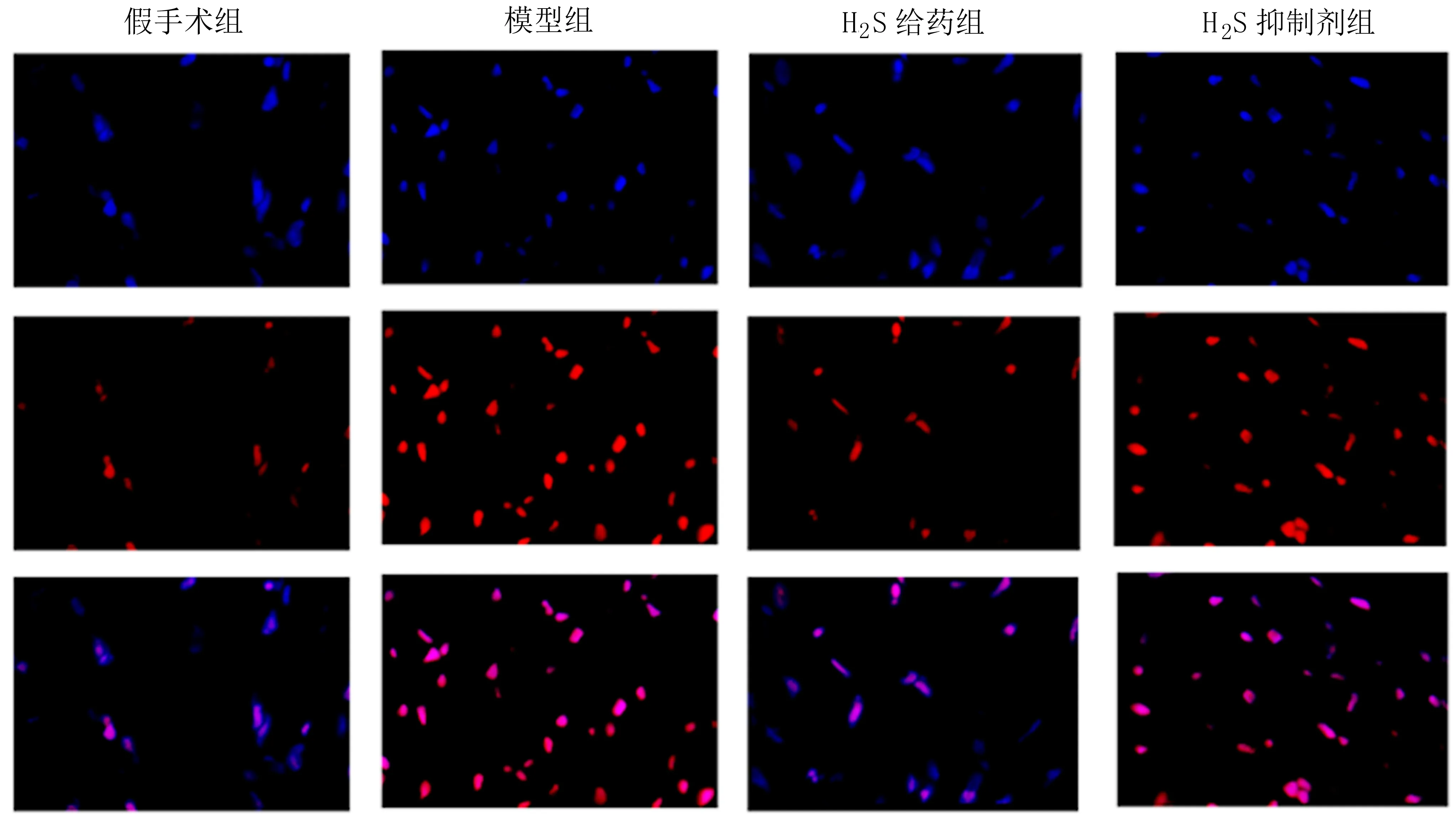
图4 各组大鼠心肌MPO荧光染色结果(400×)
2.5 Western blot实验结果 通过Western blot检测中性粒细胞外线粒体诱捕网关键蛋白GSDMD、MPO、CitH3表达。结果发现,与假手术组比较,模型组大鼠外周血中性粒细胞上清中GSDMD、MPO、CitH3蛋白表达量显著升高。与模型组比较,H2S给药组能显著降低GSDMD、MPO、CitH3蛋白表达水平。在使用PAG之后,GSDMD、MPO、CitH3蛋白表达水平明显提升(P<0.05)。见图5。
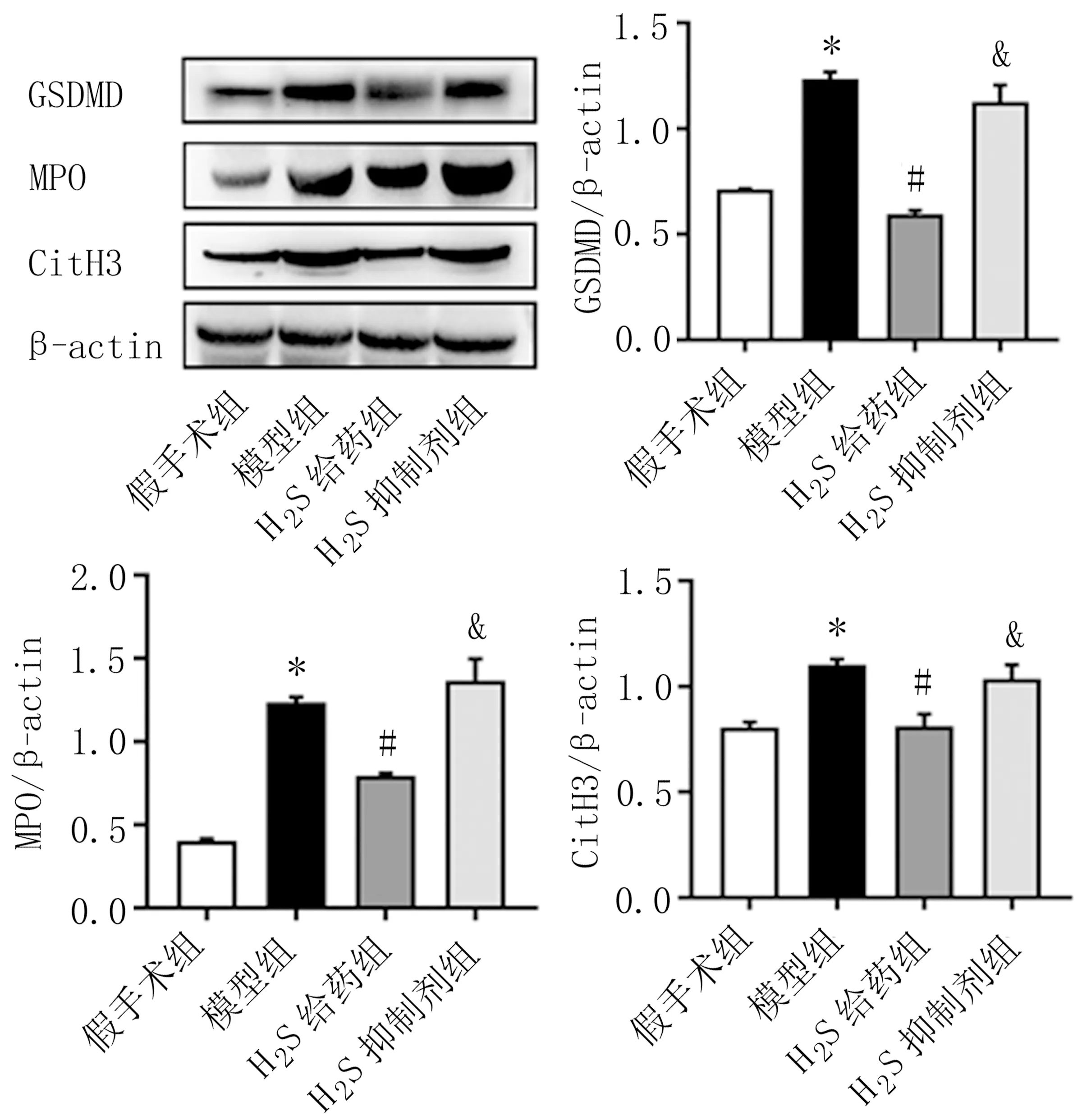
图5 各组大鼠外周血中性粒细胞GSDMD、MPO和CitH3表达水平
3 讨论
中性粒细胞在感染性疾病中发挥着重要的作用。它可通过吞噬、释放溶菌酶和形成NETs,依靠自身网状结构在活化时破膜释放未聚集的染色质,进而杀灭感染的细菌、真菌,但也有研究证实,在机体感染时,NETs自身具备免疫原性,可促发机体炎症反应,与细胞毒性、促血栓、细胞死亡调控形成等不良事件密切相关[11-12],可见中性粒细胞在感染性疾病中的作用值得深入研究。H2S作为一种气体信号分子,其促炎或抗炎作用仍有待进一步研究与探讨,既往研究表明在不同模型中H2S的给药温度、剂量、时间和首选给药途径,吸入气态或注射液态都是造成H2S不同作用的潜在因素[13-16]。本研究中,笔者发现在脓毒症大鼠心肌损伤模型中,外源性给予H2S供体NaHS具有抗炎作用,其主要机制是通过抑制中性粒细胞外诱捕网的形成,继而改善脓毒症诱导的心肌损伤。
CK-MB和LDH是广泛被认可的心肌损伤标志物,这两项作为心肌损伤的诊断和检测指标,具有一定的特异性和实用性[17]。本研究结果显示,脓毒症模型组与假手术组心肌酶学指标CK-MB、LDH相比明显升高,具有统计学差异。同时心肌病理组织学染色结果也显示,假手术组心肌细胞排列整齐呈规律梭形,脓毒症大鼠心肌细胞排列无序,心肌横线模糊或缺失,同时伴炎细胞浸润,这是心肌损伤的标志。笔者通过人为处理分别促进和抑制大鼠体内H2S的表达水平,发现与脓毒症心肌损伤模型相比,促进H2S表达降低了CK-MB和LDH含量,而通过PAG抑制大鼠体内H2S含量发现心肌损伤并未得到明显改善。以上结果表明,在脓毒症大鼠心肌损伤模型中,外源性给予H2S供体NaHS起到了一定程度的心肌保护作用。
中性粒细胞外诱捕网是由DNA、组蛋白和抗菌蛋白组成的网状结构,它是以DNA为骨架,其间镶嵌有组蛋白CitH3、中性粒细胞弹性蛋白酶(Neutrophil elastase, NE)、MPO、抗菌肽(IL-37)、丝氨酸蛋白酶等,因此,关于NETs的检测也都是围绕这些主要组成成分展开[18]。NETs可以捕获、中和和杀死病原体,防止细菌传播,而过量的NETs形成也可以诱导心肌细胞和心血管内皮细胞损伤。在脓毒症相关的心肌损伤中,NETs刺激中性粒细胞浸润到心肌,并通过分泌促炎细胞因子引起组织损伤。抑制NETs形成可减轻脓毒症心肌病[19-20]。NETs在脓毒症发展过程中表现出促炎作用,加重了心肌损伤和炎细胞的浸润,抑制CLP诱导产生的中性粒细胞外诱捕网形成可减轻脓毒症相关的心肌损伤。MPO作为NETs形成的主要组分之一,免疫荧光结果显示,NaHS可降低脓毒症大鼠心肌MPO表达水平。此外,Western blot结果显示,H2S的过表达也降低了脓毒症大鼠心肌组织GSDMD的表达水平,正常细胞条件下,GSDMD 蛋白在细胞内呈现无活性状态,当细胞受到炎症刺激因素,GSDMD可由细胞内的半胱氨酸蛋白酶或中性粒细胞弹性蛋白进行剪切修饰,经剪切修饰的 GSDMD的N端能在细胞膜处发生寡聚反应,形成裂解孔,从而靶向和溶解中性粒细胞颗粒膜,释放出MPO和NETs。
综上所述,本研究结果表明H2S具有一定的抗炎作用,可通过下调GSDMD信号通路减少NETs的释放和形成,从而改善脓毒性心肌病。

