规模猪场的猪瘟净化新思路及实例初探
吴丽艳 王 杨 曾容愚 韩金凤 戴 琦
(1 佳和农牧股份有限公司,湖南长沙 410000;2 天康生物制药有限公司,江苏苏州 215028)
猪瘟(Classical swine fever,CSF)是由猪瘟病毒(Classical swine fever virus,CSFV)引起的一种急性、热性、高度接触性传染病,因其对养猪业危害严重,该病被世界动物卫生组织(OIE)列入须申报的动物疫病目录,我国将其列为一类动物传染病[1,2]。猪瘟对养猪业的危害主要表现在以下4 方面,一是造成了严重的经济损失;二是阻碍养猪业的健康发展,挫伤养猪生产者的积极性;三是造成母猪带毒综合症和先天感染仔猪,严重影响母猪的繁殖性能和育肥猪的生产性能,降低饲料报酬、延迟上市时间,影响种猪和猪肉销售;四是造成猪只出现免疫抑制和免疫耐受,严重影响猪群健康水平,增加其他猪病防控难度等[3-6]。由于猪瘟对养猪业的危害较大,因此,被定义为猪场中需要防控的最重要的疫病之一[7]。
动物疫病净化是经过国内外实践证明了的非常有效的疫病消灭方法[8],欧盟于20 世纪80 年代开始实施猪瘟净化项目,主要是通过采用C 株疫苗免疫,降低感染率,然后再采取非免疫和扑杀策略,并通过限制生猪及猪产品的流通,从而使一些国家净化了猪瘟[9,10]。我国猪瘟净化的难点主要存在于生物安全防范不严格、疫苗免疫覆盖率低、免疫不到位及综合防控措施不到位等[11,12]。2018 年我国发生非洲猪瘟后,集约化进程越来越快,新建猪场生物安全等级更高,同时猪瘟标记疫苗及相应配套的鉴别诊断技术也开始发展与成熟,在抵御非洲猪瘟疫情的前提下,猪瘟净化时机及条件均已具备[13]。猪瘟净化按进程分为免疫净化阶段和非免疫净化阶段,在免疫净化阶段,疫苗的防治作用仍不容忽视,国内许多规模化猪场一直使用猪瘟兔化弱毒疫苗(C 株)来防控猪瘟,但由于弱毒疫苗对保存和运输温度、免疫程序和免疫时机具有较高的要求,同时不能阻断病毒的传播途径,且诱导产生的抗体与野生毒株诱导产生的抗体因极其相似而无法区别[14,15],因此,需要通过猪瘟标记疫苗来实现猪瘟净化。区别于猪瘟活疫苗、猪瘟E2 亚单位疫苗的唯一抗原为猪瘟病毒E2 蛋白,是最主要的保护性抗原,免疫猪后只产生针对E2 的抗体。猪场可以通过对E2 疫苗免疫猪只的E0 蛋白抗体检测,来区分免疫和野毒感染猪,进而为猪瘟的防控和净化提供科学诊断和依据。本研究通过2 个试验分别对比了猪瘟传统弱毒疫苗与猪瘟E2 基因工程苗的免疫效果,并进一步验证了猪瘟E2 基因工程苗在推进猪瘟净化进程中的实际使用效果,以期为猪瘟净化提供新的思路。
1 试验材料与方法
1.1 试验材料
猪瘟E2 基因工程苗、猪瘟传统弱毒疫苗、英迪康CSFV Erns Ab Test Kit、IDEXX 猪瘟病毒ELISA 抗体检测试剂盒,TaKaRa 反转录试剂盒,恒温培养箱KE054N、HNGY-YQ-027、酶标仪KE082M、HNGYYQ-082、全自动核酸提取仪HNGY-YQ-109、基因扩增仪HNGY-YQ-013、电泳仪HNGY-YQ-037、凝胶成像分析系统HNGY-YQ-033 等。
1.2 试验时间与地点
试验于2018 年9 月至2022 年3 月在湖南省某集团规模猪场完成。
1.3 试验方法与分组
1.3.1 2 种猪瘟疫苗免疫效果对比试验
选择健康的同批次保育仔猪80 头,随机分为试验组和对照组,每组40 头猪,试验组接种猪瘟基因工程苗(E2),对照组接种传统弱毒疫苗。分别在首免前、首免后21 d 及二免后30 d 采血,进行猪瘟抗体水平检测,对比2 种猪瘟疫苗的实际免疫效果。
1.3.2 猪瘟E2 基因工程苗的免疫效果试验
2019 年3 月后,猪场母猪群使用猪瘟E2 基因工程苗,商品猪继续使用猪瘟传统弱毒苗,持续跟踪猪场母猪群更换使用猪瘟E2 基因工程苗后的情况,对母猪群和商品猪按照不同胎次、不同日龄进行采血检测,并采集病死猪病料进行检测,评估该猪场E2 和E0 的抗体水平和猪瘟野毒感染情况。试验分组与设计详见表1、表2 和表3。
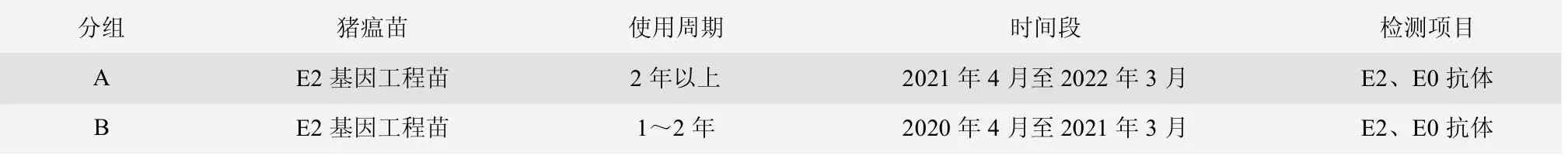
表1 试验分组

表2 母猪群采血表

表3 商品猪群采血表
1.3.3 评估指标
猪瘟E2 抗体(IDEXX 的阻断法);猪瘟E0 抗体(INDICAL 的间接ELISA);猪瘟病毒核酸PCR(TaKaRa 的RT-PCR)。
1.4 数据处理
用Excel 软件进行试验数据录入、整理和初步分析,用SPSS 统计分析软件进行方差分析,结果用“平均数±标准差(X±SD)”表示。P<0.05 表示有显著差异。
2 结果与分析
2.1 猪瘟E2 抗体检测结果
从表4、图1、图2、图3 和图4 可知,对照组猪群在首免后21 d 时猪瘟抗体阳性率为25.00%,阻断率均值为29.40%,离散度为51.80%;试验组猪群在首免后21 d 时的猪瘟抗体阳性率为55.00%,阻断率均值为40.49%,离散度为27.40%。对照组猪群在二免后30 d时猪瘟抗体阳性率为80.00%,阻断率均值为55.48%,离散度为32.70%;实验组猪群在二免后30 d 时猪瘟抗体阳性率为100%,阻断率均值为76.32%,离散度为10.3%。
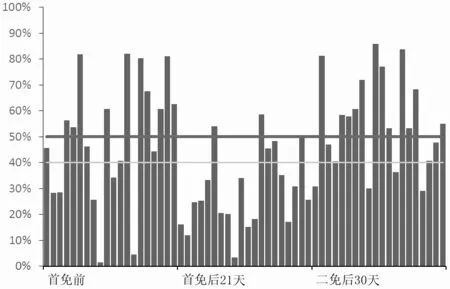
图1 对照组猪瘟抗体水平

图2 试验组猪瘟抗体水平
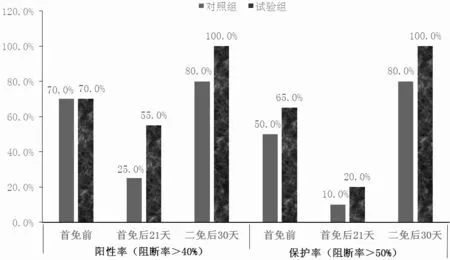
图3 猪瘟抗体阳性率、保护率

图4 猪瘟抗体平均阻断率、离散度
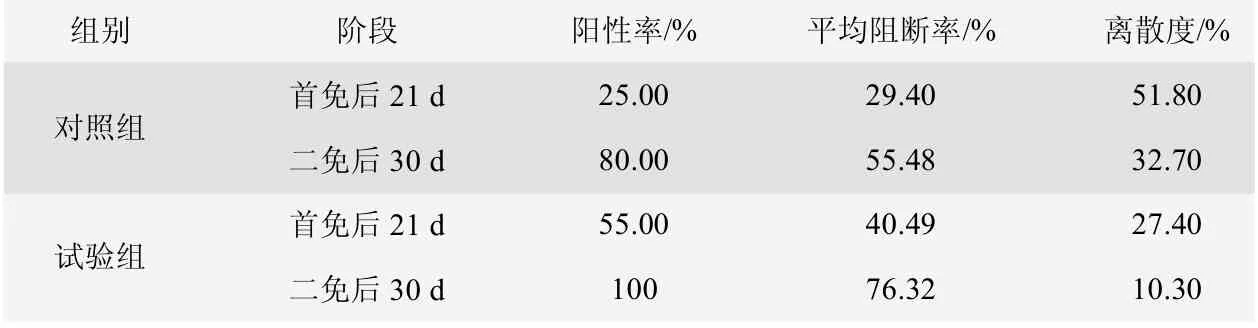
表4 免疫猪瘟疫苗后E2 抗体检测水平
2.2 猪瘟E2 基因工程苗的免疫效果
2.2.1 猪瘟E2 抗体
由表5、图5、图6 可知,A 组0~2 胎次母猪的猪瘟E2 抗体阳性率为100.00%,3 胎次及以上母猪猪瘟E2 抗体阳性率为100.00%,37 日龄仔猪猪瘟E2 抗体阳性率为100.00%,58 日龄仔猪猪瘟E2 抗体阳性率为91.67%。B 组0~2 胎次母猪的猪瘟E2 抗体阳性率为100.00%,3 胎次及以上母猪猪瘟E2 抗体阳性率为100.00%,28 日龄仔猪猪瘟E2 抗体阳性率为100.00%,62 日龄仔猪猪瘟E2 抗体阳性率为100.00%。
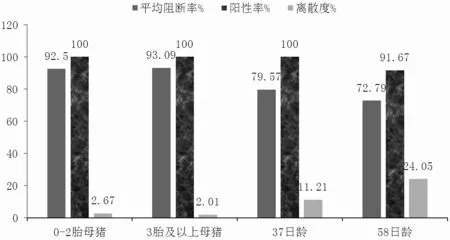
图5 A 组猪瘟E2 抗体阳性率、平均阻断率、离散度
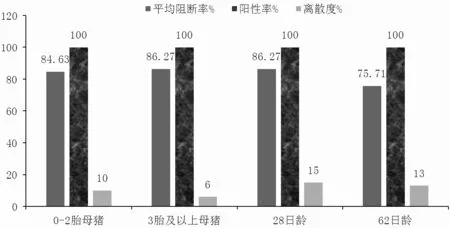
图6 B 组猪瘟E2 抗体阳性率、平均阻断率、离散度

表5 猪瘟E2 抗体检测情况表
2.2.2 猪瘟E0 抗体
由表6、图7 可知,A 组0~2 胎次母猪猪瘟E0 抗体阳性率为0%,3 胎次及以上母猪猪瘟E0 抗体阳性率为8.33%,37 日龄仔猪猪瘟E0 抗体阳性率为0%,58 日龄仔猪猪瘟E0 抗体阳性率为8.33%。B 组0~2 胎次母猪猪瘟E0 抗体阳性率为0%,3 胎及以上母猪猪瘟E0 抗体阳性率为25.00%。
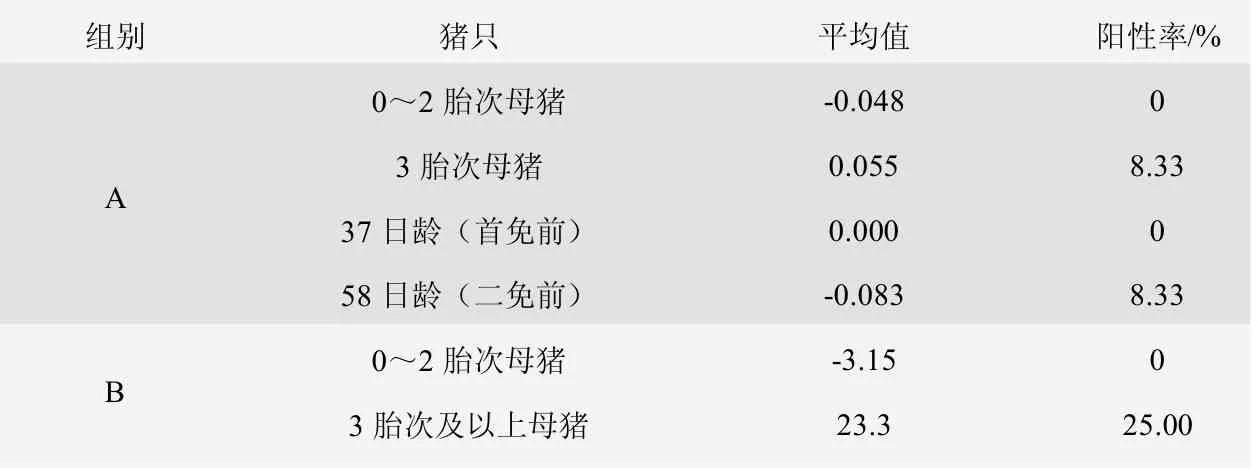
表6 猪瘟E0 抗体检测情况表
2.2.3 病猪猪瘟E0 抗体及猪瘟病原PCR 检测
由表7 可知,对5 头断奶前病猪(病死猪均采集自3 胎次以上高胎龄母猪所产仔猪)采血检测猪瘟E0 抗体,有4 头猪只呈阳性,阳性率80%;而对病死猪猪瘟病毒核酸检测全部为阴性。
3 讨论
传统猪瘟弱毒苗在首免后受母源抗体影响较大,其免疫效果不佳,CSFV 抗体水平低、整齐度差,无法提供较好的保护,且在二免后其免疫效果仍不理想。猪瘟E2 基因工程苗首免后在一定程度上仍会受到母源抗体影响,但相较传统猪瘟弱毒苗,其受影响较小。且在二免后,CSFV 抗体水平明显上升,阳性率及保护率均达100%,抗体水平整齐度好,免疫效果佳,表明猪瘟E2亚单位疫苗在二免后能为猪群提供强有力的保护。
猪瘟E2 抗体结果显示,A、B组母猪E2 抗体的阳性率均高达100%,A 组相较B 组整齐度更好、阻断率更高,表明猪场更换E2 基因工程苗后,母猪的猪瘟抗体水平较高,且随着E2 基因工程苗使用时间越长,E2 抗体整齐度越好、保护力越高;A、B 组商品猪的E2抗体水平整体均较好,首免前抗体阳性率均为100%,二免前抗体阳性率均可达90%以上,阻断率稍低,在72%~75%;首免至二免的抗体水平变化说明目前猪场的免疫程序较合适,但仔猪首免前抗体水平较高,为减少母源抗体干扰,首免时间可从当前实施的5 周龄适当延后至6~7 周龄。
猪瘟E0 抗体检测结果显示,A、B 组0~2 胎次母猪E0 抗体阳性率均为0,而3 胎次及以上母猪E0 抗体阳性率均超过5%,这可能是由于猪场有过猪瘟感染史,且猪场之前使用弱毒疫苗造成的E0 抗体阳性率较高,随着时间的推移,在母猪群调整使用猪瘟E2 基因工程苗2 年后E0 抗体阳性率从25%下降至8.33%,有明显下降的趋势。
5 头病死猪的死因均与猪瘟感染无关,而其中4 头猪的猪瘟E0抗体阳性,有可能是母猪的猪瘟E0 抗体为阳性,通过乳汁将E0 抗体传递给仔猪所造成的。病死猪均采集自3 胎次以上高胎龄母猪所产仔猪,该结果与上述E0 抗体结果相符,说明3 胎及以上母猪所产仔猪病症情况更多,且随着母猪调整使用E2 苗,E0 抗体阳性率下降明显,病症减轻。
综上所述,猪场在更换E2 基因工程苗后不同时间段监测猪瘟E2 抗体水平均较好,E0 抗体阳性率也呈明显下降的趋势,通过核酸检测跟踪发现,猪场无猪瘟野毒感染,猪场在免疫猪瘟E2 苗后免疫效果较好,保护力较强。
4 结论
本研究通过评估E2 基因工程苗的实际免疫效果,并跟踪猪场母猪群更换使用E2 苗2 年后的情况,对比使用不同猪瘟疫苗后猪场的母猪、商品猪的E0 抗体的阳性率与病原情况,了解猪场的野毒感染情况,同时通过对比使用猪瘟E2 基因工程苗与使用传统猪瘟弱毒苗在猪瘟抗体水平及猪瘟野毒感染上的差异,验证了使用猪瘟E2 基因工程苗猪场的猪瘟净化效果,为指导猪场猪瘟净化提供参考依据。
对比传统猪瘟弱毒苗,E2 基因工程苗具有明显优势,且猪场在更换使用猪瘟E2 基因工程苗后猪瘟E2 抗体水平较好、保护力高,E0抗体阳性率有明显下降的趋势,猪场无猪瘟野毒感染现象,生产成绩稳定,可以继续依照调整后的免疫程序实施、推进猪瘟净化进程。本研究结果初步验证了E2 基因工程苗在临床上评估猪瘟净化进展的可行性,且作为猪瘟净化的实例,具有可推广性。


