六种商品化血促性素的活性成分含量检测和生物学活性分析
张 洪 宋星星 韩一啸 汪 澎 潘华柱 张佳妮 李 珣*
(1 吉力生物科技有限公司,浙江宁波 315000;2 广西大学动物科学技术学院,广西南宁 530004)
随着我国畜牧业养殖规模的扩大和饲养技术的日益提升,血促性素的需求量也逐步递增。血促性素是动物繁殖激素的重点产品,比较不同的商品化血促性素的活性,有利于推进行业激素产品高质量发展,提高母畜受胎率,促进养殖场集约化经营,提升畜牧业养殖的生产效益。血促性素的主要成分是孕马血清促性腺激素(Pregnant Mare Serum Gonadotropin,PMSG),也称为马属动物绒毛膜促性腺激素[1]。PMSG 是一种在怀孕母马血清中发现的糖蛋白激素,主要由雌性马属动物的子宫内膜杯状细胞分泌[2]。从健康孕马的血清或血浆中提取的血促性素具有调控动物繁殖力的作用,主要应用于奶牛、绵羊、猪等动物[3,4]。神英超等[4]、罗昊澍等[5]研究发现,PMSG 具有促卵泡素和促黄体素活性。此外,PMSG 已被证明可以用于诱导发情[6]、治疗不孕、增强动物生育能力[7-9]、促进卵泡发育或胚胎移植时的超数排卵[10,11]、诱导多胎[12]、治疗母畜卵巢机能疾病和提高公畜繁殖性能等[1,13]方面。通过使用血促性素可以使养殖场中动物的发情率有效提高,从而尽可能地实现母畜同期发情,便于集约化养殖场的生产管理和卫生防疫[14]。目前市场上注射用血促性素的产品有很多种,不同厂家生产的血促性素的效果也有所不同。本试验选取了市场上常见的6 种注射用血促性素产品进行活性成分含量检测和分析,并依据前人报道[15-18],测定它们对大鼠发情、卵巢增重和卵泡发育的影响,以评价不同注射用血促性素产品的效果,筛选出高效的血促性素产品,为今后养殖场主的选择用药提供参考。
1 材料与方法
1.1 试验材料
BCA 蛋白定量试剂盒、SDS-PAGE 凝胶制备试剂盒、HE 染色试剂均购自中国索莱宝公司;PMSG ELISA试剂盒购自德国DRG 公司;考马斯亮蓝染液购自中国碧云天生物科技有限公司。注射用血促性素产品均为粉剂针,1 000 单位,批号分别是A 组(B2205271)、B组(B220703)、C 组(20210101)、D 组(20220728)、E 组(210504)和F 组(20221027)。
1.2 试验动物
84 只6 周龄雌性SD 大鼠(202±5)g 购自广西医科大学试验动物中心。雌性SD 大鼠适应性饲喂1 周后,随机分为对照组和6 组试验组,即对照组(生理盐水)、A 组 (B2205271)、B 组 (B220703)、C 组(20210101)、D 组(20220728)、E 组(210504)和F组(20221027),每组12 只,试验组分别单次皮下注射0.1 mL 对应的血促性素10 IU,对照组相同时间皮下注射0.1 mL 生理盐水,随后进行试验。
1.3 试验方法
1.3.1 血促性素蛋白浓度的测定
本试验依据BCA 蛋白定量试剂盒说明书进行。将标准品和血促性素分别用PBS 梯度稀释,记为待检样品,将BCA 试剂和Cu 试剂按50∶1 的比例配制成BCA 工作液,将待检样品和工作液依次加入96 孔板,37℃孵育后,在562 nm 处测定各孔吸光值,绘制标准曲线,计算样品中的蛋白浓度。
1.3.2 血促性素PMSG 含量测定
将蛋白上样缓冲液与PBS 溶解后的血促性素按照1∶4 的比例配制为待检样品,取20 μL 待检样品进行SDS-PAGE 凝胶电泳,待Marker 到达胶块底部,电泳完成。将SDS-PAGE 凝胶放入考马斯亮蓝染液进行染色,过夜脱色后,拍照分析,初步判断PMSG 含量。
根据PMSG ELISA 试剂盒说明书,将样品用蒸馏水溶解后用零标准品按1∶100 的比例稀释,加入微孔中,室温下孵育1 h。随后依次进行酶联物、底物液和终止液的孵育,终止反应后在450±10 nm 处读取OD 值,绘制标准曲线,计算样品中的PMSG 含量。
1.3.3 血促性素的生物活性检测
(1)诱导发情。注射血促性素后每天2 次制作大鼠阴道涂片,每组6 只,连续2 周,对涂片进行HE 染色,在显微镜下观察细胞形态及含量,记录并分析各组大鼠发情情况。
(2)卵巢增重和卵泡发育。注射血促性素后第72 h对大鼠进行剖检,每组6 只,摘除卵巢,称重,计算卵巢指数,卵巢指数=卵巢重量÷体重。将卵巢用福尔马林固定,自动脱水机脱水、透明和浸蜡,石蜡包埋后,制成4 μm 连续切片。HE 染色后,随机观察不连续的3张切片,选取5 个不相邻的视野,记录单侧卵巢中的成熟卵泡数、生长卵泡数(即初级卵泡和次级卵泡的数目),计算成熟卵泡率。成熟卵泡率=成熟卵泡数÷(成熟卵泡数+生长卵泡数)。
1.4 数据分析
试验相关数据用SPSS 22.0 软件进行单因素方差分析,数据结果以“平均值±标准差(Mean±SD)”表示,P<0.05 表示数据具有显著性差异。
2 结果与分析
2.1 血促性素的浓度检测
根据BCA 蛋白定量试剂盒检测结果绘制标准曲线(图1A),在0~0.5 mg/mL 范围内,得到线性回归方程y=0.7918x+0.0816,R2为0.9962,大于0.98,表明BCA 法的线性相关性符合标准。
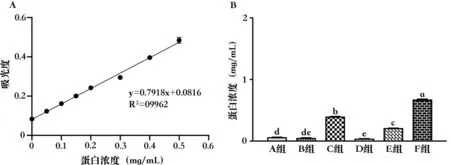
图1 BCA 法检测不同血促性素的蛋白浓度
根据线性回归方程计算得出不同血促性素的蛋白浓度,绘制柱状图(图1B)。蛋白浓度由高到低依次为F组、C 组、E 组、A 组、B 组、D 组,其中A 组和B 组没有显著差异(P>0.05),B 组和D 组没有显著差异(P>0.05),其他组间均存在显著差异(P<0.05)。
2.2 不同厂家血促性素的活性成分含量检测
血促性素的主要成分为PMSG,分子量为53 KDa。SDS-PAGE 凝胶电泳结果显示,C 组、E 组和F 组的血促性素均呈现出明显的蛋白泳道(图2A)。在43 KDa范围处,C 组、E 组、F 组的血促性素均有蛋白条带,其中F 组的血促性素的蛋白含量最高。上述结果提示F组中PMSG 的含量最高。
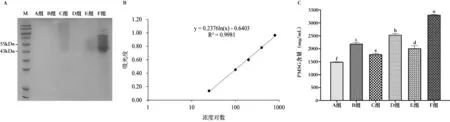
图2 SDS-PAGE 凝胶电泳和PMSG ELISA 试剂盒测定不同厂家血促性素的含量
根据PMSG ELISA 试剂盒检测结果,以每个标准品的平均OD 值为Y 轴,其浓度为X 轴做标准曲线(半对数,见图2B),在0~800 IU/mL 范围内,得到线性回归方程y=0.2376ln(x)-0.6403,R2=0.9981,大于0.98,表明ELISA 的线性相关性符合标准。
根据线性回归方程计算得出不同厂家的血促性素的PMSG 含量,绘制柱状图(图2C)。由图可知,PMSG的含量从高到低依次为F 组、D 组、B 组、E 组、C 组、A 组,各组之间均存在显著性差异(P<0.05)。
2.3 血促性素生物活性检测
2.3.1 诱导发情
大鼠一个发情周期为4~5 d,根据阴道涂片中3 种细胞不同比例区分为发情前期(图3A)、发情期(图3B)、发情后期(图3C)和间情期(图3D)。结果表明,注射药物后第72 h,对照组的SD 大鼠发情率为33.33%,A 组、B 组、C 组、D 组、E 组和F 组的SD大鼠的发情率均为100%(图4)。表明不同血促性素均能达到同期发情效果。
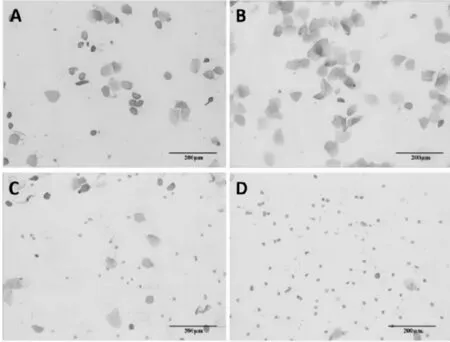
图3 大鼠发情周期各阶段阴道细胞变化图(100×)
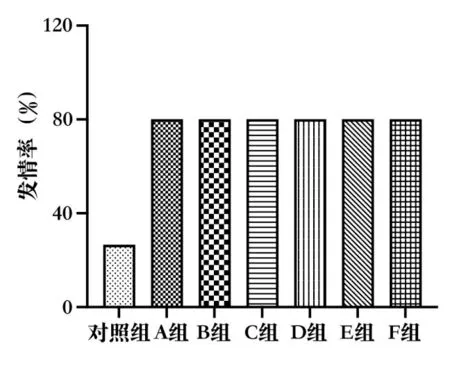
图4 不同厂家血促性素对SD 大鼠同情发情的影响
14 d 的阴道涂片统计结果显示(图5),与对照组相比,A 组、B 组、C 组、D 组、E 组和F 组的SD 大鼠均表现出发情前期和发情后期时长显著性减少(P<0.05),发情期时长显著增多(P<0.05),其中,D 组发情前期时长最短;E 组发情期时长最短(P<0.05),发情后期时长最长(P<0.05)。与对照组的间情期时长相比,E 组显著增多(P<0.05),A 组和F 组显著减少(P<0.05)。上述结果提示不同血促性素均能延长SD 大鼠发情期的时间,其中,E 组的延长效果不佳。
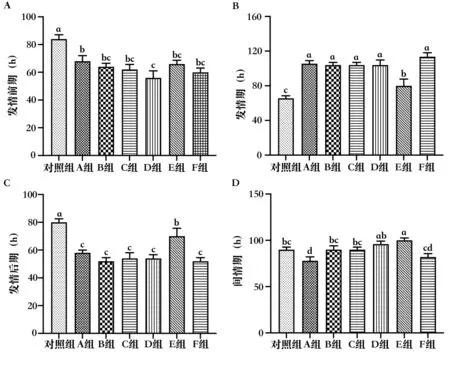
图5 不同血促性素对SD 大鼠发情周期的影响
2.3.2 卵巢增重及卵泡发育
SD 大鼠卵巢增重试验结果(图6)显示,F 组大鼠的卵巢指数显著高于对照组、A 组、B 组、C 组和E 组(P<0.05),与D 组无显著差异(P>0.05)。除F 组外,其他各组均无显著性差异,表明F 组具有较好地促进卵巢增重的效果。
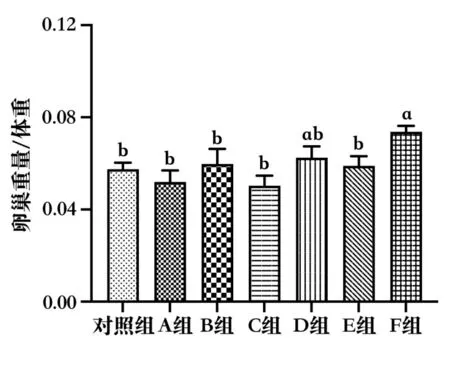
图6 不同厂家血促性素对SD 大鼠卵巢增重的影响
根据SD 大鼠各级卵泡的形态学特点(表2),对各组卵巢切片(图7)中的成熟卵泡和生长卵泡进行计数,结果显示,注射血促性素后大鼠卵巢中成熟卵泡增多。与对照组相比,C 组、D 组和F 组的成熟卵泡率显著升高(P<0.05)。其中,C 组和F 组的成熟卵泡率还显著高于A 组和B 组(P<0.05)。但是,其他各组的成熟卵泡率无显著性差异(图8)。结果表明,C 组和F组产品均可以促进SD 大鼠卵泡成熟。
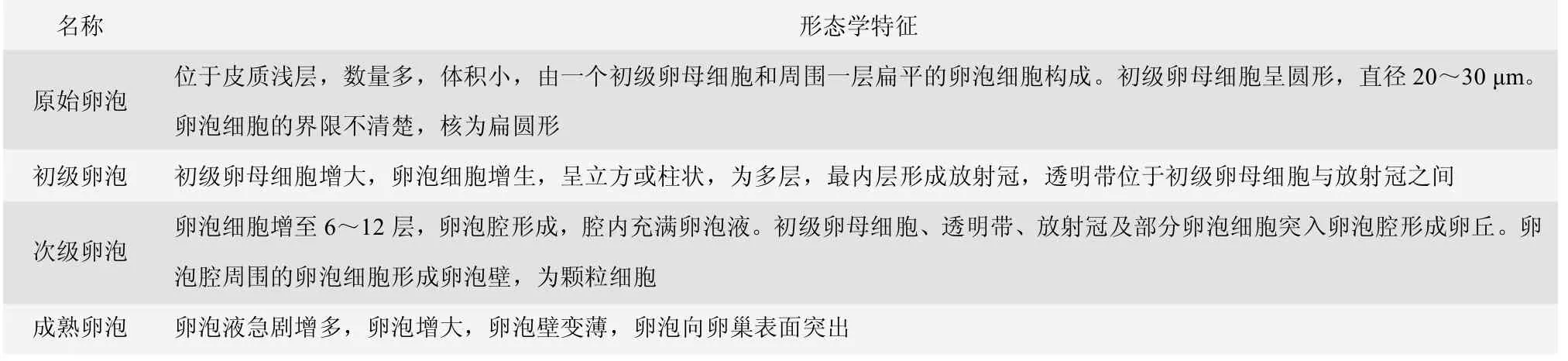
表2 大鼠各级卵泡的形态学特征
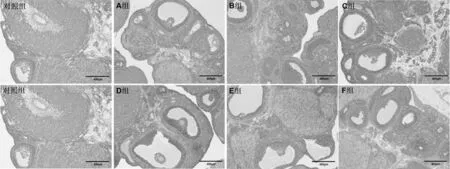
图7 不同血促性素对SD 大鼠的卵泡发育的影响(40×)
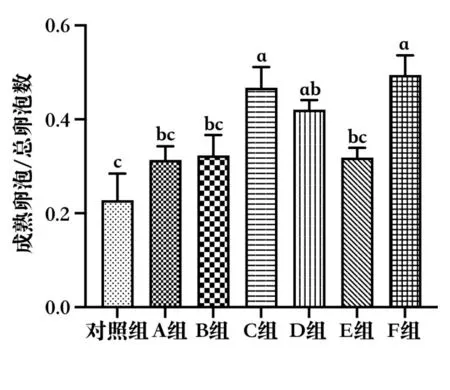
图8 不同血促性素对SD 大鼠的成熟卵泡率的影响
3 讨论
注射用血促性素是母畜繁育中广泛使用的激素产品,主要用于调控母畜同期发情和超数排卵。我国兽药典标准中规定,注射用血促性素效价应为标示量的67%~148%。由试验结果可知,市场上商品化注射用血促性素的效价具有一定差异。马增晓等[19]研究表明,PMSG 的剂量会影响动物的发情、排卵和受胎率。为了筛选出高效的血促性素,对6 种常见注射用血促性素进行了活性成分含量检测和生物活性分析。
血促性素的活性成分含量是决定其生物活性的前提。蛋白浓度检测结果发现,C 组、E 组、F 组的血促性素均具有较高的蛋白浓度,其中F 组浓度最高。SDS-PAGE 凝胶电泳和ELISA 检测结果显示,F 组的血促性素中PMSG 含量最高,D 组、B 组、E 组、C 组、A 组的PMSG 含量依次降低。表明F 组的血促性素含有最多的活性成分,PMSG 含量最高,其应用效果最好。生物活性试验结果显示,6 种血促性素均能100%诱导SD 大鼠同期发情,这与高建明等[20]报道的PMSG 剂量对动物同期发情效果无显著影响结果一致。发情期是动物排卵的主要时期[21],PMSG 可以在大鼠发情周期的任何阶段诱导超数排卵[22]。阴道涂片结果显示,6 种血促性素均能显著促进大鼠发情期时间的增长,但E 组效果较差,表明6 种血促性素均能诱导大鼠超数排卵,但排卵效果有差异。此外,卵巢增重和HE 染色结果表明,仅有F 组的大鼠卵巢指数显著增加,卵泡成熟率最高,表明F 组的血促性素促进卵泡发育的效果最好,可以诱导大鼠超数排卵。曾昭成等[23]指出不同效价的PMSG 对动物发情率和排卵率影响不显著,但高效价的PMSG 可以显著提高动物的排卵数,提升动物受胎率,这与本研究结果类似。生殖激素是调控动物卵巢发育及其排卵过程的主要内分泌因子[24],PMSG 作为生殖激素的一种,在血液中半衰期较长,可达2~5 d,外源注射后体内残留的激素会影响母畜的发情效果。低效价的PMSG 虽然诱导动物发情,但对卵巢影响较小,无法改善动物卵泡发育和排卵情况[25]。此外,低效价PMSG 比高效价PMSG 更易引发大鼠子宫和卵巢水肿,影响动物卵子发育,导致动物后期受胎率大幅降低,降低母畜繁殖性能,影响家畜养殖效益。
4 结论
通过对6 家厂家的注射用血促性素进行活性成分含量检测和生物学活性分析,发现F 组产品效果最好。低效价的血促性素只具备诱导大鼠发情的效果,不能诱导其排卵,容易导致动物配种失败。而高效价的血促性素兼备诱导发情、促进卵巢发育和促进卵泡成熟的效果,有利于动物配种成功和超数排卵,提升动物受胎率和产仔率。因此,使用高效价的血促性素能使养殖场的效益更大化。

