CCL18在胶质母细胞瘤中的表达及其对U87MG细胞增殖和迁移的影响
黄冠又 葛学成 甘鸿川 郝淑煜 吴震


摘要:目的 探討趋化因子配体18(CCL18)在胶质母细胞瘤(GBM)中的表达与GBM临床预后的关系以及对U87MG细胞增殖和迁移的影响。方法 基于癌症基因组图谱(TCGA)和基因型-组织表达(GTEx)数据库中GBM和正常脑组织数据,分析CCL18在GBM与正常脑组织中的表达差异,采用免疫组织化学染色进行验证。应用Kaplan-Meier生存分析、单因素和多因素Cox回归分析评估CCL18对GBM患者预后的影响。基于多因素Cox回归模型构建生存列线图,绘制校准曲线和受试者工作特征(ROC)曲线进行验证。将人胶质母细胞瘤U87MG细胞分为siRNA-CCL18组、siRNA-NC组和Mock-siRNA组,采用实时荧光定量PCR(qPCR)法检测细胞中CCL18 mRNA表达,CCK-8法和细胞划痕愈合实验检测U87MG细胞的增殖和迁移能力。结果 TCGA和GTEx数据库分析结果显示,GBM组织中CCL18基因表达水平高于正常脑组织;免疫组织化学染色结果显示,GBM组CCL18阳性表达率高于对照组(P<0.05)。CCL18高表达组患者预后较低表达组差(P<0.01)。Cox回归分析结果显示,IDH野生型和CCL18高表达是GBM患者死亡的独立危险因素(P<0.05)。校准曲线显示列线图预测模型与实际生存有较好一致性,ROC曲线表明该模型对GBM患者生存概率有较好预测能力。siRNA-CCL18组CCL18 mRNA表达水平、细胞增殖(48 h、72 h和96 h)和迁移能力(24 h)均低于siRNA-NC组和Mock-siRNA组(P<0.05)。结论 CCL18在GBM中表达上调,可促进GBM肿瘤细胞增殖和迁移,且可导致患者预后不良。
关键词:胶质母细胞瘤;趋化因子CCL18;细胞增殖;细胞运动;预后
中图分类号:R739.41文献标志码:ADOI:10.11958/20221791
Expression of CCL18 in glioblastoma and its effect on proliferation and migration of
human U87MG cells
HUANG Guanyou GE Xuecheng GAN Hongchuan HAO Shuyu WU Zhen
1 Department of Neurosurgery, the Second Peoples Hospital of Guiyang, Guiyang 550081, China; 2 Department of Neurosurgery, Beijing Tiantan Hospital, Capital Medical University
Corresponding Author E-mail: wuzhen1966@aliyun.com
Abstract: Objective To analyze the expression chemokine (C-C motif) ligand 18 (CCL18) on the clinical prognosis of glioblastoma (GBM) and its effects on the proliferation and migration of U87MG cells. Methods The differential expression of CCL18 gene in GBM and normal brain tissue was analyzed based on the GBM data from Cancer Genome Atlas (TGGA) database and the normal brain tissue data from Genotype-Tissue Expression (GTEx) database. Immunohistochemical staining was used to verification. Kaplan-Meier survival analysis, univariate and multivariable Cox regression analysis were used to evaluate the impact of CCL18 expression on the prognosis in GBM patients. A nomogram was established based on the results of multivariate Cox analysis. The calibration curve and receiver-operating characteristic (ROC) curve were draw for validation. Human glioblastoma U87MG cells were divided into the siRNA-CCL18 group, the siRNA-NC group and the Mock-siRNA group. qPCR was used to detect the content of CCL18 mRNA in the different U87MG cell groups. The CCK-8 assay and cell scratch test were used to detect the cell proliferation and migration ability of U87MG cells in each group. Results CCL18 was significantly upregulated in GBM tissue (P<0.05). The immunohistochemistry results suggested that CCL18 protein was significantly increased in GBM tissue (P<0.05). Survival analysis indicated that high expression of CCL18 was associated with poor prognosis in GBM patients (P<0.05). Multivariate Cox regression analysis revealed that IDH wild-type and high level of CCL18 expression were the two major risk factors affecting the poor prognosis of GBM (P<0.05). The calibration curve showed that the actual survival rate of patients was consistent with the predicted survival rate. The ROC curve demonstrated that the model had a good predictive for predicting the survival of GBM patients. siRNA reduced the expression of CCL18 in human U87MG cells. The results of CCK-8 assay showed that the proliferation of U87MG cells was significantly inhibited (P<0.05), and the wound healing scratch ability of U87MG cells with low expression of CCL18 decreased (P<0.01). Conclusion CCL18 is over-expressed in GBM tissue, and high CCL18 expression is associated with poor prognosis in GBM patients.CCL18 promotes GBM cell proliferation and migration and may act as a relevant predictive biomarker for GBM.
Key words: glioblastoma; chemokine CCL18; cell proliferation; cell movement; prognosis
多形性胶质母细胞瘤(glioblastoma multiforme,GBM)是成人最常见的中枢神经系统原发恶性脑肿瘤,其恶性程度和复发率较高,患者生存期短[1]。传统的手术切除结合术后同步放化疗及替莫唑胺辅助化疗方案对改善GBM患者预后效果不佳,其中位生存期仅15个月[2]。有研究表明,GBM进展迅速,且异质性显著[3],趋化因子与肿瘤的侵袭和转移密切相关[4]。GBM的肿瘤微环境中有大量的小胶质细胞/巨噬细胞浸润,能进一步增强GBM的侵袭性以及促进抑制性免疫微环境的形成[5]。C-C趋化因子配体18(chemokine CC-motif ligand 18,CCL18)是趋化因子配体家族成员之一,主要由肿瘤相关巨噬细胞分泌,可促进肿瘤细胞上皮间质转化(epithelial to mesenchymal transition,EMT)和自我更新能力,在肿瘤侵袭和转移中发挥重要作用[6]。研究表明,CCL18在乳腺癌[6]、肺癌[7]、口腔鳞癌[8]等多种恶性肿瘤中表达上调,但关于CCL18在GBM中表达及其对GBM细胞增殖和侵袭的影响尚鲜见报道。本研究通过生物信息学方法和免疫组织化学染色检测分析CCL18在GBM中的表达及其对U87MG细胞增殖和迁移能力的影响。
1 资料与方法
1.1 数据库资料和分组 利用UCSC XENA(https://xenabrowser.net/datapages/)从癌症基因组图谱(The Cancer Genome Atlas,TCGA,https://portal.gdc.cancer.gov)数据库和基因型-组织表达数据库(The Genotype-Tissue Expression,GTEx)中提取有关GBM的基因表达谱(RNA-Seq)数据。经Toil流程[9]标准化处理后分别得到168例GBM患者的RNA-Seq数据和临床资料以及1 157例正常脑组织的RNA-Seq数据。GBM患者纳入标准:(1)病理学诊断为GBM;(2)具有CCL18基因数据的样本。排除临床资料不全者。
患者临床信息资料,包括性别、年龄、异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)状态、Karnofsky功能状态评分(Karnofsky performance scale,KPS)[10]等。总生存期(overal survival,OS)指从患者病理确诊之日起至患者死亡或末次随访的生存时间;无进展生存期(progression free survival,PFS)是指患者接受治疗开始到出现肿瘤复发或死亡的时间。
1.2 临床标本资料 选择2020年1月—2021年8月于贵阳市第二人民医院神经外科行手术治疗的GBM患者(GBM组)45例,其中男25例,女20例,年龄29~79岁,平均年龄(56.06±10.05)岁;另选择2021年1—5月同科收治的重型颅脑损伤患者15例为对照组,其中男9例,女6例,年龄30~76岁,平均年龄(53.43±9.35)岁;2组患者性别(χ2=0.090)和年龄(t=0.974)比较差异无统计学意义(P>0.05)。GBM组纳入标准:(1)有完整的临床病史记录、影像学及围手术期资料。(2)行常规开颅显微手术切除肿瘤,肿瘤切除程度有明确的手术记录。(3)根据WHO中枢神经系统肿瘤第五版分类标准[11]诊断为GBM,并经术后病理确诊。(4)术前均未接受过放化疗和靶向治疗。本研究经本院伦理委员会批准(批准号:2021伦审第53号),获患者或法定代理人知情同意并签署知情同意书。
1.3 材料、试剂和仪器 人胶质母细胞瘤细胞株U87MG购自中国科学院上海细胞库;兔抗人CCL18单克隆抗体购自英国Abcam公司,免疫组化试剂盒和二氨基联苯胺(diaminobenzidine,DAB)购自北京中杉金桥生物技术有限公司;标准胎牛血清、胰酶、乙二胺四乙酸购自美国Gibico公司;RNA提取试剂盒、SYBR Green荧光定量逆转录试剂盒、CCK-8试剂盒购自武汉赛维尔生物科技有限公司;riboFECTTM CP转染试剂购自广州锐博生物科技有限公司;CCL18小干扰RNA(CCL18-siRNA)、阴性对照RNA由广州锐博生物科技有限公司设计合成。紫外分光光度计、CO2培养箱购自美国赛默飞世尔科技有限公司;全自动轮转式切片机购自德国Leica公司;酶标分析仪(ELx808)购自美国BioTek公司;qPCR仪购自美国Bio-Rad公司;倒置荧光显微镜(CKX41)购自日本奥林巴斯公司;台式低速离心机购自德国Sigma公司。
1.4 免疫组织化学染色检测CCL18在GBM中的表达 胶质母细胞瘤标本于肿瘤处取材,10%甲醛固定,常规石蜡包埋,4 μm切片,常规二甲苯、无水乙醇脱蜡,PBS冲洗3次,切片置于柠檬酸修复液(pH=6.0)中修复,3%H2O2封闭20 min阻断内源性过氧化物酶,PBS清洗玻片3次,每次5 min。加入CCL18抗体(1∶200稀释)4 ℃孵育过夜。加入辣根过氧化物酶标记的兔抗山羊IgG二抗(1∶500稀释),室温孵育1 h,DAB显色3 min,蒸馏水冲洗终止显色。苏木素复染1 min,流水反蓝10 min,中性树脂封片,显微镜下拍照。结果判定:阳性染色以细胞膜或细胞浆中出现褐色或棕黄色颗粒为准,400倍镜下随机读取3个视野计数阳性表达细胞数。染色程度评分由弱到强分为阴性(0分)、弱阳性(1分)、阳性(2分)和强陽性(3分),染色范围评分为0(0分)、1%~25%(1分)、26%~50%(2分)、51%~75%(3分)和76%~100%(4分),染色程度评分和染色范围评分两者相加得到CCL18表达评分。CCL18表达评分0~5分为低表达,5分以上为高表达。
1.5 细胞培养和siRNA转染 U87MG细胞从液氮中取出,于37 ℃水浴中快速解冻,使用含10%胎牛血清和1%青霉素-链霉素的DMEM培养基,于37 ℃、5%CO2培养箱中培养。取对数生长期的单层细胞,接种至24孔板,接种密度为1×105个/mL,加入胰酶消化细胞和传代培养,收集生长状态良好的细胞进行后续实验。当细胞正常生长且汇合度达60%~70%即进行转染。根据说明书配制转染混合液,将配制好的riboFECTTM CP混合液加入465.75 μL无双抗完全培养基(v1)中,将培养板置于37 ℃、5%CO2培养箱中培养24~96 h。实验分为Mock-siRNA组(U87MG细胞转染Mock-siRNA,Mock序列为无义序列)、siRNA-NC组(细胞转染CCL18 siRNA control)、siRNA-CCL18组(细胞转染CCL18 siRNA),各组siRNA序列见表1。
1.6 实时荧光定量PCR(qPCR)检测CCL18 mRNA表达 根据Trizol法提取各组U87MG细胞的总RNA,用分光光度计检测RNA浓度和纯度。参照说明书将RNA逆转录为cDNA后进行qPCR。qPCR反应体系为25 μL:qPCR SYBR? Green Master Mix 12.5 μL,上下游引物(0.2 μmol/L)各0.5 μL,cDNA 2 μL,ddH2O调整至25 μL。qPCR反应条件为:95 ℃预变性5 min;95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸20 s,共40个循环。每个循环结束时采集荧光强度,根据熔解曲线读取参数。以GAPDH为内参,引物序列见表2。采用2-ΔΔCt法计算CCL18 mRNA相对表达量。实验重复3次。
1.7 CCK-8法检测细胞增殖 将各组siRNA转染细胞24 h后,弃上清液,PBS清洗,加入胰酶进行消化,离心(800 r/min,5 min);制成细胞悬液,调整为5×104个/mL。取96孔板,以100 μL/孔加入细胞悬液(即5 000个细胞/孔),每组不少于5个复孔,37 ℃、5%CO2培养24 h后,取96孔板,更换新鲜培养基,按照实验分组将配制好的转染混合液加入培养基中。培养24、48、72、96 h后,加入10 μL CCK-8工作液孵育1~2 h,采用酶标仪于450 nm波长处测定吸光度值。
1.8 划痕愈合实验检测细胞迁移能力 将对数生长期的各组细胞以1×105个/mL接种于6孔板。37 ℃恒温孵育过夜。细胞汇合度达100%时,吸弃培养基,使用20 μL的移液枪头对准标尺划痕,均匀用力保证划痕宽度一致。用无菌PBS洗细胞3次,冲洗不贴壁的细胞碎屑,加入无血清培养基在37 ℃、5%CO2培养箱中培养。培养0、6、12、24 h,相差显微镜下测量细胞迁移的相对距离并拍照。采用Image J软件分析细胞迁移率。迁移率(%)=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度×100%。
1.9 统计学方法 使用SPSS 20.0软件、R语言统计软件(v 3.6.3)及Graphpad Prism 8.0软件进行数据分析和作图。计数资料以例(%)表示,组间比较采用χ2检验或连续校正χ2检验。符合正态分布的计量资料以x±s表示,2组间比较采用独立样本t检验;多组间比较采用单因素方差分析,组间多重比较行SNK-q检验;非正态分布的计量资料以M(P25,P75)表示,组间比较采用Mann-Whitney U检验。应用Kaplan-Meier法和Log-rank检验比较不同CCL18表達组患者的生存情况。采用单因素Cox回归分析影响患者生存的因素,选择单因素分析结果有意义者进行多因素Cox回归分析。基于多因素分析结果,通过R软件rms程序包构建1年、2年和3年生存时间的预测模型,计算模型一致性指数(C-index),C-index>0.6,则预测性能良好;并绘制校准曲线和受试者工作特征(ROC)曲线评估模型的预测效能。P<0.05为差异有统计学意义。
2 结果
2.1 CCL18在胶质母细胞瘤组织中的表达 TCGA数据库和GTEx数据库分析结果显示,GBM组CCL18基因表达水平高于对照组(Z=18.619,P<0.01),见图1A。免疫组织化学染色结果显示,GBM组CCL18阳性表达率高于对照组[62.2%(28/45)vs. 6.7%(1/15),χ2=8.789,P<0.05],见图1B—D。
2.2 TCGA数据库中CCL18表达与GBM患者预后的关系 以CCL18相对表达量的中位数(0.63)为界,将TCGA数据库168例GBM患者均分为CCL18高表达组和低表达组。Kaplan-Meier生存分析显示,CCL18高、低表达组患者的中位OS分别为12.2个月、16.0个月,中位PFS分别为4.83个月、8.61个月,高表达组患者OS、PFS均较低表达组短(Log-rank χ2分别为7.310、14.611,P<0.01),见图2。以患者是否死亡(是=1,否=0)为因变量,以年龄(>60岁=1,≤60岁=0)、性别(男=1,女=0)、KPS评分(≥80分=1,<80分=0)、IDH状态(突变型=1,野生型=0)、CCL18表达(高表达=1,低表达=0)为自变量,单因素Cox回归分析结果显示,IDH状态和CCL18表达是GBM患者预后的影响因素,见表3。多因素Cox回归分析结果显示,IDH野生型和CCL18高表达是GBM患者死亡的独立危险因素,见表4。
2.3 列线图模型建立和验证 基于多因素Cox回归分析得出2个独立危险因素,构建影响患者生存预后的列线图预测模型,见图3。采用Bootstrap法对列线图进行内部验证,该模型C-index为0.793(95%CI:0.777~0.803)。Calibration校准曲线显示列线图预测GBM患者1年、2年和3年生存概率与实际观测结果具有较好一致性;列线图预测GBM患者1年、2年和3年生存概率的ROC曲线下面积(AUC)均大于0.6,见图4、表5。
2.4 CCL18-siRNA抑制U87MG細胞中CCL18基因表达 siRNA-CCL18组CCL18 mRNA表达水平(0.10±0.04)低于siRNA-NC组(0.60±0.18)和Mock-siRNA组(1.02±0.26),组间差异有统计学意义(F=18.360,P<0.01)。
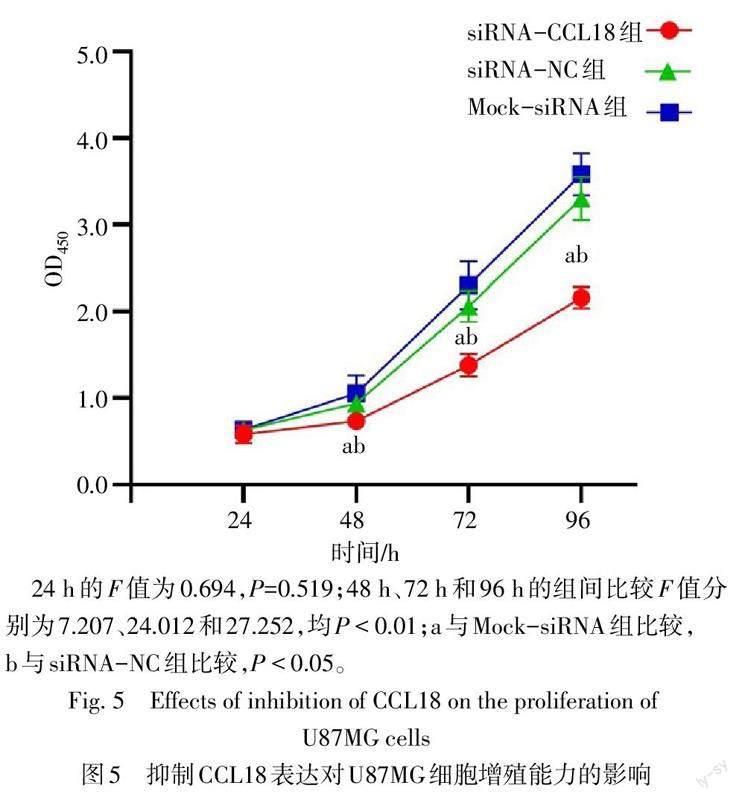
2.5 抑制CCL18表达对U87MG细胞增殖和迁移能力的影响 CCK-8实验结果显示,siRNA-CCL18组48 h、72 h和96 h的细胞增殖能力均低于siRNA-NC组和Mock-siRNA组(P<0.05),见图5。划痕愈合实验显示,siRNA-CCL18组24 h时的细胞迁移能力低于siRNA-NC组和Mock-siRNA组(P<0.05),12 h时的细胞迁移能力与siRNA-NC组和Mock-siRNA组差异无统计学意义(P>0.05),见图6、表6。
3 讨论
趋化因子是肿瘤微环境中的重要调节因子,可通过各种机制影响恶性肿瘤的细胞增殖,或间接调节血管生成和免疫细胞募集,促进肿瘤生长和转移[12]。CCL18是趋化因子的重要组成部分,与肿瘤侵袭、迁移和EMT等恶性生物学行为关系密切,在肿瘤进展中起重要作用[13]。Zeng等[14]研究发现,在乳腺癌细胞中,CCL18可通过PITPNM3激活核因子活化B细胞κ轻链增强子信号转导,增加白细胞介素(IL)-6和IL-8产生,诱导肿瘤细胞干细胞富集和介导化疗耐药,促进乳腺癌细胞的侵袭和转移。另有研究表明,CCL18在膀胱癌中呈高表达,其可通过激活G蛋白偶联受体CCR8在肿瘤的依赖性迁移和EMT中发挥重要作用[15]。另有研究者对胸腺瘤免疫相关microRNA进行生物信息学分析发现,CCL18与miR-425-5p、miR-1370-3p表达呈正相关,且可与CD8、CD68协同作用影响患者预后[16]。
本研究采用生物信息学分析显示,GBM组织中CCL18 mRNA水平高于正常脑组织,免疫组织化学染色发现GBM组织中CCL18表达水平高于正常脑组织,提示CCL18在GBM中发挥促癌作用。Gao等[17]研究结果表明,CCL18表达与胶质瘤恶性程度呈正相关,其可作为判断GBM预后及恶性生物学行为的标志物。本研究通过Kaplan-Meier生存分析发现,CCL18高表达组患者预后较低表达组差;基于TCGA数据库的多因素Cox回归分析结果显示,IDH野生型和CCL18高表达是GBM患者死亡的独立危险因素。有研究证实,缺氧可上调GBM肿瘤微环境中PITPNM3受体及CCL18表达,促进肿瘤细胞的侵袭和迁移[18]。GBM微环境中,肿瘤组织广泛缺氧,容易导致化疗耐药,笔者推测缺氧可能是引起CCL18表达升高,导致GBM患者预后较差的原因之一。
本研究根据筛选出IDH突变状态和CCL18表达2个独立影响因素,构建GBM患者生存预后的列线图模型,结果显示C-index为0.793(95%CI:0.777~0.803),校准曲线的预测值与实测值基本一致,列线图模型的时间依赖ROC曲线AUC值均大于0.6,表明构建的列线图具有较好的区分度和精准度,进一步表明CCL18是GBM患者预后的重要影响因素,且其可能为GBM的危险因子之一。
另外,本研究通过体外实验证实抑制胶质母细胞瘤U87MG细胞系CCL18的表达能降低GBM细胞的增殖和迁移能力,与Ma等[19]研究结果类似。胶质瘤相关小胶质细胞/巨噬细胞释放的CCL18在GBM进展过程中起关键作用,通过上调CCL18表达,能激活肿瘤细胞的CCR8受体,介导酸性磷酸酶5信号转导,促进GBM细胞的生长和侵袭[20]。以上结果进一步表明CCL18可调节GBM细胞的侵袭及增殖,在GBM进展中发挥重要作用。
综上,CCL18在GBM中表达上调,可促进GBM肿瘤细胞增殖和迁移;CCL18高表达和IDH野生型是GBM患者死亡的独立危险因素。本研究为GBM的靶向治疗提供了新方向。但也存在一些局限性,如生物信息学分析不够深入,纳入影响因素和临床样本有限,且未明确CCL18在GBM发生发展过程的具体作用机制,有待今后深入探讨。
参考文献
[1] KARAMI FATH M,BABAKHANIYAN K,ANJOMROOZ M,et al. Recent advances in glioma cancer treatment:conventional and epigenetic realms[J]. Vaccines,2022,10(9):1448. doi:10.3390/vaccines10091448.
[2] ALLAMI P,HEIDARI A,REZAEI N. The role of cell membrane-coated nanoparticles as a novel treatment approach in glioblastoma[J]. Front Mol Biosci,2022,9:1083645. doi:10.3389/fmolb.2022.1083645.
[3] RODR?GUEZ-CAMACHO A,FLORES-V?ZQUEZ J G,MOSCARDINI-MARTELLI J,et al. Glioblastoma treatment:state-of-the-art and future perspectives[J]. Int J Mol Sci,2022,23(13):7207. doi:10.3390/ijms23137207.
[4] PARK J H,KANG I,LEE H K. The immune landscape of high-grade brain tumor after treatment with immune checkpoint blockade[J]. Front Immunol,2022,13:1044544. doi:10.3389/fimmu.2022.1044544.
[5] KHAN F,PANG L Z,DUNTERMAN M,et al. Macrophages and microglia in glioblastoma:heterogeneity,plasticity,and therapy[J]. J Clin Invest,2023,133(1):e163446. doi:10.1172/jci163446.
[6] HUANG X J,LAI S Q,QU F L,et al. CCL18 promotes breast cancer progression by exosomal miR-760 activation of ARF6/Src/PI3K/Akt pathway[J]. Mol Ther Oncolytics,2022,25:1-15. doi:10.1016/j.omto.2022.03.004.
[7] SHEFLER I,SALAMON P,ZITMAN-GAL T,et al. Tumor-derived extracellular vesicles induce CCL18 production by mast cells:A possible link to angiogenesis[J]. Cells,2022,11(3):353. doi:10.3390/cells11030353.
[8] ARAVIND A,PALOLLATHIL A,REX D A B,et al. A multi-cellular molecular signaling and functional network map of C-C motif chemokine ligand 18 (CCL18):a chemokine with immunosuppressive and pro-tumor functions[J]. J Cell Commun Signal,2022,16(2):293-300. doi:10.1007/s12079-021-00633-3.
[9] VIVIAN J,RAO A A,NOTHAFT F A,et al. Toil enables reproducible,open source,big biomedical data analyses[J]. Nat Biotechnol,2017,35(4):314-316. doi:10.1038/nbt.3772.
[10] DEMOGEOT N,SALLERON J,RECH F,et al. Impact of fractionated stereotactic radiotherapy on activity of daily living and performance status in progressive/recurrent glioblastoma:a retrospective study[J]. Radiat Oncol,2022,17(1):201. doi:10.1186/s13014-022-02169-1.
[11] LOUIS D N,PERRY A,WESSELING P,et al. The 2021 WHO classification of tumors of the central nervous system:a summary[J]. Neuro Oncol,2021,23(8):1231-1251. doi:10.1093/neuonc/noab106.
[12] TAKACS G P,FLORES-TORO J A,HARRISON J K. Modulation of the chemokine/chemokine receptor axis as a novel approach for glioma therapy[J]. Pharmacol Ther,2021,222:107790. doi:10.1016/j.pharmthera.2020.107790.
[13] KORBECKI J,OLBROMSKI M,DZI?GIEL P. CCL18 in the progression of cancer[J]. Int J Mol Sci,2020,21(21):7955. doi:10.3390/ijms21217955.
[14] ZENG W F,XIONG L X,WU W,et al. CCL18 signaling from tumor-associated macrophages activates fibroblasts to adopt a chemoresistance-inducing phenotype[J]. Oncogene,2023,42(3):224-237. doi:10.1038/s41388-022-02540-2.
[15] LIU X Q,XU X Y,DENG W,et al. CCL18 enhances migration,invasion and EMT by binding CCR8 in bladder cancer cells[J]. Mol Med Rep,2019,19(3):1678-1686. doi:10.3892/mmr.2018.9791.
[16] WANG B,XIAO H,YANG X,et al. A novel immune-related microRNA signature for prognosis of thymoma[J]. Aging,2022,14(11):4739-4754. doi:10. 18632/aging.204108.
[17] GAO W Q,LI Y Y,ZHANG T,et al. Systematic analysis of chemokines reveals CCL18 is a prognostic biomarker in glioblastoma[J]. J Inflamm Res,2022,15:2731-2743. doi:10.2147/jir.S357787.
[18] GROCHANS S,KORBECKI J,SIMI?SKA D,et al. CCL18 expression is higher in a glioblastoma multiforme tumor than in the peritumoral area and causes the migration of tumor cells sensitized by hypoxia[J]. Int J Mol Sci,2022,23(15):8536. doi:10.3390/ijms23158536.
[19] MA L,WANG H,LI Z,et al. Chemokine (C-C motif) ligand 18 is highly expressed in glioma tissues and promotes invasion of glioblastoma cells[J]. J Cancer Res Ther,2019,15(2):358-364. doi:10.4103/jcrt.JCRT_360_17.
[20] HUANG Y,MOTTA E,NANVUMA C,et al. Microglia/macrophage-derived human CCL18 promotes glioma progression via CCR8-ACP5 axis analyzed in humanized slice model[J]. Cell Rep,2022,39(2):110670. doi:10.1016/j.celrep.2022.110670.
(2022-11-07收稿 2023-04-21修回)
(本文編辑 陈丽洁)

