CHD4调控端粒功能促进宫颈癌HeLa细胞生长的机制研究
王倩倩 李婷芳 王峰
摘要:目的 探討染色质域解旋酶DNA结合蛋白4(CHD4)通过调控端粒功能对宫颈癌HeLa细胞增殖、迁移的影响。方法 慢病毒感染构建CHD4稳定敲低的宫颈癌HeLa细胞系,实时荧光定量PCR(qPCR)和Western blot分别检测CHD4的mRNA和蛋白表达水平;将宫颈癌HeLa细胞分为对照组、shCDH4-1组、shCHD4-2组,CCK-8实验检测CHD4对HeLa细胞增殖能力的影响;集落形成实验检测细胞的集落数量;划痕愈合实验检测细胞迁移能力;裸鼠荷瘤实验观察移植瘤生长情况;免疫荧光-荧光原位杂交技术检测CHD4与HeLa细胞中端粒的共定位及各组细胞中端粒的损伤情况,端粒损伤以损伤因子γH2AX与端粒的共定位表示;中期染色体-荧光原位杂交技术检测各组细胞中端粒功能的变化,端粒信号缺失(SFE)或多端粒信号(MTS)的染色体比例升高代表端粒功能障碍。结果 慢病毒感染成功构建CHD4稳定下调的HeLa细胞系(P<0.05)。与对照组相比,shCDH4-1组和shCHD4-2组的细胞增殖能力、集落形成能力、迁移能力、体内肿瘤生长能力均明显下降(P<0.05)。免疫荧光-荧光原位杂交实验表明,CHD4定位于HeLa细胞的端粒上。与对照组相比,CHD4的缺失不足以引起端粒的DNA损伤(P>0.05),但会导致HeLa细胞SFE的染色体比例明显增多(P<0.05)。结论 CHD4可通过调控HeLa细胞的端粒功能,促进宫颈癌细胞的增殖和迁移。
关键词:HeLa细胞;端粒;宫颈肿瘤;细胞增殖;染色质域解旋酶DNA结合蛋白4
中图分类号:R737.33文献标志码:ADOI:10.11958/20222091
Study on the mechanism of CHD4 regulating telomere function to promote cervical cancer HeLa cell proliferation
WANG Qianqian, LI Tingfang, WANG Feng
School of Basic Medical Sciences, Tianjin Medical University, Tianjin 300070, China
Corresponding Author E-mail: wangf@tmu.edu.cn
Abstract: Objective To investigate the effect of chromodomain helicase DNA-binding protein 4 (CHD4) on the proliferation and migration of cervical cancer HeLa cells by regulating telomeres function. Methods CHD4-depleted HeLa cell lines were constructed by lentivirus infection. The mRNA and protein expression levels of CHD4 were detected by real-time fluorescence quantitative PCR (qPCR) and Western blot assay. Cervical cancer HeLa cells were divided into the control group, the shCDH4-1 group and the shCHD4-2 group. The effect of CHD4 on cell proliferation of HeLa cells was detected by CCK-8 assay. The colony formation assay was performed to detect the number of cell colonies. Scratch-healing assay was performed to detect cell migration. In vivo, the tumor formation experiment was used to observe the growth changes of xenograft in nude mice. Immunofluorescence-fluorescence in situ hybridization was performed to detect the co-localization of telomeres and CHD4 in HeLa cells, and the level of damage at telomeres in each group. Telomere damage was indicated by the co-localization of damage factor γH2AX with telomeres. Metaphase-telomere fluorescence in situ hybridization was performed to detect changes in telomere function in each group, and the increased proportion of chromosomes with telomere signal deletion (SFE) or multiple telomere signals (MTS) represented telomere dysfunction. Results HeLa cell lines with stable down-regulated CHD4 were successfully constructed after lentiviral infection (P<0.05). Compared with the control group, the cell proliferation ability, colony formation ability, migration ability and tumor growth ability in vivo were significantly decreased in the shCHD4-1 group and the shCHD4-2 group (P<0.05). Immunofluorescence-fluorescence in situ hybridization assay showed that CHD4 localized to telomeres of HeLa cells. Compared with the control group, the deletion of CHD4 was insufficient to cause DNA damage at telomeres (P>0.05). However, the proportion of SFE chromosomes in HeLa cells increased significantly (P<0.05). Conclusion CHD4 can promote the proliferation and migration of HeLa cells by regulating telomere function.
Key words: HeLa cells; telomere; uterine cervical neoplasms; cell proliferation; chromodomain helicase DNA-binding protein 4
全球每年约有64万宫颈癌的新发病例及34万的死亡病例[1]。尽管人乳头瘤病毒(human papillomavirus,HPV)疫苗的接种率呈上升趋势,但宫颈癌仍然是女性四大常见的恶性肿瘤之一[1-2]。目前,手术、放疗和化疗是宫颈癌经典和有效的治疗方法[3]。端粒是位于真核生物线性染色体末端的特殊结构,能够维持基因组的稳定[4]。绝大多数肿瘤通过激活端粒酶来维持端粒长度,实现永生化[5]。据报道,核小体重塑和组蛋白去乙酰化酶复合物(nucleosome remodeling and deacetylase complex,NuRD)能够参与端粒功能的维持[6]。染色质域解旋酶DNA结合蛋白4(chromodomain helicase DNA-binding protein 4,CHD4)是NuRD复合体的关键催化亚基,参与细胞分化、细胞周期调节和DNA损伤修复[7-8],且CHD4的表达与多种恶性肿瘤患者的预后相关[9]。然而CHD4在宫颈癌中的作用尚未见报道。本研究旨在探究CHD4通过调控端粒功能对宫颈癌HeLa细胞增殖、迁移的影响,为宫颈癌治疗提供潜在靶点。
1 材料与方法
1.1 材料 人宫颈癌HeLa细胞为天津市细胞稳态与人类重大疾病重点实验室保存。RPMI1640培养基、基质胶均购自美国Corning公司。胰蛋白酶购自美国Gibco公司。胎牛血清购自乌拉圭Lonsera公司。RNA提取试剂盒购自美国Promega公司。逆转录试剂盒和实时荧光定量试剂盒均购自Invitrogen公司。磷酸盐缓冲液(PBS)、4%多聚甲醛、1 mol/L Tris-HCl(pH=7.2)、Tris缓冲盐溶液(TBS)、牛血清白蛋白(BSA)、高效RIPA裂解液购自北京索莱宝公司。甲酰胺、明胶(Gelatin)、吐温-20(Tween-20)、Triton X-100均购自美国Sigma公司。秋水仙素购自以色列BI生物科技公司。鼠源γH2AX一抗购自Millpore公司,鼠源CHD4一抗购自Abcam公司,兔源β-Tubulin一抗和羊抗兔二抗均购自Affinity公司,羊抗鼠二抗购自美国Immunoway公司。TelC-FITC探针488、CY3均购自Panagene公司。Aleax 555羊抗鼠二抗购自Thermo公司。CCK-8检测试剂盒购自兰杰柯科技有限公司。荧光倒置显微镜购自日本Nikon公司。Western blot电泳仪、酶标仪购自美国Bio-Rad公司。短发夹RNA(shRNA)序列由生工生物工程(上海)股份有限公司合成。8只SPF级雌性裸鼠,4周龄,体质量14~16 g,购自北京维通利华公司,动物生产许可证号:SCXK(京)2021-0006。
1.2 方法
1.2.1 细胞培养及分组 将人宫颈癌HeLa细胞分为阴性对照组(shRNA靶向无义序列)和CHD4敲低组(包括shCHD4-1组、shCHD4-2组,2条shRNA分别靶向干扰CHD4序列),细胞均于RPMI1640培养基(含10%胎牛血清,1%青链霉素双抗)和37 ℃,5%CO2细胞培养箱中培养。
1.2.2 慢病毒感染及稳定细胞株筛选 靶向CHD4的2条短发夹RNA(shRNA)序列分别为5′-GCTGACACAGTTATTATCTAT-3′和5′-GGTGTTATGTCTTTGATTC-3′;阴性对照组shRNA序列为5′-TTCTCCGAACGTGTCACGT-3′。构建pLKO.1-Puro-shCHD4质粒,测序确认质粒成功构建。将包装质粒pMG2.G、psPAX2与pLKO.1-Puro-shCHD4质粒共同转染到293T细胞内,收集48 h病毒上清。同时接种适量细胞于6孔板中,待细胞汇合至60%后加入病毒上清,放置于细胞培养箱中。感染24 h后更换为含10%FBS的新鲜培养基,继续培养24 h。加入嘌呤霉素(2 mg/L)筛选阳性细胞,待无病毒感染对照细胞死亡后,停止筛选进行后续实验。
1.2.3 RNA提取与实时荧光定量PCR(qPCR)检测HeLa细胞中CHD4 mRNA表达 RNA试剂盒提取细胞总RNA。按照逆转录试剂盒说明书将1 μg总RNA逆转录为cDNA。以cDNA为模板进行qPCR。反应程序为:95 ℃预变性3 min;95 ℃变性10 s,60 ℃退火20 s,72 ℃延伸30 s,共40个循环。以GAPDH为内参,根据扩增曲线的Ct值用2-ΔΔCt公式计算CHD4 mRNA的相对表达水平。GAPDH上游引物5′-CGACAGTCAGCCGCATCTT-3′,下游引物5′-CCCCATGGTGTCTGAGCG-3′;CHD4上游引物5′-AGTGCTGCAACCATCCATACCTCT-3′,下游引物5′-ATGCCCACCCTCCTTAAGGTTCTT-3′。
1.2.4 Western blot检测HeLa細胞中CHD4蛋白的表达水平 RIPA裂解液提取细胞总蛋白,BCA法测定总蛋白浓度。30 μg的细胞总蛋白经电泳分离后,转至0.45 μm的PVDF膜上,5%的脱脂奶粉室温封闭1 h,CHD4(1∶1 000)、β-Tubulin(1∶2 000)一抗孵育,摇床4 ℃过夜。二抗(羊抗鼠1∶5 000,羊抗兔1∶8 000)室温孵育1 h,洗膜后曝光显影。Image J分析灰度值并进行归一化处理。
1.2.5 CCK-8检测细胞增殖 将各组细胞计数后接种于96孔板中(1 000个/孔),每组设6个复孔,分别培养1、3、5 d。检测前每孔避光加入CCK-8试剂(每100 μL培养基中加入10 μL CCK-8)。1 h后使用酶标仪检测450 nm波长处的光密度(OD)值。
1.2.6 集落形成实验检测细胞的集落数量 将800个细胞接种于6孔板中,继续培养2周,待细胞长出肉眼可见的细胞集落时,终止培养,PBS洗2次,甲醛固定20 min,结晶紫染色20 min,去离子水清洗后,晾干培养皿,相机拍照,Image J软件计数图片中的细胞集落数量。
1.2.7 划痕愈合实验检测细胞迁移 将各组细胞接种于6孔板中,待细胞汇合至100%时,用100 μL的枪头在孔板内垂直划线,产生细胞划痕。PBS冲洗,无血清培养基中继续培养24 h,显微镜下观察0 h和24 h的划痕迁移率。划痕迁移率(%)=(0 h划痕面积-24 h划痕面积)/0 h划痕面积×100%。
1.2.8 裸鼠成瘤实验 由于shCHD4-2组敲低效率较高,对细胞的生长抑制比较明显,且裸鼠荷瘤所需细胞量较大,shCHD4-2组的细胞量不能达到注射前所需细胞数量,因此选用shCHD4-1组细胞进行裸鼠荷瘤。将1×107个对照组和shCHD4-1组的HeLa细胞悬浮于 50 μL的PBS中,将基质胶按1∶1比例加入,全程冰上操作。选择裸鼠左前肢腋下处皮下接种,将裸鼠分为对照组和shCHD4-1组,每组4只,20 d后处死裸鼠,取出肿瘤并进行称质量和拍照。
1.2.9 免疫荧光-荧光原位杂交(IF-FISH) 提前将适量细胞接种于含盖玻片的6孔板中,待细胞贴壁生长至汇合度达到80%时,用2%多聚甲醛固定20 min,0.5%Triton X-100的PBS通透20 min。将含有TelC-FITC探针的杂交液与细胞共孵育,85 ℃变性3 min后于室温避光杂交2 h。洗液A(70%甲酰胺,1 mol/L Tris HCl,pH=7.2,10% BSA,无菌水)洗涤15 min,2次。洗液B(0.1% Tween-20,TBS)洗涤5 min,3次。室温下用封闭液(PBS∶BSA∶Gelatin=1∶1∶100)孵育1 h后,一抗(CHD4为1∶10 000,γH2AX为1∶1 000)避光孵育1 h,含0.1% Tween-20的PBS避光振荡5 min,4次。荧光二抗(1∶2 000)避光孵育30 min。之后用70%、90%、100%的乙醇梯度脱水各2 min,晾干后每张细胞爬片用10 μL DAPI封片,荧光显微镜下观察拍摄,统计每个细胞核中端粒与γH2AX的共定位个数的平均值检测端粒损伤情况。
1.2.10 中期染色体-荧光原位杂交(Metaphase-FISH)检测端粒功能 传代培养细胞,待细胞密度达到80%左右时加入秋水仙素,终质量浓度为0.1 mg/L。培养6 h后进行中期染色体制备。收集细胞沉淀,逐滴加入37 ℃预热的0.075 mol/L氯化钾低渗液至10 mL,37 ℃低渗30 min。逐滴加入10 mL固定液(甲醇∶冰乙酸=3∶1),室温静置30 min。随后根据细胞沉淀加入适量固定液,将细胞悬液滴片。4%多聚甲醛固定,70%、90%、100%的乙醇梯度脱水后杂交直至封片。后续操作步骤同实验方法1.2.9。统计每个中期染色体分裂相中含端粒信號缺失(SFE)和多端粒信号(MTS)的染色体比例,比例升高代表端粒功能障碍。
1.3 统计学方法 采用SPSS 25.0软件进行数据分析。符合正态分布的计量资料以均数[±]标准差(x±s)表示。2组间比较采用独立样本t检验;多组间比较采用单因素方差分析,组间多重比较采用LSD法;不符合正态分布的计量资料以M(P25,P75)表示,组间比较采用Kruskal-Wallis H检验。不同时间点多组间比较采用重复测量方差分析。P<0.05为差异有统计学意义。
2 结果
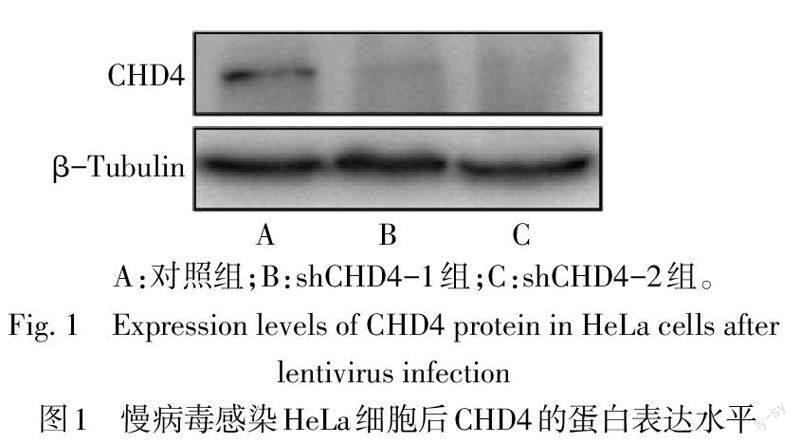
2.1 慢病毒感染HeLa细胞后CHD4的表达 与对照组相比,慢病毒感染后,在敲低CHD4的细胞系中,CHD4的mRNA及蛋白表达水平均降低(P<0.05),见图1、表1。
2.2 抑制CHD4表达对HeLa细胞增殖活力的影响 CCK-8实验结果表明,与对照组相比,第5天时shCHD4-1组和shCHD4-2组的OD450值均下降(P<0.05),见表2。
2.3 抑制CHD4表达对HeLa细胞集落形成、迁移能力的影响 与对照组相比,shCDH4-1组和shCHD4-2组的集落形成数量、细胞迁移率均降低(P<0.05),见图2、3,表3。
2.4 抑制CHD4表达对裸鼠体内肿瘤生长的影响 裸鼠成瘤结果显示,与对照组相比,shCHD4-1组裸鼠体内移植瘤质量降低[(0.10±0.03)g vs. (0.04±0.01)g,n=4,t=4.533,P<0.01],见图4。
2.5 CHD4在HeLa细胞的端粒处的定位情况 IF-FISH结果表明,CHD4定位于HeLa细胞的端粒上,见图5。
2.6 CHD4对HeLa细胞中端粒DNA损伤的影响 对照组、shCHD4-1组和shCHD4-2组中每个细胞核中端粒与γH2AX的共定位数分别为(0.26±0.09)个、(0.26±0.12)个和(0.20±0.05)个,组间比较差异无统计学意义(n=3,F=0.441,P>0.05),见图6。
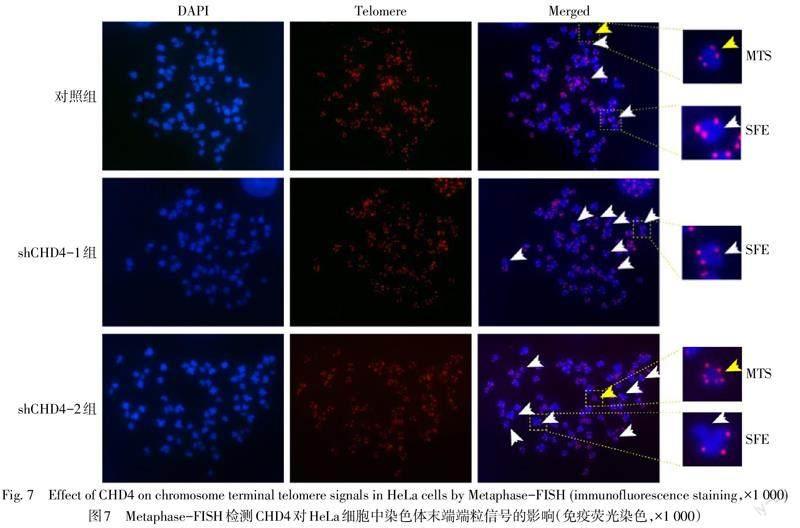
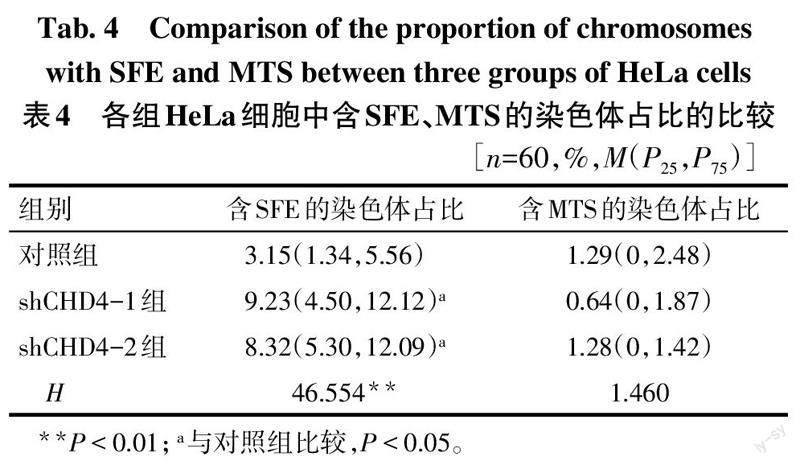
2.7 CHD4对端粒功能的影响 Metaphase-FISH结果表明,与对照组相比,CHD4的缺失导致HeLa细胞中SFE的染色体所占比例增多(P<0.05),而各组间含MTS的染色体比例的差异无统计学意义(P>0.05),见图7、表4。
3 讨论
宫颈癌容易早期转移,且预后不良,5年生存率低至30%~60%[10]。尽管手术、化疗和放疗等治疗方法已经取得了较大进步,但化疗药物会导致严重的肝肾毒性及耐药性,这也是局部晚期宫颈癌治疗的主要问题[11-12]。放疗被认为是宫颈癌患者不可或缺的治疗方法,特别是对于晚期宫颈癌患者。但有研究发现,接受放疗后的宫颈癌患者更易患上盆腔器官的第二原发性癌症[13]。因此,深入探究宫颈癌进展的分子机制,寻找新的靶点对宫颈癌的治疗具有重要临床意义。
CHD4作為NuRD复合物的关键催化亚基,在染色质重塑和基因调节过程中发挥重要作用。随着研究的深入,越来越多的证据表明,CHD4作为致癌因子参与多种肿瘤的发生与进展。如Xia等[14]研究发现CHD4可抑制抑癌基因的表达,并促进结直肠癌的增殖、侵袭和迁移;D'Alesio等[15]通过RNAi筛选发现CHD4是乳腺癌必不可少的生长因子,抑制CHD4的表达可显著抑制小鼠体内乳腺癌肿瘤的生长。最近一项研究表明,胃癌患者中肿瘤的耐药性与CHD4的上调有关,敲低CHD4可增强胃癌对化疗药物的敏感性,并抑制肿瘤生长[16]。本研究结果发现,利用shRNA靶向抑制CHD4表达后,宫颈癌HeLa细胞的增殖活力、集落形成数量及迁移能力明显降低,体内成瘤实验进一步证实下调CHD4能抑制宫颈癌裸鼠移植瘤的生长。以上结果进一步印证了CHD4的促癌作用,提示CHD4是宫颈癌的促癌因子,可能作为宫颈癌治疗的潜在靶点。
癌细胞与体细胞最大区别在于癌细胞能够绕过“海弗利克(Hayflick)极限”并进行无限增殖,这依赖于端粒功能的稳定和端粒长度的维持[17]。由于末端复制问题的存在,随着每一轮的DNA复制和细胞分裂,端粒会逐渐缩短,最终触发复制性衰老[18]。正常体细胞中,端粒的进行性缩短是不可逆的,但肿瘤细胞会激活端粒维持机制来获得无限增殖的能力[19]。因此,参与端粒功能维持的因子可视为潜在的抗癌治疗的靶点。Alder等[20]表明端粒功能障碍可导致肺泡干细胞功能衰竭。最近的研究发现,部分特发性肺纤维化患者表现出端粒丢失和端粒DNA损伤增加,导致成纤维细胞生长缺陷[21]。Conomos等[6]研究表明,NuRD复合体通过锌指蛋白ZNF827定位到端粒上,从而促进端粒功能的维持。本研究发现,在宫颈癌HeLa细胞中,NuRD复合体的核心亚基CHD4能够定位在HeLa细胞的端粒处,提示CHD4参与HeLa细胞的端粒维持。尽管CHD4的缺失并没有引起γH2AX与端粒定位的明显变化,即CHD4缺失不会造成端粒区DNA损伤,但导致HeLa细胞端粒信号丢失的染色体比例明显增加,表明CHD4能够维持端粒的稳定,防止端粒功能紊乱,进而增强HeLa细胞的生存能力。
综上所述,CHD4能促进宫颈癌HeLa细胞的增殖、迁移以及宫颈癌肿瘤的生长,这可能与CHD4调控端粒功能有关。本研究初步证实了CHD4可能是临床中宫颈癌治疗的潜在靶点,为探索宫颈癌的发病机制及临床药物开发提供了理论支持。
参考文献
[1] SUNG H,FERLAY J,SIEGEL R L,et al. Global cancer statistics 2020:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin,2021,71(3):209-249. doi:10.3322/caac.21660.
[2] COHEN P A,JHINGRAN A,OAKNIN A,et al. Cervical cancer[J]. Lancet,2019,393(10167):169-182. doi:10.1016/S0140-6736(18)32470-X.
[3] ABU-RUSTUM N R,YASHAR C M,BEAN S,et al. NCCN guidelines insights:cervical cancer,version 1.2020[J]. J Natl Compr Canc Netw,2020,18(6):660-666. doi:10.6004/jnccn.2020.0027.
[4] BEJARANO L,BOSSO G,LOUZAME J,et al. Multiple cancer pathways regulate telomere protection[J]. EMBO Mol Med,2019,11(7):e10292. doi:10.15252/emmm.201910292.
[5] GUTERRES A N,VILLANUEVA J. Targeting telomerase for cancer therapy[J]. Oncogene,2020,39(36):5811-5824. doi:10.1038/s41388-020-01405-w.
[6] CONOMOS D,REDDEL R R,PICKETT H A. NuRD-ZNF827 recruitment to telomeres creates a molecular scaffold for homologous recombination[J]. Nat Struct Mol Biol,2014,21(9):760-770. doi:10.1038/nsmb.2877.
[7] ZHAO H,HAN Z,LIU X,et al. The chromatin remodeler Chd4 maintains embryonic stem cell identity by controlling pluripotency- and differentiation-associated genes[J]. J Biol Chem,2017,292(20):8507-8519. doi:10.1074/jbc.M116.770248.
[8] LARSEN D H,POINSIGNON C,GUDJONSSON T,et al. The chromatin-remodeling factor CHD4 coordinates signaling and repair after DNA damage[J]. J Cell Biol,2010,190(5):731-740. doi:10.1083/jcb.200912135.
[9] WANG H C,CHOU C L,YANG C C,et al. Over-expression of CHD4 is an independent biomarker of poor prognosis in patients with rectal cancers receiving concurrent chemoradiotherapy[J]. Int J Mol Sci,2019,20(17):4087. doi:10.3390/ijms20174087.
[10] DU P,LI G,WU L,et al. Perspectives of ERCC1 in early-stage and advanced cervical cancer:From experiments to clinical applications[J]. Front Immunol,2022,13:1065379. doi:10.3389/fimmu.2022.1065379.
[11] SCATCHARD K,FORREST J L,FLUBACHER M,et al. Chemotherapy for metastatic and recurrent cervical cancer[J]. Cochrane Database Syst Rev,2012,10(10):CD006469. doi:10.1002/14651858.CD006469.pub2.
[12] FEDERICO C,SUN J,MUZ B,et al. Localized delivery of cisplatin to cervical cancer improves its therapeutic efficacy and minimizes its side effect profile[J]. Int J Radiat Oncol Biol Phys,2021,109(5):1483-1494. doi:10.1016/j.ijrobp.2020.11.052.
[13] CHEN M,PAN X,WANG H,et al. The risk and latency evaluation of secondary primary malignancies of cervical cancer patients who received radiotherapy:A study based on the SEER database[J]. Front Oncol,2022,12:1054436. doi:10.3389/fonc.2022.1054436.
[14] XIA L,HUANG W,BELLANI M,et al. CHD4 has oncogenic functions in initiating and maintaining epigenetic suppression of multiple tumor suppressor genes[J]. Cancer Cell,2017,31(5):653-668.e7. doi:10.1016/j.ccell.2017.04.005.
[15] D'ALESIO C,PUNZI S,CICALESE A,et al. RNAi screens identify CHD4 as an essential gene in breast cancer growth[J]. Oncotarget,2016,7(49):80901-80915. doi:10.18632/oncotarget.12646.
[16] WU J,ZHOU Z,LI J,et al. CHD4 promotes acquired chemoresistance and tumor progression by activating the MEK/ERK axis[J]. Drug Resist Updat,2023,66:100913. doi:10.1016/j.drup.2022.100913.
[17] ROUSSEAU P,AUTEXIER C. Telomere biology:Rationale for diagnostics and therapeutics in cancer[J]. RNA Biol,2015,12(10):1078-1082. doi:10.1080/15476286.2015.1081329.
[18] LU R,PICKETT H A. Telomeric replication stress: the beginning and the end for alternative lengthening of telomeres cancers[J]. Open Biol,2022,12(3):220011. doi:10.1098/rsob.220011.
[19] YUAN X,DAI M,XU D. Telomere-related markers for cancer[J]. Curr Top Med Chem,2020,20(6):410-432. doi:10.2174/1568026620666200106145340.
[20] ALDER J K,BARKAUSKAS C E,LIMJUNYAWONG N,et al. Telomere dysfunction causes alveolar stem cell failure[J]. Proc Natl Acad Sci U S A,2015,112(16):5099-5104. doi:10.1073/pnas.1504780112.
[21] KELICH J,ARAMBURU T,VAN DER VIS J J,et al. Telomere dysfunction implicates POT1 in patients with idiopathic pulmonary fibrosis[J]. J Exp Med,2022,219(5):e20211681. doi:10.1084/jem.20211681.
(2022-12-21收稿 2023-04-20修回)
(本文編辑 李国琪)

