PET/CT影像组学结合LncRNA-DGCR5在NSCLC精准医疗中的应用研究
张振华 付伟 刘伟良 李俊彦 黄涛 胡辉 范志刚
摘要:目的 研究PET/CT影像组学结合长链非编码RNA DiGeorge综合征临界区基因5(LncRNA-DGCR5)在非小细胞肺癌(NSCLC)精准医疗中的应用价值。方法 106例NSCLC患者均接受PET/CT检查及放化疗治疗,根据治疗后实体肿瘤疗效评价标准(RECIST)对其进行疗效评价,将完全缓解和部分缓解患者纳入治疗有反应组(58例),疾病稳定和疾病进展患者纳入治疗无反应组(48例)。比较2组患者的PET/CT图像纹理参数[最大标准摄取值(SUVmax)、平均值、方差、峰度、偏度、对比度、熵、能量];实时荧光定量PCR检测外周血LncRNA-DGCR5表达;构建受试者工作特性(ROC)曲线分析各指标对NSCLC患者疗效的预测价值。结果 有反应组SUVmax、熵及LncRNA-DGCR5表达低于无反应组(P<0.05),能量高于无反应组(P<0.05),其余参数比较差异无统计学意义;以LncRNA-DGCR5表达均值2.01为临界值,将患者分为LncRNA-DGCR5低表达组(51例)和高表达组(55例),与LncRNA-DGCR5低表達组比较,LncRNA-DGCR5高表达组PET/CT纹理参数中SUVmax、熵升高,能量降低(P<0.05);ROC曲线结果显示,SUVmax、熵、能量及LncRNA-DGCR5预测NSCLC患者疗效的AUC分别为0.897、0.851、0.795和0.949,且联合预测的AUC最高,为0.998。结论 PET/CT影像组学结合LncRNA-DGCR5有助于预测NSCLC患者的疗效,从而在NSCLC精准医疗中提供指导。
关键词:癌,非小细胞肺;体层摄影术,发射型计算机;RNA,长链非编码;DiGeorge综合征临界区基因5;精准医疗
中图分类号:R734.2,R814.42文献标志码:ADOI:10.11958/20221865
Application of PET/CT radiomics combined with LncRNA-DGCR5 in
precision medicine of NSCLC
ZHANG Zhenhua FU Wei LIU WeiliangLI Junyan HUANG Tao HU Hui FAN Zhigang
1 Department of Cardiothoracic Surgery, 2 Department of Medical Oncology, 3201 Hospital, Xi an 723000, China
△Corresponding Author E-mail: fanzg0414@163.com
Abstract: Objective To study the application value of PET/CT radiomics combined with long noncoding RNA DiGeorge syndrome critical region gene 5 (LncRNA-DGCR5) in the precision medicine of non-small cell lung cancer (NSCLC). Methods A total of 106 NSCLC patients received PET/CT examination and chemoradiotherapy, and their efficacy was evaluated according to the Evaluation Criteria for Solid Tumor Efficacy after Treatment (RECIST). Patients with complete remission and partial remission were included in the response group (58 cases), and patients with stable or progressive disease were included in the non-response group (48 cases). Image texture parameters of PET/CT including SUVmax (maximum standard value), mean value, variance, kurtosis, skewness, contrast, entropy and energy were compared between groups. Real-time fluorescence quantitative PCR was used to detect LncRNA-DGCR5 expression in peripheral blood. Receiver operating characteristic curve (ROC) was constructed to analyze the predictive value of each index to the therapeutic efficacy of NSCLC patients. Results The SUVmax value, entropy and expression of LncRNA-DGCR5 were significantly lower in the response group than those in the non-response group (P<0.05), and the energy was significantly higher in the response group than that in the non-response group (P<0.05). There were no significant differences in the other parameters between the two groups. Patients were divided into the low LncRNA-DGCR5 expression group (51 cases) and the high LncRNA-DGCr5 expression group (55 cases) according to the mean expression of LncRNA-DGCR5 (2.01) as the critical value. Compared with the low LncRNA-DGCR5 expression group, the PET/CT image texture parameters of SUVmax and entropy were significantly increased in the high LncRNA-DGCR5 expression group, and the energy was significantly decreased (P<0.05). ROC curve construction showed that the AUCs of SUVmax value, entropy, energy and LncRNA-DGCR5 expression on predicting the treatment efficacy of patients with NSCLC were 0.897, 0.851, 0.795 and 0.949 respectively, and the AUC of combined prediction was the highest at 0.998. Conclusion PET/CT radiomics combined with LncRNA-DGCR5 is helpful to predict the treatment efficacy of patients with NSCLC, thus providing the guidance for precision medicine of NSCLC.
Key words: carcinoma, non-small-cell lung; tomography, emission-computed; RNA, Long Noncoding; DiGeorge syndrome critical region gene 5; precision medicine
肺癌是男性发病率及病死率较高的恶性肿瘤,患者5年生存率约为19%,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)占肺癌总数的85%以上[1]。NSCLC的治疗方法包括手术、放疗、化疗、免疫治疗、分子靶向治疗等,但患者生存预后仍不理想[2]。及时预测NSCLC对各种治疗的敏感性,有助于为患者制定个体化的治疗方案。影像组学作为影像学领域中的一门新兴学科,在肿瘤诊断、治疗效果的评价以及预后评估等方面具有重要价值。PET/CT能够反映病变组织内的代谢情况,从而预测NSCLC对治疗的反应[3]。研究认为,PET/CT纹理特征分析对实体肿瘤术前肿瘤分期预测、疗效评价以及预后评估均具有一定的应用价值[4]。但目前PET/CT纹理特征分析在NSCLC精准医疗中的报道甚少。长链非编码RNA(LncRNA)是一类长度超过200个核苷酸的非编码RNA,其能够在转录后和转录水平调节基因表达,从而调节恶性细胞表型[5]。长链非编码RNA DiGeorge综合征临界区基因5(LncRNA-DGCR5),也称为LncRNA0037,首次发现于亨廷顿病,此后研究发现LncRNA-DGCR5在肺癌、肝癌、乳腺癌等多种恶性肿瘤中发挥着重要作用[6]。LncRNA-DGCR5可通过靶向miR-218-5p增强NSCLC细胞的迁移和侵袭[7],提示其可能是NSCLC的潜在治疗靶点。临床中尚缺乏功能影像组学结合分子生物学靶标预测NSCLC疗效的研究。本研究旨在探讨PET/CT影像组学结合LncRNA-DGCR5在NSCLC精准医疗中的应用价值。
1 对象与方法
1.1 研究对象 选取2020年1月—2022年4月三二〇一医院收治的106例NSCLC患者,其中男59例,女47例;年龄48~85岁,平均(66.18±8.42)岁;病理类型:腺癌55例,鳞癌51例。纳入标准:(1)经手术病理或穿刺活检病理明确诊断,且为Ⅲ期NSCLC患者。(2)入组前未接受任何抗肿瘤治疗。(3)于治疗前1周接受PET/CT检查。排除标准:(1)既往恶性肿瘤史者。(2)预估生存时间大于3个月的患者。本研究经过医院伦理批准[院伦理审(2021)018号],全部患者知情同意。
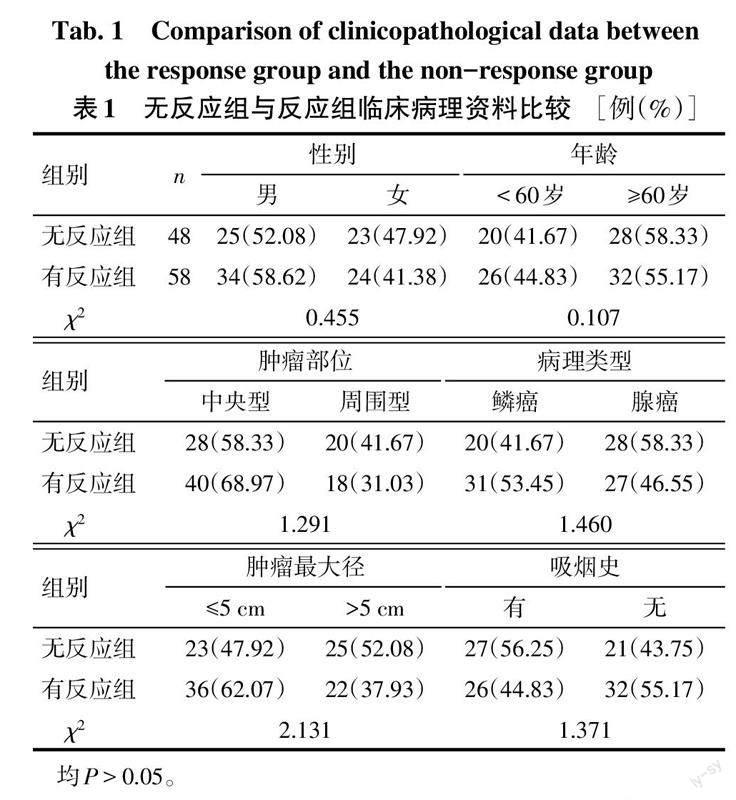
1.2 治疗方法及疗效评价 患者均进行放化疗治疗。采用三维适形放疗,使用10或15 MV-X线照射,以肺部原发灶及转移淋巴结作为临床治疗靶区,并外放5~7 mm作为计划治疗靶区,剂量分割:1.8~2.0 Gy/次,5次/周,总剂量为60~65 Gy。于放疗开始第2天进行第1周期化疗。腺癌:75 mg/m2顺铂+500 mg/m2培美曲塞;鳞癌:75 mg/m2顺铂+25 mg/m2长春瑞滨或75 mg/m2顺铂+175mg/m2紫杉醇,1个化疗周期为21 d,共化疗4个周期。化疗结束后根据实体肿瘤疗效评价标准(RECIST)Version1.1进行疗效评价,分为完全缓解(24例)、部分缓解(34例)、疾病稳定(32例)以及疾病进展(16例),其中完全缓解和部分缓解患者纳入治疗有反应组(58例),疾病稳定和疾病进展患者纳入治疗无反应组(48例)。收集有反应组与无反应组患者性别、年龄、肿瘤部位、病理类型、肿瘤最大径及吸烟史。
1.3 PET/CT图像获取、重建及纹理特征提取 于检查前嘱咐患者禁食4 h以上,按照患者的体质量静脉注射3.7 MBq/kg的18F-FDG(由北京恒益德科技有限公司,放射化学纯度>98%),1 h后采集患者体部图像,从患者颅骨顶端至大腿中部进行扫描。采用荷兰飞利浦公司生产的Gemini TF 16 PET/CT仪器进行检查,CT扫描电压120 kV,电流100 mA,采用三维模式进行PET扫描,采集时间为1 min/床位,共6~7个床位。PET图像采用CT数据进行衰减校正,迭代法重建,获得全身PET、CT图像以及PET/CT融合图像。根据PET/CT图像勾画感兴趣区(region of interest,ROI),采用三维方式测量NSCLC原发灶传统代谢参数,包括最大标准摄取值(maximum standardized uptake value,SUVmax)。由2名具有丰富经验的核医学医师手动勾画ROI,意見不一致时通过协商达成一致。使用A.K软件完成PET/CT图像分割、纹理特征参数的提取和筛选,得到相关纹理特征参数,包括平均值、方差、峰度、偏度、对比度、熵、能量。
1.4 实时荧光定量PCR检测LncRNA-DGCR5表达 收集患者外周血标本,立即置于抗凝管中,3 000 r/min离心10 min,取上层血浆。采用Trizol法(由北京艾德莱生物科技有限公司提供)提取总RNA,并测定RNA纯度和浓度。以RNA为模板,采用TakaRa逆转录试剂盒[宝生物工程(大连)有限公司]合成cDNA。采用实时荧光定量PCR试剂盒(上海俊晟生物科技有限公司)扩增cDNA。反应体系为10 μL;反应条件:95 ℃预变性1 min;95 ℃ 15 s,60 ℃ 30 s,72 ℃ 30 s,40个循环。引物由南京金斯瑞生物科技有限公司合成,LncRNA-DGCR5引物:上游5′-CACACGCATGGAAAACCCAG-3′,下游5′-GAGGACCTGAGCTGTAAGCC-3′,产物大小319 bp;内参GAPDH引物:上游5′-GCACCGTCAAGGCTGAGAAC-3′,下游5′-TGGTGAAGACGCCAGTGGA-3′,产物大小267 bp。采用2-ΔΔCt法计算NSCLC患者外周血LncRNA-DGCR5相对表达量。
1.5 统计学方法 采用SPSS 26.0软件进行数据分析,计量资料以x±s表示,组间比较采用独立样本t检验;计数资料以例或例(%)表示,组间比较行χ2检验。采用受试者工作特征(ROC)曲线和曲线下面积(AUC)评价PET/CT纹理参数及LncRNA-DGCR5对NSCLC患者疗效的预测价值。P<0.05为差异有统计学意义。
2 结果
2.1 有反应组与无反应组临床病理资料比较 有反应组与无反应组性别、年龄、肿瘤部位、肿瘤最大径、病理类型、吸烟史比较差异均无统计学意义,见表1。
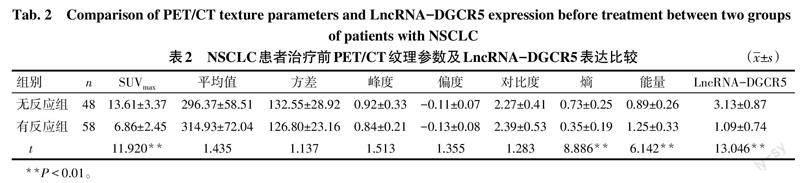
2.2 NSCLC患者治疗前PET/CT纹理参数及LncRNA-DGCR5表达比较 有反应组SUVmax、熵及LncRNA-DGCR5表达低于无反应组(P<0.05),能量高于无反应组(P<0.05),其余参数比较差异无统计学意义,见表2。
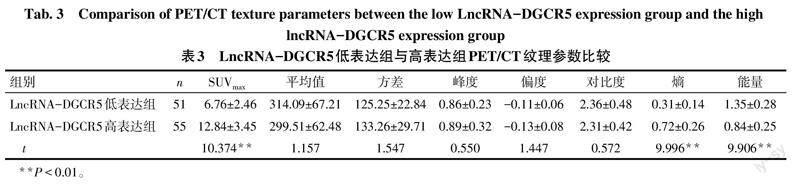
2.3 NSCLC患者LncRNA-DGCR5表达与PET/CT纹理参数关系 以LncRNA-DGCR5表达均值2.01为临界值,将患者分为LncRNA-DGCR5低表达组(≤2.01,51例)和高表达组(>2.01,55例)。与LncRNA-DGCR5低表达组比较,LncRNA-DGCR5高表达组PET/CT纹理参数中SUVmax、熵升高,能量降低(P<0.01),见表3。
2.4 PET/CT纹理参数及LncRNA-DGCR5表达对NSCLC患者疗效的预测价值 ROC曲线结果显示,SUVmax、熵、能量及LncRNA-DGCR5预测NSCLC患者疗效的AUC分别为0.897、0.851、0.795和0.949,且联合预测的AUC最高,为0.998。见表4、图1。
3 讨论
约70%的NSCLC患者确诊时即处于晚期,错失最佳手术时机,放疗、化疗、分子靶向治疗以及免疫治疗成为其常用治疗手段[8]。放疗能够诱导局部和全身免疫反应,对于无法手术的Ⅲ期NSCLC患者,其标准治疗方案为进行以铂类为基础的同步放化疗,加上使用程序性细胞死亡蛋白-1(PD-1)及其配体(PD-L1)抑制剂度伐单抗[9]。尽早预测疗效有助于临床医师制定个体化的治疗方案,从而减少不合理治疗给患者带来的痛苦,同时也有利于减轻患者医疗负担。
既往纹理研究多从CT图像中提取纹理特征进行分析,但不同研究结果差异较大,因此有学者提出研究纹理参数随代谢摄取的异质性变化[10]。PET/CT是一种用于肿瘤诊断及分期的多模态成像技术,其原理为肿瘤细胞葡萄糖代谢升高、葡萄糖转运蛋白表达和己糖激酶活性增加,已在临床上被广泛应用于肿瘤分期预测[11]。目前PET/CT也越来越多地被用于评估治疗反应及预测治疗结果[12-13]。SUVmax是PET/CT半定量分析中最常用的参数,其值随肿瘤恶性程度的升高而升高[14]。任树华等[15]研究表明,NSCLC原发灶SUVmax越高,NSCLC患者术后总生存期和无进展生存期越短,但纵隔或肺门高代谢淋巴结SUVmax并不是NSCLC患者术后生存期的预测因子,这可能与结核、炎症反应等均能够引起纵隔或肺门淋巴结代谢升高有关。而影像组学能够通过大量自动提取的定量影像特征量化肿瘤表征,进而对临床决策的制定起到辅助作用。本研究结果显示,有反应组SUVmax、熵低于无反应组,能量高于无反应组,提示PET/CT影像组学用于早期评价NSCLC患者的疗效是可行的。熵反映的是PET/CT影像中纹理的非均匀程度或者复杂程度,而能量反映的是PET/CT影像灰度分布的均匀程度以及纹理粗细度,两者均是PET/CT影像的二阶参数。相比于有反应组患者,无反应组患者原发灶异质性相对较高,瘤内细胞分布不均匀,使得其熵较高,能量较低。张斌等[16]亦发现,进行放化疗治疗的NSCLC患者中,缓解组熵明显低于非缓解组,PET/CT纹理特征分析有助于预测进展期NSCLC患者的放化疗疗效。故通过PET/CT影像组学来早期评价NSCLC患者的疗效,有助于尽早发现疗效较差的患者,从而及时调整治疗方案。
LncRNA-DGCR5位于人染色体22q11.2上,可通过多种机制如染色质修饰、蛋白功能调节、转录后调控、转录激活等参与细胞信号转导调控,在恶性肿瘤的发生发展中具有至关重要的作用[17-19]。郭水根等[20]研究表明,LncRNA-DGCR5能够促进肺腺癌的发生和发展,而沉默LncRNA-DGCR5表达则能够抑制肺腺癌细胞的增殖、侵袭及迁移生物学行为,LncRNA-DGCR5有可能作为肺腺癌的潜在治疗靶点。本研究结果显示,有反应组LncRNA-DGCR5表达水平低于无反应组,提示LncRNA-DGCR5高表達可能预示NSCLC患者较差的疗效。故LncRNA-DGCR5有可能作为评价NSCLC患者疗效的预测标志物。本研究发现LncRNA-DGCR5高表达组PET/CT纹理参数中SUVmax、熵升高,能量降低,提示NSCLC患者LncRNA-DGCR5表达与PET/CT纹理参数有一定关系。通过构建ROC曲线结果显示,SUVmax值、熵、能量及LncRNA-DGCR5表达联合预测NSCLC患者疗效的预测价值较单一指标更高。但本研究仍存在一定的局限性:病例数量有限;仅分析了PET/CT影像组学结合LncRNA-DGCR5对NSCLC患者疗效的预测价值,其对患者肿瘤转移、复发等方面的应用价值尚有待证实;不同的重建算法可能影响PET/CT影像的纹理特征,有待进一步分析研究。
综上所述,PET/CT影像组学结合LncRNA-DGCR5有助于预测NSCLC患者的疗效,为指导NSCLC患者的个体化治疗奠定科学基础,从而在NSCLC精准医疗中提供指导。
参考文献
[1] SIEGEL R L,MILLER K D,JEMAL A. Cancer statistics,2020[J]. CA Cancer J Clin,2020,70(1):7-30. doi:10.3322/caac.21590.
[2] ALEXANDER M,KIM S Y,CHENG H. Update 2020:Management of non-small cell lung cancer[J]. Lung,2020,198(6):897-907. doi:10.1007/s00408-020-00407-5.
[3] 郑庆中,苏洁敏,邓菁,等. 18F-FDG PET/CT代谢参数对116例非小细胞肺癌患者预后评估价值[J]. 中华肿瘤防治杂志,2020,27(16):1309-1314. ZHENG Q Z,SU J M,DENG J,et al. Prognostic value of 18F-FDG PET/CT metabolic parameters in patients with non-small cell lung cancer[J]. Chin J Cancer Prev Treat,2020,27(16):1309-1314. doi:10.16073/j.cnki.cjcpt.2020.16.06.
[4] 刘寒冰,赵杰,胡春峰. PET/CT代谢参数及纹理分析评价晚期肺腺癌EGFR-TKI的疗效[J]. 中国医学影像学杂志,2020,28(11):842-845. LIU H B,ZHAO J,HU C F. Evaluation of EGFR-TKI in advanced lung adenocarcinoma by PET/CT metabolic parameters and texture analysis[J]. Chinese Journal of Medical Imaging,2020,28(11):842-845. doi:10.3969/j.issn.1005-5185.2020.11.011.
[5] SHEN Y,LIN Y,LIU K,et al. XIST:A meaningful long noncoding RNA in NSCLC process[J]. Curr Pharm Des,2021,27(11):1407-1417. doi:10.2174/1381612826999201202102413.
[6] XUE C,CHEN C,GU X,et al. Progress and assessment of lncRNA DGCR5 in malignant phenotype and immune infiltration of human cancers[J]. Am J Cancer Res,2021,11(1):1-13.
[7] WANG J,SHU H Z,XU C Y,et al. LncRNA DGCR5 promotes non-small cell lung cancer progression via sponging miR-218-5p[J]. Eur Rev Med Pharmacol Sci,2020,24(20):10303. doi:10.26355/eurrev_202010_23355.
[8] 周潔,周清华. NTRK基因融合和TRK抑制剂在非小细胞肺癌中的研究进展[J]. 中国肿瘤临床,2020,47(12):633-636. ZHOU J,ZHOU Q H. Role of NTRK gene fusions and TRK inhibitors in non-small cell lung cancer[J]. Chin J Clin Oncol,2020,47(12):633-636. doi:10.3969/j.issn.1000-8179.2020.12.497.
[9] EZE C,SCHMIDT-HEGEMANN N S,SAWICKI L M,et al. PET/CT imaging for evaluation of multimodal treatment efficacy and toxicity in advanced NSCLC-current state and future directions[J]. Eur J Nucl Med Mol Imaging,2021,48(12):3975-3989. doi:10.1007/s00259-021-05211-8.
[10] 刘寒冰,赵杰,胡春峰,等. PET/CT纹理分析在预测非小细胞肺癌EGFR基因突变中的应用[J]. 临床放射学杂志,2020,39(9):1759-1763. LIU H B,ZHAO J,HU C F. The application of PET/CT combined texture analysis in predicting EGFR gene mutation in non-small cell lung cancer[J]. J Clin Radiol,2020,39(9):1759-1763. doi:10.13437/j.cnki.jcr.2020.09.018.
[11] AG?LO?LU N,AKYOL M,K?MEK H,et al. The prognostic value of 18F-FDG PET/CT metabolic parameters in predicting treatment response before EGFR TKI treatment in patients with advanced lung adenocarcinoma[J]. Mol Imaging Radionucl Ther,2022,31(2):104-113. doi:10.4274/mirt.galenos.2022.24650.
[12] 张晓洁,李娜,杨芳,等. 18F-FDG PET/CT技术评价T2DM对晚期结直肠癌患者PD-L1治疗疗效的影响[J]. 影像科学与光化学,2022,40(2):237-242. ZHANG X J,LI L,YANG F,et al. The value of 18F-FDG PET/CT technology in evaluating the effect of T2DM on the efficacy of PD-L1 targeted therapy in patients with advanced colorectal cancer[J]. Imag Sci Photochem,2022,40(2):237-242. doi:10.7517/issn.1674-0475.210831.
[13] EVANGELISTA L,SEPULCRI M, PASELLO G. PET/CT and the response to immunotherapy in lung cancer[J]. Curr Radiopharm,2020,13(3):177-184. doi:10.2174/1874471013666191220105449.
[14] SUN X Y,CHEN T X,CHANG C,et al. SUVmax of 18FDG PET/CT predicts histological grade of lung adenocarcinoma[J]. Acad Radiol,2021,28(1):49-57. doi:10.1016/j.acra.2020.01.030.
[15] 任树华,黄琪,胡静超,等. 18F-AV45 PET显像在轻微认知下降和轻度认知障碍患者中的应用[J]. 中华核医学与分子影像杂志,2020,40(4):196-200. REN S H,HUANG Q,HU J C,et al. Application of 18F-AV45 PET imaging in subtle cognitive decline and mild cognitive impairment patients[J]. Chinese Journal of Nuclear Medicine and Molecular Imaging,2020,40(4):196-200. doi:10.3760/cma.j.cn321828-20190812-00166.
[16] 张斌,马玉波,耿彦方,等. 18F-FDG PET/CT图像纹理分析在非小细胞肺癌中的应用价值[J]. 临床放射学杂志,2019,38(10):1852-1856. ZHANG B,MA Y B,GENG Y F,et al. The value of 18F-FDG PET/CT texture analysis in non-small cell lung cancer[J]. J Clin Radiol,2019,38(10):1852-1856. doi:10.13437/j.cnki.jcr.2019.10.013.
[17] 段玉青,王梦杰,王洪琰,等. lncRNA DGCR5在食管鳞状细胞癌组织中的表达及其临床意义[J]. 中国肿瘤生物治疗杂志,2020,27(4):416-419. DUAN Y Q,WANG M J,WANG H Y,et al. Expression of lncRNA DGCR5 in esophageal squamous cell carcinoma tissues and its clinical significance[J]. Chinese Journal of Cancer Biotherapy,2020,27(4):416-419. doi:10.3872/j.issn.1007-385x.2020.04.012.
[18] 籍玉青,尹永波,邱金霞. lncRNA DGCR5通過靶向调控miR-21抑制鼻咽癌细胞的增殖、侵袭和迁移[J]. 中国老年学杂志,2022,42(11):2791-2795. JI Y Q,YIN Y B,QIU J X. lncRNA DGCR5 inhibition of proliferation, invasion and migration of nasopharyngeal carcinoma cells through targeted regulation of miR-21 [J]. Chinese Journal of Gerontology,2022,42(11):2791-2795. doi:10.3969/j.issn.1005-9202.2022.11.055.
[19] KANG M,SHI J,LI B,et al. LncRNA DGCR5 regulates the non-small cell lung cancer cell growth,migration,and invasion through regulating miR-211-5p/EPHB6 axis[J]. Biofactors,2019,45(5):788-794. doi:10.1002/biof.1539.
[20] 郭水根,舒慧珍. 沉默长链非编码RNA DGCR5对肺腺癌细胞增殖、侵袭、迁移及Wnt/β-catenin信号通路的影响[J]. 中国免疫学杂志,2020,36(23):2866-2871. GUO S G,SHU H Z. Effects of silencing long non-coding RNA DGCR5 on proliferation,invasion,migration and Wnt/β-catenin signaling pathway in lung adenocarcinoma cells[J]. Chinese Journal of Immunology,2020,36(23):2866-2871. doi:10.3969/j.issn.1000-484X.2020.23.011.
(2022-11-12收稿 2023-04-10修回)
(本文编辑 李志芸)

