美洲大蠊提取物CⅡ-3 对荷S180 肉瘤小鼠抑瘤作用及机制初探
陆 丽,何 旭,张艳菊,彭 芳
(1.大理大学基础医学院,云南大理 671000;2.云南省昆虫生物医药研发重点实验室,云南大理 671000;3.大理白族自治州人民医院药剂科,云南大理 671000;4.巍山县大仓中心卫生院,云南巍山 672401;5.大理大学药学院,云南大理 671000)
肉瘤是一种罕见的肿瘤,常发生在结缔组织,恶性程度较高,一般5年生存期低于20%,并且80%的患者在确诊时已发生肿瘤转移。化疗药物的毒性反应和耐药性的产生一直是肿瘤疾病治疗中难以解决的问题,而昆虫体内高效低毒的天然抗肿瘤活性成分对肿瘤疾病的治疗有着独特的优势〔1-4〕。
美洲大蠊Periplaneta americana,俗称蟑螂,属昆虫纲蜚蠊目蜚蠊科大蠊属昆虫。现代药理学研究〔5-6〕表明,美洲大蠊具有抗肿瘤、增强免疫、促进伤口愈合、改善微循环等作用。美洲大蠊提取物CⅡ-3是从美洲大蠊中提取、分离得到的以肽类为主的混合物〔7〕。胡艳芬等研究〔8〕发现,CⅡ-3 在体外对肿瘤细胞的增殖具有较好的抑制作用,为进一步探讨CⅡ-3 体内的抗肿瘤作用,本研究就CⅡ-3 对荷S180 肉瘤小鼠抑瘤作用及机制进行初探,旨在为CⅡ-3 抗肿瘤方面的应用提供实验依据。
1 材料与仪器
1.1 动物和细胞株SPF 级雄性昆明种小鼠60只,体质量(18±2)g,由昆明医科大学动物实验中心提供,许可证号:SCXK(滇)2011-0004。S180 细胞株由昆明医科大学天然药物药理重点实验室馈赠。
1.2 药品与试剂 美洲大蠊提取物CⅡ-3 由大理大学药学院刘光明教授提供,其制备工艺:乙醇提取→大孔树脂分离→CⅡ-3;环磷酰胺(cyclophosphamide,CTX,江苏恒瑞医药股份有限公司,批号:11020821);无水乙醇(天津市风船化学试剂科技有限公司,批号:090214);p53 单克隆抗体(Enzolifesciences,批号:ADI-KAM-CC00-D);含半胱氨酸的天冬氨酸蛋白水解酶-3(cysteinyl asparate specific protease-3,Caspase-3)单克隆抗体(Enzolifesciences,批号:ALX-804-305-C100);B 细胞淋巴瘤-2(B cell lymphoma 2,Bcl-2) 单克隆抗体(Abcam,批号:ab117115);环氧合酶-2(cyclooxygenase-2,COX-2)单克隆抗体(Abcam,批号:ab179800);微血管密度(microvessel density,MVD)多克隆抗体(Proteintech,批号:15331-1-AP);血管内皮生长因子(vascular endothelial growth factor,VEGF)ELISA 试剂盒(南京建成生物工程研究所,批号:H044-2-2);端粒酶(telomerase,TE)ELISA 试剂盒(武汉赛培生物科技有限公司,批号:SP14404)。
1.3 实验仪器 EL-104 型电子天平(梅特勒-托利多仪器有限公司);KL-UP-UV-20KNSY1059 型艾柯超纯水机(成都康宁实验专用纯水设备厂);BMVⅢ型生物组织包埋机(孝感市宏业医用仪器有限公司);IX-7 型倒置相差显微镜(日本Olympus 公司);HH.B11.360 型电热恒温培养箱(上海跃进医疗器械厂);XB.K.25 型血球计数板(上海市求精生化试剂仪器有限公司);SN255939 型酶标仪(美国BioTek 公司)。
2 方法
2.1 分组及给药 无菌条件下,抽取第2 代荷S180 腹水瘤小鼠淡黄色癌性腹水,0.9%氯化钠溶液调节S180 细胞悬液密度为1.5×107个/mL,0.2 mL/只,皮下接种于小鼠右侧腋窝。接种次日将小鼠随机分为模型组、阳性对照(CTX)组、CⅡ-3 高、中、低剂量组,另设正常对照组,每组10 只小鼠。阳性对照组隔日腹腔注射CTX,30 mg/kg,1 次/d;CⅡ-3 高、中、低剂量组灌胃CⅡ-3,剂量分别为200、100、50mg/kg,1 次/d;正常对照组和模型组均灌胃0.9%氯化钠溶液,20 mL/kg,1 次/d。10 d 后处死小鼠,取血,并剥离瘤块。
2.2 抑瘤率测定 将瘤块称重并测量长、短径。瘤块体积V(mm3)=ab2/2(a、b 分别为瘤块的长、短径);抑瘤率(%)=〔(对照组平均瘤质量-给药组平均瘤质量)/对照组平均瘤质量〕×100%。
2.3 肿瘤组织病理切片的制备 取各组小鼠瘤块,经10%甲醛固定、脱水、石蜡包埋、切片、HE 染色、封片等步骤后进行镜检,观察各组小鼠肿瘤组织的病理改变。
2.4 血清中VEGF 含量和TE 活力的测定 小鼠眼球取血后,将全血于冰水浴中静置1.5 h,然后4 ℃下3 500 r/min 离心15 min,取上清液备用。ELISA板条样品孔中,每孔加入上述上清液40 μL,抗-VEGF 抗体10 μL(或抗-TE 抗体10 μL),链霉亲和素-HRP 50 μL,空白孔和标准孔按照试剂盒说明书操作,混匀后置于培养箱内37 ℃温育60 min,弃混合液并洗板数次。每孔加显色剂100 μL,37 ℃避光10 min 后,加终止液50 μL,空白对照调零,450 nm波长处测各孔吸光度(A)值,计算VEGF 浓度和TE活力。
2.5 小鼠肿瘤组织中p53、Bcl-2、Caspase-3、MVD和COX-2 蛋白表达检测 采用免疫组织化学法分别测定各组小鼠肿瘤组织中p53、Bcl-2、Caspase-3、MVD 和COX-2 蛋白的表达水平。肿瘤组织经10 %甲醛固定、脱水、石蜡包埋、切片、烤片过夜。次日,二甲苯脱蜡,高浓度到低浓度乙醇脱水,片子漂洗干净后用柠檬酸修复液进行抗原修复,3%双氧水阻断内源性过氧化物酶,流水冲洗,PBS 冲洗,滴加一抗工作液,37 ℃孵育1 h,流水冲洗,PBS 冲洗,滴加适当的二抗工作液,室温下孵育30 min,流水冲洗,PBS冲洗,DAB 显色剂显色,流水冲洗,苏木素复染,稀盐酸分化,稀氨水返蓝,再进行常规脱水、透明、封片。在光镜下观察细胞阳性表达率,阳性表达率与蛋白水平呈正相关。
2.6 统计分析 实验数据用SPSS 19.0 软件进行统计处理,计量资料以(x± s)表示。方差齐,组间均数比较采用单因素方差分析;方差不齐则采用韦尔奇检验,组间两两比较选用LSD 法。P<0.05 为差异有统计学意义。
3 结果
3.1 CⅡ-3 对荷S180 肉瘤小鼠抑瘤作用 与模型组相比,CTX组和CⅡ-3 高剂量组的瘤块体积和肿瘤质量均显著降低(P<0.01),且CⅡ-3 高剂量组与CTX组作用相当(P>0.05)。CⅡ-3 高、中、低剂量组的抑瘤率分别为55.71%、44.28%、34.28%,均大于30.00%。见表1。

表1 CⅡ-3 对荷S180 肉瘤小鼠抑瘤作用(x±s,n=10)
3.2 荷S180 肉瘤组织病理切片观察 模型组小鼠肉瘤细胞生长旺盛,核呈均匀分布;CTX组小鼠肉瘤细胞出现大量的核固缩和核碎片,并伴有坏死;CⅡ-3 高剂量组小鼠肉瘤细胞呈现大面积坏死;CⅡ-3 中剂量组小鼠肉瘤细胞坏死区域明显,并出现微血管;CⅡ-3 低剂量组小鼠肉瘤细胞生长状况良好,与模型组相当。见图1。

图1 荷S180 肉瘤组织病理切片(×100)
3.3 CⅡ-3 对荷S180 肉瘤小鼠血清中VEGF 和TE的影响 与模型组相比,CⅡ-3 高剂量组小鼠血清中TE 的活力降低(P<0.05),模型组与CⅡ-3 各剂量组小鼠血清中VEGF 含量的差异均无统计学意义(P>0.05)。见表2。
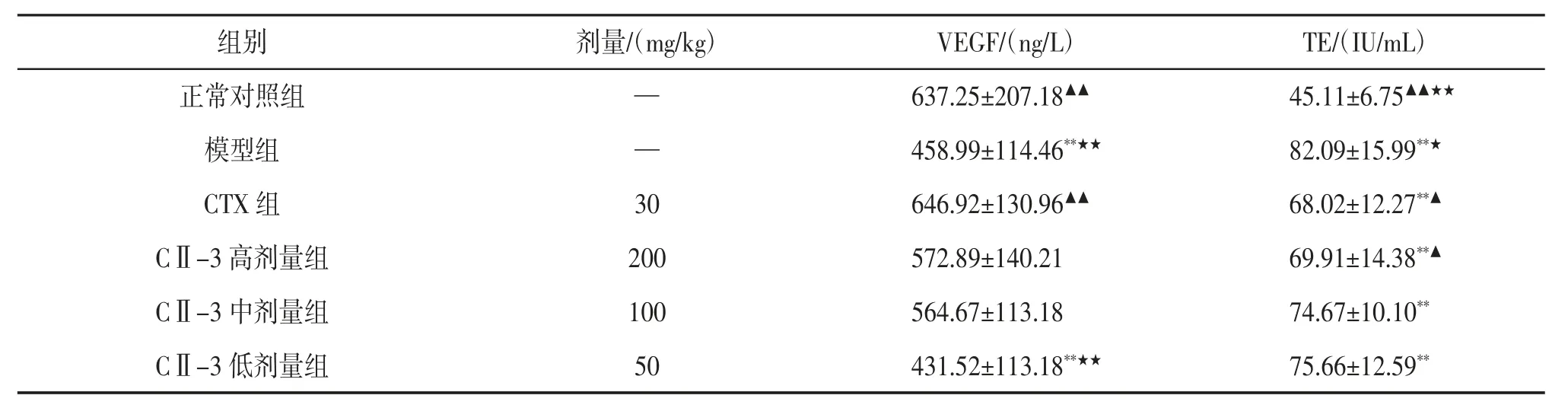
表2 CⅡ-3 对荷S180 肉瘤小鼠血清中VEGF 和TE 的影响(x±s,n=10)
3.4 CⅡ-3 对荷S180 肉瘤小鼠肿瘤组织中p53、Bcl-2、Caspase-3 蛋白表达的影响 免疫组织化学染色中,p53 阳性着色部位在细胞核,棕褐色染色,呈散在分布。正常对照组未见p53 阳性着色,其余各组均有不同程度着色,以模型组着色区域最大。见图2。Bcl-2 阳性着色部位在细胞浆,棕黄色染色,呈弥漫分布。正常对照组细胞排列紧密,未见Bcl-2阳性着色,模型组着色区域明显大于CTX组和CⅡ-3高剂量组。见图3。Caspase-3 阳性着色部位在细胞核和细胞质,棕黄色染色,呈片状分布。模型组和CⅡ-3 低剂量组着色区域明显小于CTX组和CⅡ-3高、中剂量组。见图4。与模型组相比,CTX组、CⅡ-3高、中剂量组小鼠肿瘤组织中Bcl-2、p53 的表达显著降低(P<0.01),Caspase-3 的表达显著增加(P<0.01);CⅡ-3 高剂量组与CTX组p53、Bcl-2、Caspase-3 表达差异无统计学意义(P>0.05)。见表3。
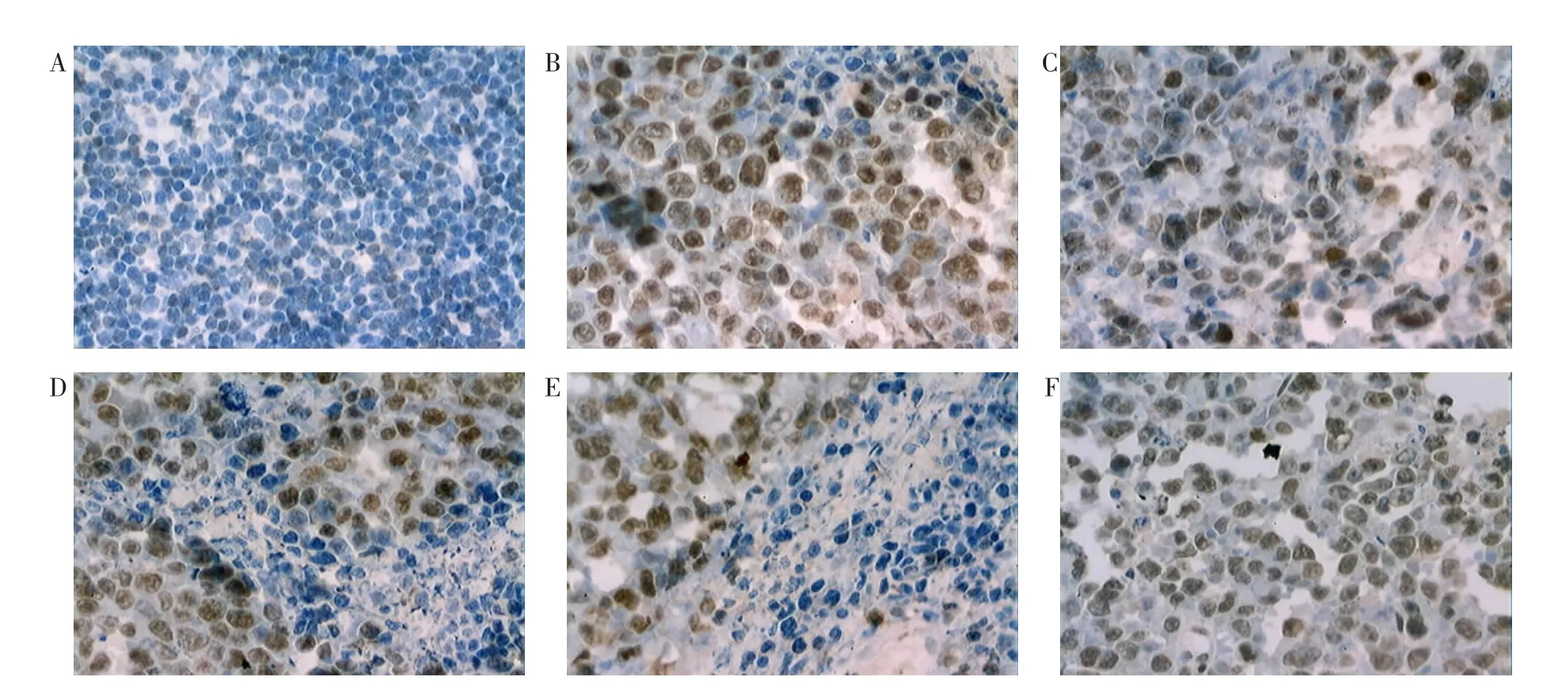
图2 p53 免疫组织化学染色图(×400)
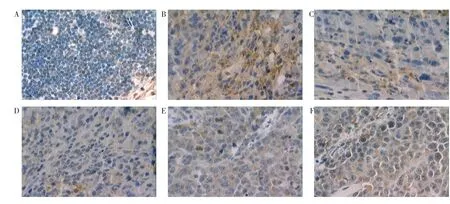
图3 Bcl-2 免疫组织化学染色图(×400)
图4 Caspase-3 免疫组织化学染色图(×400)
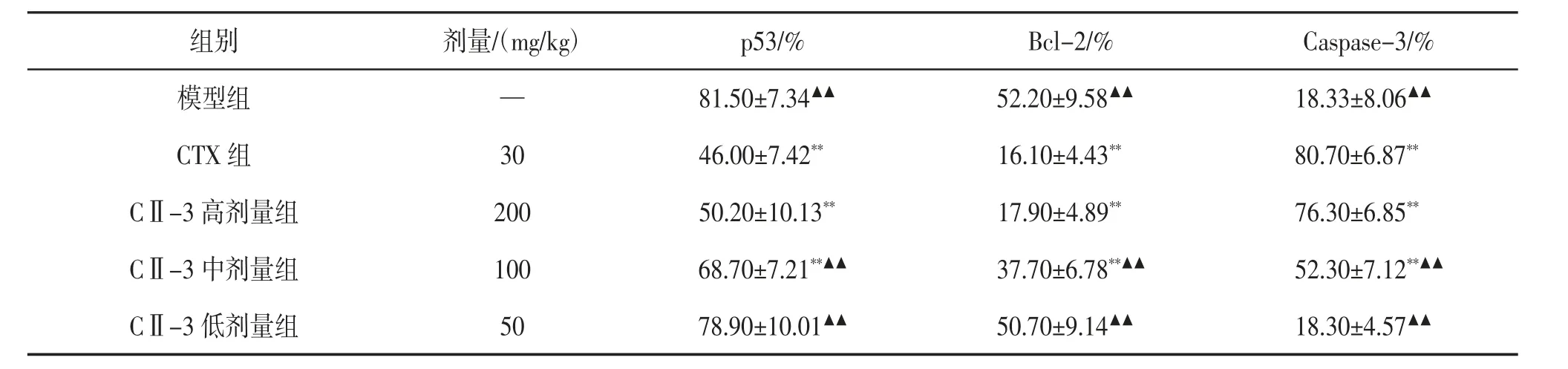
表3 CⅡ-3 对荷S180 肉瘤小鼠肿瘤组织中p53、Bcl-2、Caspase-3 的影响(x±s,n=10)
3.5 CⅡ-3 对荷S180 肉瘤小鼠肿瘤组织中MVD 及COX-2 蛋白表达的影响 免疫组织化学染色中,MVD 和COX-2 阳性着色部位在细胞质,棕黄色染色。正常对照组细胞排列紧密,核体积较小,均未见MVD 和COX-2 阳性着色;模型组细胞质MVD 和COX-2 阳性着色,着色区域均较大,细胞核较大;CTX组细胞质MVD 和COX-2 阳性着色,呈弥漫分布,着色区域较小;CⅡ-3 高剂量组细胞质MVD 和COX-2 阳性着色,细胞核较大并出现异型性;CⅡ-3中剂量组细胞质和细胞核MVD 阳性着色,细胞质COX-2 阳性着色,呈弥漫分布;CⅡ-3 低剂量组细胞质MVD 和COX-2 阳性着色,细胞核较大,着色区域较大。见图5~6。与模型组相比,CTX组和CⅡ-3 高、中剂量组小鼠肿瘤组织中MVD 和COX-2 蛋白的表达显著降低(P<0.01)。见表4。

图5 MVD 免疫组织化学染色图(×400)
4 讨论
CⅡ-3 是从美洲大蠊中提取、分离得到的以肽类为主的混合物,灌胃给药后显示出一定的抗S180肉瘤作用,其发挥抗肿瘤作用的有效物质尚不明确,这些有效物质可能是环状多肽类。环状多肽的两端通过化学键桥连成环,对多肽骨架产生构象限制,柔韧性比线性多肽差,因而更难被消化酶水解〔9-10〕。
CⅡ-3 高、中、低剂量组对荷S180 肉瘤小鼠抑瘤率分别为55.71%、44.28%、34.28%,均大于30.00%,而且CⅡ-3 高剂量组肿瘤体积和肿瘤质量显著低于模型组,可见CⅡ-3 对S180 肉瘤的生长具有明显的抑制作用。
VEGF 可诱导新生血管形成,从而促进肿瘤细胞、组织生长并发生转移,其特异性作用于内皮细胞糖基化的细胞有丝分裂素〔11〕,在缺血部位高表达能够对新血管生成进行诱导,使缺血部位恢复正常的血流供应〔12〕,通过血管外周细胞基质降解,血管内皮细胞增殖迁移和毛细血管分化吻合来促进肿瘤血管形成〔13〕。TE 是人体细胞中延伸端粒的特异性反转录酶,可通过催化线性染色体末端添加DNA重复序列来维持端粒长度,限制端粒损耗〔14-15〕,在维持细胞活性、基因组完整性和机体稳定性中起重要的调控作用〔16-17〕,然而,TE 的表达仅限于特定的细胞状态或细胞类型,在正常人体的细胞中,除了生殖细胞、干细胞和造血细胞,大多数体细胞的TE活性处于失活状态,但在细胞癌变过程中,TE 会被异常通路活化〔18〕,90%以上的癌细胞中TE 处于高活性状态〔19〕。在本实验中,模型组小鼠血清中TE活性最高,CⅡ-3 高剂量组能显著降低荷瘤小鼠血清中TE 的活性,提示CⅡ-3 的抑瘤作用可能与抑制TE 的活性有关。
p53 是机体内重要的抑癌基因,有突变型和野生型两种,野生型p53 半衰期延长可转变为突变型p53 基因,同时失去诱导细胞凋亡的作用,在肿瘤组织中突变型p53 基因高表达,可以用免疫组织化学方法检测〔20-21〕。Bcl-2 是机体内抑制细胞凋亡的基因,可以抑制生理条件下致凋亡因素引起的细胞凋亡,为细胞中受损伤但不能被修复的DNA 发生突变提供前提,最终导致肿瘤的发生〔22-23〕。Caspase-3是Caspase 家族中重要的一员,参与细胞凋亡的调节过程,通过一系列的调控最后促进凋亡小体的形成。Caspase-3 蛋白的低表达与肿瘤的发生、发展、浸润及转移等生物学行为特征密切相关〔24-25〕。MVD在肿瘤血管生成活性的评估中有很重要的作用,也是反映恶性肿瘤部分生物学行为的一个重要指标〔26〕。COX-2 作为环氧合酶中的诱导型酶,在机体受到炎性反应、癌蛋白、细胞因子等多种刺激下而诱导性表达,与机体炎性反应、肿瘤的发生、发展等病理变化密切相关〔27〕,在调控细胞增殖与抑制细胞凋亡、促进患者体内血管生成及肿瘤转移等多方面发挥作用〔28〕。本实验结果表明,CⅡ-3 高、中剂量均能显著降低肿瘤组织中p53、Bcl-2、MVD、COX-2的表达水平,同时增加Caspase-3 的表达。
综上所述,CⅡ-3 对S180 实体瘤有显著的抑制作用,其机制可能与降低TE 活性,减少p53、Bcl-2、MVD、COX-2 蛋白表达,增加Caspase-3 蛋白表达等途径有关。具体的机制有待进一步研究。

