云南松松塔抗HIV 活性提取物对人冠状病毒229E抑制活性的研究
李亚飞,尚方建,罗春雨,石哲芳,刘 奇
(1.大理大学基础医学院,云南大理 671000;2.云南省昆虫生物医药研发重点实验室,云南大理 671000;3.首都医科大学附属北京儿童医院保定医院,河北保定 071000)
新型冠状病毒在全球范围的传播引起了科研人员对冠状病毒(coronavirus,CoV)新一轮的研究热潮。冠状病毒亚科分为α、β、γ、δ 4 个属,β 属由A、B、C、D 4 个亚群组成〔1〕。至今为止,科研人员先后从患者体内发现了7 种可引起人类患病的人冠状病毒(human coronavirus,HCoV),分别为α 属的HCoV-229E 和HCoV-NL63,A 亚群的HCoV-OC43和HCoV-HKU1,B 亚群的SARS-CoV 和SARSCoV-2,C 亚群的中东呼吸综合征病毒〔1-2〕。普通冠状病毒229E、OC43 和NL63 能引起人上呼吸道感染,是导致近三分之一普通感冒的病因〔3〕。尽管普通冠状病毒感染的症状不严重且能自愈,但会导致儿童、老年人和免疫功能低下患者产生严重甚至致命的疾病〔2,4〕。松塔为松科植物的果球,具有抗肿瘤、抗菌、抗病毒、抗氧化和增强免疫功能的作用,有较高的研究价值〔5-6〕。云南松主要分布在中国西南地区,研究〔7〕发现云南松松塔提取物对HIV-1ⅢB、HIV-1RF、HIV-1A17等病毒株具有抑制效果,然而其是否具有抗冠状病毒的活性尚无相关报道。
本研究通过建立HCoV-229E S 蛋白介导的细胞-细胞融合模型和假病毒模型,探究云南松松塔抗HIV 活性提取物(以下简称“松塔提取物”)对HCoV-229E 的抑制活性,并初步明确其活性部位和作用机制,为松塔药物后续活性单体追踪及抗HCoV-229E 机制研究奠定基础,丰富云南松松塔的医学研究价值和经济价值,为抗冠状病毒天然药物研究提供新的方向。
1 材料与方法
1.1 材料
1.1.1 菌株、质粒、细胞 感受态细菌(DH-5α)购自天根生物科技有限公司(批号:CB101-02);293T、Huh-7 细胞、表达绿色荧光蛋白(enhanced green fluorescent protein,EGFP)的克隆载体质粒pAAVIRES-EGFP、质粒pNL4-3.luc.R-E(编码env 缺陷,含有萤火虫酶报告基因的HIV-1 骨架质粒)、表达HCoV-229E S 蛋白的重组真核表达质粒pCDNA3.1-229E-S、共表达S 蛋白和EGFP 的重组质粒pAAV-IRES-EGFP-229E-S 均由本实验室团队前期成功构建保存。
1.1.2 主要试剂 大提质粒试剂(天根生化科技有限公司,批号:DP117);EZ Trans 细胞转染试剂(上海李记生物科技有限公司,批号:AC04L091);萤火虫酶检测系统试剂盒、细胞裂解液(Promega公司,批号:E1501、E153A);DMEM 高糖培养基、胎牛血清(大连美仑生物技术有限公司,批号:MA0212、PW1001);DAPI 溶液(北京索莱宝科技有限公司,批号:C0065);PBS、青链霉素混合液、CCK-8 试剂盒(北京索莱宝科技有限公司,批号:P1020、MA0110、MA0218-L);松塔提取物由大理大学药学院刘光明教授惠赠。
1.2 方法
1.2.1 细胞培养及转染 293T 细胞与靶细胞Huh-7 均采用含10%胎牛血清和1%青链霉素混合液的高糖DMEM 完全培养基,于37 ℃、5% CO2恒温培养。转染前12 h 将293T 细胞以8×106个/孔铺于6孔板,待细胞密度达70%~80%且形态良好时,采用EZ Trans 转染试剂按说明书操作进行质粒pAAVIRES-EGFP-229E-S 转染,继续培养24~48 h 后得到稳定共表达HCoV-229E S 和EGFP 蛋白的效应细胞(293T/229E/EGFP),转染质粒pAAV-IRESEGFP 作为阴性对照细胞(293T/EGFP)。
1.2.2 细胞-细胞融合模型建立 融合前1 d 将Huh-7 细胞以3×104个/孔铺于96 孔板培养12 h。融合前2 h 加入20 μL DAPI 溶液作用20 min,进行Huh-7 细胞和293T/229E/EGFP 细胞核染色,PBS 洗净DAPI 溶液后将293T/229E/EGFP 和293T/EGFP 以每孔约1×104个荧光细胞与Huh-7 细胞共培养,分别作为实验组和阴性对照组,于不同时间段用荧光显微镜观察细胞-细胞融合情况,计算细胞-细胞融合率。细胞-细胞融合率=(1-n1/n0)×100%(式中n1表示不同融合时间后单个荧光细胞数;n0表示融合前单个荧光细胞数),绘制时间融合关系曲线。
1.2.3 假病毒HCoV-229E 包装及靶细胞感染 假病毒包装主要步骤如下:按1 ∶2 比例将质粒pCDNA3.1-229E-S 与pNL4-3.luc.R-E 共转染于293T 细胞,10~12 h 后将液体更换为DMEM 完全培养基。48~72 h 后,收集细胞培养液,3 000 r/min 离心10 min,去除细胞沉淀,取上清液分装后于-80 ℃保存备用。感染靶细胞主要步骤如下:感染前12 h于96 孔板中铺入靶细胞Huh-7,2×104个/孔,PBS洗涤细胞2 次,每孔加入100 μL 用1∶2 DMEM 稀释的假病毒,感染10~12 h 后,更换为DMEM。培养48~72 h,用PBS 洗涤2 次,每孔加40 μL 细胞裂解液,100 r/min 振荡裂解30 min,取裂解后的液体20 μL 于96 孔板中,加20 μL 萤火虫酶底物,混匀后检测荧光值。
1.2.4 抑制活性检测 细胞-细胞融合抑制活性检测以293T/229E/EGFP 与Huh-7 细胞共培养作为阳性对照组;293T/EGFP 与Huh-7 细胞共培养作为阴性对照组;梯度稀释松塔提取物和293T/229E/EGFP在37 ℃、5% CO2条件下孵育1 h 与Huh-7 细胞共培养作为实验组。假病毒抑制活性检测以HCoV 细胞-229E 假病毒与Huh-7 细胞共培养作为阳性对照组;无假病毒和松塔提取物作为阴性对照组;假病毒梯度稀释松塔提取物37 ℃孵育1 h 与Huh-7细胞共培养为实验组,按“1.2.3”项下方法检测荧光值,计算抑制率。抑制率=[1-(E-N)/(P-N)]×100%(式中E 表示实验组的细胞-细胞融合率或荧光值;P 和N 分别表示阳性对照组和阴性对照组的细胞-细胞融合率或荧光值)。以松塔提取物浓度为横坐标,抑制率为纵坐标绘制药物抑制曲线,使用Calsusyn软件计算半抑制浓度(half maximal inhibitory concentration,IC50)。
1.2.5 时间-移除实验 松塔提取物分别与293T/229E/EGFP、Huh-7 细胞共孵育1 h,洗除未结合的药物,将两者共培养,观察是否仍具有抑制作用,初步检测其作用靶点。实验组分为3组:组1 为松塔提取物与293T/229E/EGFP 作用1 h,与Huh-7 细胞共培养;组2 为松塔提取物与293T/229E/EGFP 作用1 h,用DMEM 洗涤细胞2 次去除未结合的药物,与Huh-7 细胞共培养;组3 为松塔提取物与Huh-7细胞作用1 h,用DMEM 洗涤细胞2 次去除未结合的药物,与293T/229E/EGFP 共培养。不加松塔提取物293T/229E/EGFP 与Huh-7 细胞直接共培养作为阳性对照组;293T/EGFP 与Huh-7 细胞共培养作为阴性对照组,测定荧光值,按“1.2.4”项下方法计算抑制率。
1.2.6 时间-添加实验 293T/229E/EGFP 与Huh-7细胞共孵育,分别于0.0、0.5、1.0、2.0、4.0、6.0 h 加入松塔提取物作为实验组;不加松塔提取物293T/229E/EGFP 与Huh-7 细胞直接共培养作为阳性对照组;293T/EGFP 与Huh-7 细胞共培养作为阴性对照组,测定荧光值,按“1.2.4”项下方法计算抑制率。
1.2.7 细胞增殖毒性检测 按CCK-8 试剂说明书操作,测定松塔提取物对293T、Huh-7 细胞的毒性作用。酶标仪测定450 nm 处的吸光度(OD)值,计算细胞毒性率。细胞毒性率=[(OD实验-OD空白)/(OD对照-OD空白)]×100%。
2 结果
2.1 细胞-细胞融合模型的构建 实验结果显示,3 h 后于荧光显微镜下可观察到实验组产生明显的细胞-细胞融合现象,同一荧光强度下与未融合的细胞比,荧光强度弱且形状不规则,阴性对照组没有融合现象。见图1A。48 h 后荧光视野下实验组有大面积融合现象,DAPI 染色可见融合区域有多个细胞核。见图1B。说明HCoV-229E S 蛋白会介导细胞-细胞融合现象的发生,细胞-细胞融合模型构建成功。于不同时间观察同一视野细胞-细胞融合情况,绘制时间融合关系曲线,由时间融合关系曲线可知6 h 后,实验组细胞-细胞融合率达到50%。见图2。
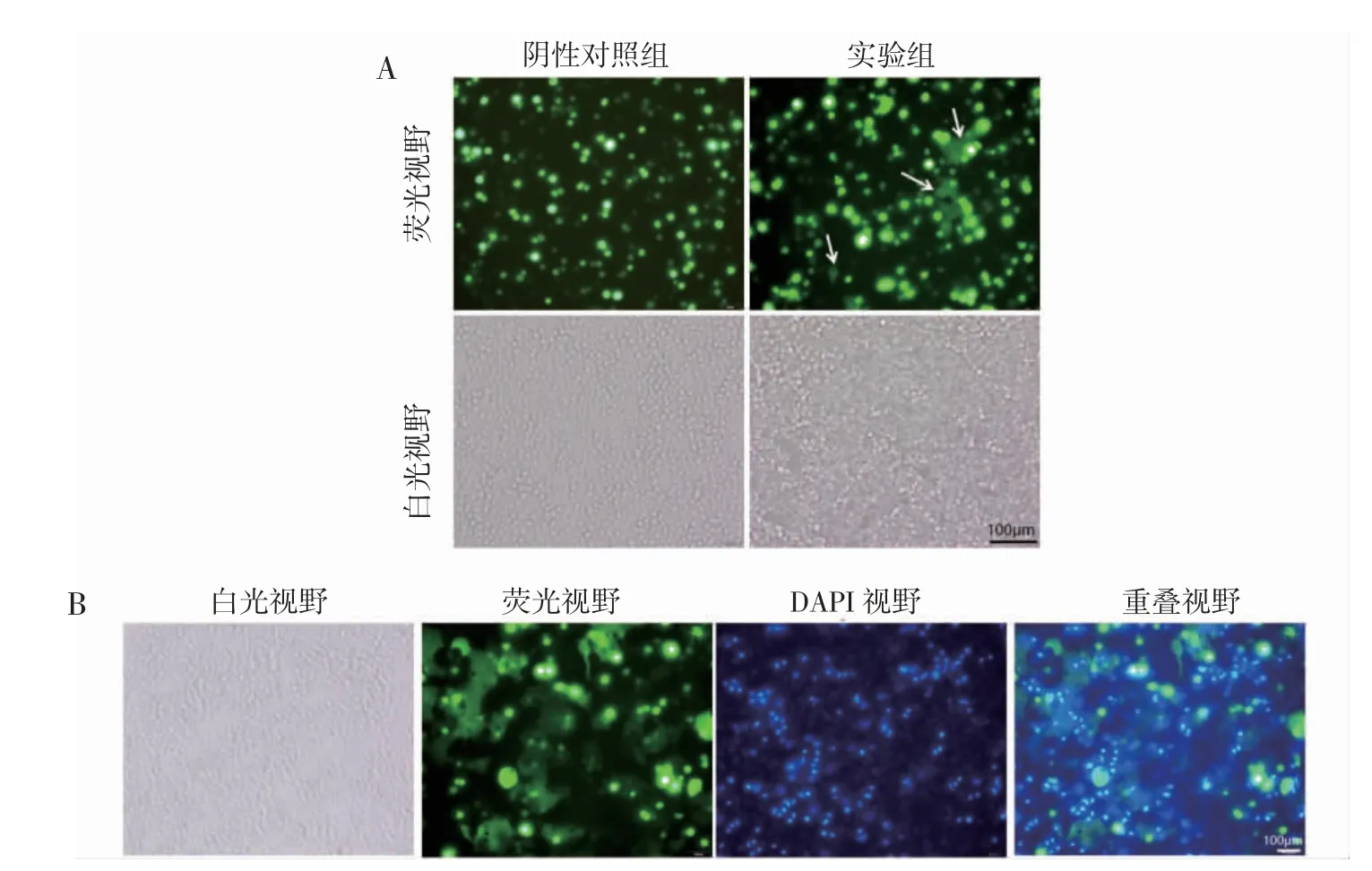
图1 HCoV-229E S 蛋白介导的细胞-细胞融合情况
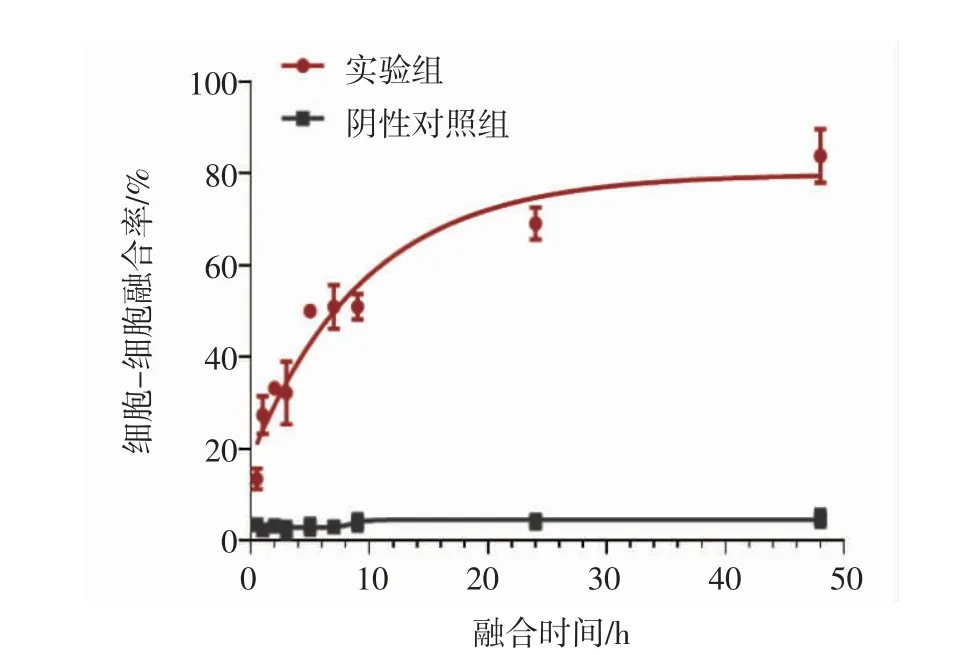
图2 时间融合关系曲线
2.2 松塔提取物对HCoV-229E 的抑制作用 利用细胞-细胞融合模型检测松塔提取物对HCoV-229E的抑制活性,6 h 后观察各组细胞-细胞融合情况,计算抑制率并绘制抑制曲线,结果显示:松塔提取物能以剂量依赖方式有效抑制由HCoV-229E S 蛋白介导的细胞融合现象发生。见图3A。松塔提取物浓度为2 mg/mL 时,能抑制75%的细胞融合,IC50为(0.136±0.010)mg/mL,而不加松塔提取物的阴性对照组没有抑制作用。假病毒模型检测结果显示:松塔提取物能抑制HCoV-229E 假病毒感染,在1 mg/mL 时对HCoV-229E 假病毒感染的抑制率达到90%,且以剂量依赖方式有效抑制感染,IC50为(0.069±0.015)mg/mL。见图3B。实验结果表明松塔提取物能有效抑制HCoV-229E 的进入。

图3 松塔提取物抑制曲线
2.3 时间-移除实验结果 实验组1 松塔提取物与293T/229E/EGFP 作用1 h 后直接加入Huh-7 细胞中,抑制率为(82.10±5.30)%。实验组2 松塔提取物仅与293T/229E/EGFP 作用,以明确药物作用靶点是否在S 蛋白上,抑制率为(77.25±4.92)%。实验组3 松塔提取物仅与Huh-7 细胞作用,明确药物作用靶点是否在靶细胞的受体上,抑制率为(25.28±3.07)%。由此可见,松塔提取物抑制活性靶向HCoV-229E 的S 蛋白。
2.4 时间-添加实验结果 共培养293T/229E/EGFP 和Huh-7 细胞后,于不同时间加入松塔提取物,观察其抑制活性,结果显示:融合初始阶段加入松塔提取物抑制活性能达到60%,随着时间的推移,抑制活性逐渐降低,2.0 h 后,抑制活性只达到10%,说明松塔提取物作用时间在HCoV-229E 感染的早期。见图4。

图4 松塔提取物作用时间检测
2.5 细胞毒性检测结果 检测了松塔提取物的细胞毒性率,结果显示:不同浓度松塔提取物对293T及Huh-7 细胞没有明显毒性作用。见表1。
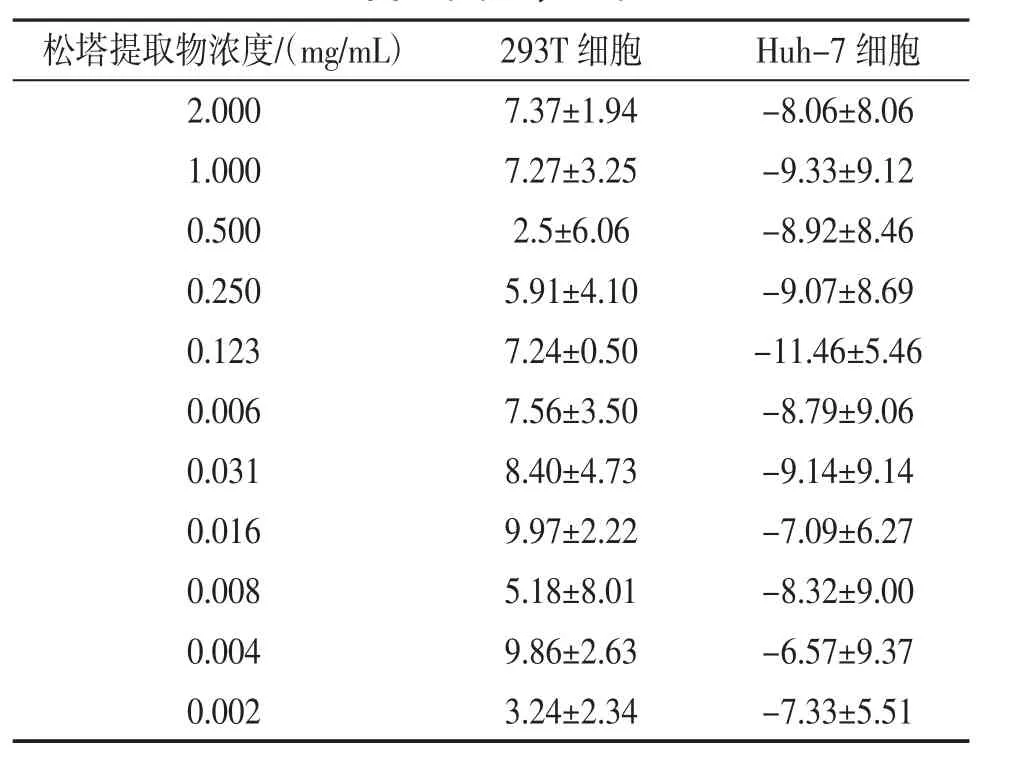
表1 松塔提取物对293T、Huh-7 细胞的细胞毒性率(%,x±s)
3 讨论
在新型冠状病毒全球传播的大背景下,虽然针对冠状病毒的疫苗研发技术在迅速发展,但药物研究方面迄今为止仍没有针对SARS-CoV-2 或其他冠状病毒的有效药物〔8-9〕,因此急需研究开发新的治疗药物。
松塔含许多天然化合物,具有抗病毒、免疫增强、抗肿瘤等多种作用〔10-11〕,有极其广泛的药用价值。云南松主要分布在中国西南地区,其松塔中的木质素-碳水化合物复合物具有多种药理特性。张海珠等〔12〕于云南松松塔提取物中发现并提取了木质素,分析证明其与抗HIV 作用有关;崔雪青等〔13〕采用合胞体抑制实验等方法证明了思茅松松塔提取物SMS-F 能作用于HIV-1 进入融合阶段,从而阻断合胞体的形成,具有很好的抗HIV-1 活性。多项研究〔6,14〕表明,天然的木质素对流感病毒、HIV-1、轮状病毒、单纯疱疹病毒、肠病毒的生长均有抑制作用,具有多方面的抗病毒活性。基于此,本研究进一步对松塔提取物的抗HCoV-229E 的活性进行评价,并探讨了其作用机制。
S 蛋白是研究抗冠状病毒进入抑制剂药物及疫苗的主要靶点之一。其中进入抑制药物可以通过阻断S1 与相应受体的结合,或靶向S2 抑制其6-HB的形成,从而阻断病毒包膜与靶细胞细胞膜的融合进程,最终抑制冠状病毒的感染。本研究成功构建了由HCoV-229E S 蛋白介导的可视化细胞-细胞融合模型,制备了HCoV-229E 假病毒,以检测松塔提取物对HCoV-229E 的抑制活性。结果显示:松塔提取物能有效抑制由HCoV-229E S 蛋白介导的细胞-细胞融合(IC50:0.136±0.010 mg/mL),同时能有效抑制HCoV-229E 假病毒对靶细胞的感染(IC50:0.069±0.015 mg/mL)。进一步通过时间-添加实验以及时间-移除实验研究作用时间及作用靶点,结果表明松塔提取物作用是在病毒感染的早期,靶向S 蛋白。
综上所述,本研究初步建立了一种安全性高的抗HCoV-229E 感染活性体外检测模型,对松塔提取物抗HCoV-229E 活性作出评价并研究其机制。结果显示:松塔提取物具有较强的抗HCoV-229E活性和低细胞毒性。松塔具有来源广泛及廉价易取的特点,适宜量产,有望成为抗冠状病毒的候选药物之一,但其具体机制和体内抗HCoV-229E 病毒活性和毒性有待进一步评价。

