艾司洛尔联合连续血液净化治疗对感染性休克患者组织氧代谢及炎性因子水平的影响
唐燕平,李善敬,苏钟东
(广东医科大学附属第二医院急诊科,广东湛江 524000)
感染性休克为临床危急重症,具有进展快、病死率高等特点,早期表现为神志不清、血压下降等症状,若不及时治疗,还可诱发多脏器功能衰竭[1-2]。连续血液净化(continuous blood purification,CBP)是近年来治疗感染性休克的重要手段之一,可清除患者体内炎性介质与内毒素,阻止炎症急性扩散,从而减轻体内器官组织损伤,稳定病情进展[3]。但感染性休克病情复杂,单纯CBP治疗效果有限。艾司洛尔为β肾上腺素能受体阻滞剂,具有减慢心率、改善心肌血氧供应、增强心功能等多种作用,有利于稳定机体血流动力,在感染性休克治疗中具有重要价值[4]。鉴于此,本研究旨在分析艾司洛尔联合CBP治疗感染性休克的临床效果。
1 资料与方法
1.1 一般资料选取2019年1月—2021年1月广东医科大学附属第二医院急诊科收治的感染性休克患者68例,按随机数字表将其分为对照组(39例)与观察组(39例)。研究经医学伦理委员会批准。对照组男24例,女15例;年龄52~76岁,平均(62.34±4.17)岁;感染类型:15例肺部感染,9例泌尿系统感染,10例腹腔感染,5例其他感染;体重指数18~26 kg/m2,平均(23.54±1.17)kg/m2。观察组男23例,女16例;年龄52~77岁,平均(62.38±4.19)岁;感染类型:14例肺部感染,10例泌尿系统感染,11例腹腔感染,4例其他感染;体重指数18~26 kg/m2,平均(23.58±1.19)kg/m2。两组一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 纳入和排除标准纳入标准:符合《中国急诊感染性休克临床实践指南》[5]中诊断标准;6 h早期液体复苏及目标导向治疗后中心静脉压仍≥12 mmHg,并需应用去甲肾上腺素维持心率≥95次/min、平均动脉压≥65 mmHg者;患者及家属知情同意。排除标准:入组前使用过β-受体阻滞剂;合并恶性肿瘤;凝血功能障碍。
1.3 治疗方法两组均接受抗感染、呼吸支持、营养支持等综合治疗,并动脉穿刺监测连续心排血量。对照组采用CBP治疗,选用Muti Filtrate型血滤机及相关配套设备,CBP治疗的模式为连续性静脉-静脉血液滤过,自右侧颈内静脉穿刺置管,建立好血管通路后,置换液流速控制在3000~4000 mL/h,并加用低分子量肝素抗凝,其间监测活化部分凝血活酶时间,维持40~60 s,每日治疗12 h内,单套滤器及管路应用应小于24 h,视病情治疗5~7 d。于对照组基础上,观察组加用盐酸艾司洛尔(广州万正药业有限公司,国药准字:H20055990)治疗,经上腔静脉导管给药,初始微量泵入0.05 mg/(kg·min),后期依据心率调整剂量,控制24 h内心率低于100次/min,连续用药5~7 d。
1.4 观察指标(1)临床疗效。显效:治疗后收缩压高于90 mmHg,意识恢复清醒,周围微循环灌注改善显著,尿量高于30 mL/h,且48 h内病情稳定;有效:收缩压为显效标准,意识恢复清醒,尿量明显增加,但仍需间断予以多巴胺等药维持血压,且于72 h内病情稳定;无效:未达上述标准。(2)组织氧代谢指标。治疗前及治疗7 d后,以血氧监护仪监测两组中心静脉血氧饱和度(ScvO2)变化,并采集3 mL静脉血,以分光光度法测定血乳酸(Lac)水平。(3)炎性因子。治疗前及治疗7 d后,采集两组5 mL静脉血,离心取得血清后,以酶联免疫吸附法测定白介素-1β(IL-1β)水平,并以放射免疫法测定降钙素原(PCT)水平。(4)心功能指标。治疗前及治疗7 d后,采集两组空腹静脉血,分别采用荧光免疫层析法、胶体金法测定B型钠尿肽(BNP)、肌钙蛋白I(cTnI)。

2 结 果
2.1 两组临床疗效比较观察组治疗总有效率高于对照组,差异有统计学意义(P<0.05)。见表1。
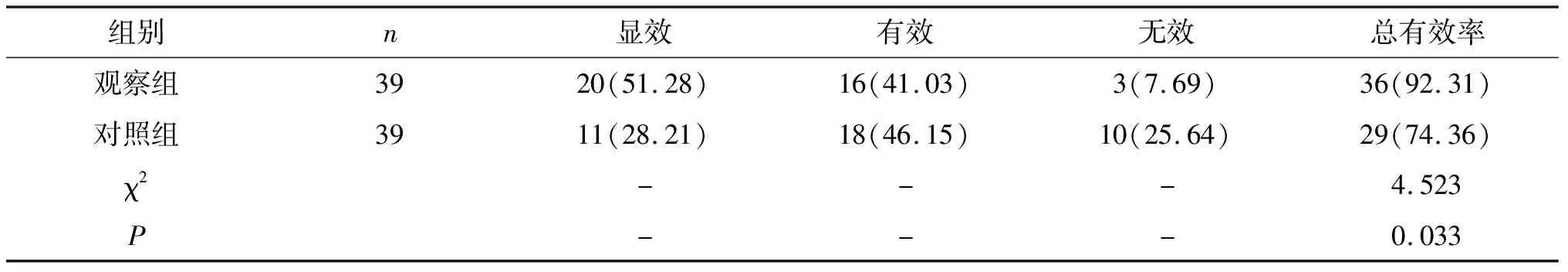
表1 两组临床疗效对比[n(%)]
2.2 两组的组织氧代谢指标比较观察组治疗后ScvO2高于对照组,Lac低于对照组,差异有统计学意义(P<0.001)。见表2。

表2 两组组织氧代谢指标对比
2.3 两组炎性因子水平比较观察组治疗后IL-1β、PCT水平低于对照组,差异有统计学意义(P<0.001)。见表3。

表3 两组炎性因子水平对比
2.4 两组心功能指标比较观察组治疗后BNP及cTnI低于对照组,差异有统计学意义(P<0.01)。见表4。

表4 两组心功能指标对比
3 讨 论
感染性休克发病较为复杂,多由各种病原微生物侵袭机体引发全身性炎症反应,致毛细血管通透性增加及静脉异常扩张,大量血浆外渗,体内有效循环血量减少,导致心脏代偿功能障碍,使得有效循环血量不足进一步加重,最终引起微循环功能障碍[6-7]。感染性休克进展迅速,若未能及时控制,可引起多器官组织缺血缺氧,诱发多器官功能衰竭,威胁生命安全[8]。临床应及时抑制炎症蔓延,纠正组织器官缺氧,以改善感染性休克患者预后。
CBP属于新型血液净化技术,通过连续性静脉-静脉血液滤过,可快速清除体内多种炎性介质及内毒素,阻断瀑布样炎症反应,减轻机体炎性损伤,从而阻止感染性休克患者病情继续恶化[9-10]。CBP还可清除体内溶质和过多水分,纠正酸碱与水电解质失衡,稳定机体内环境,改善微循环状态,并能提高组织细胞摄氧能力,缓解组织器官缺氧,以促进病情恢复[11]。但感染性休克发病机制复杂,单纯CBP治疗虽具有一定疗效,但对患者病情整体改善幅度较小。ScvO2、Lac为监测组织氧代谢的重要指标,当机体组织缺氧时,ScvO2降低,Lac分泌增多。IL-1β、PCT为监测炎症反应的重要指标,其中IL-1β参与免疫应答及组织修复等过程,炎症加剧时其水平异常升高,可加速感染性休克进展;PCT可反映全身炎症反应活跃程度,机体受严重感染时,可促进PCT大量合成并释放入血。本研究结果显示,观察组治疗总有效率高于对照组,治疗后ScvO2高于对照组,Lac低于对照组,IL-1β、PCT水平低于对照组,表明艾司洛尔联合CBP治疗感染性休克效果显著,可控制机体炎症反应,纠正组织氧代谢异常,以稳定病情进展。艾司洛尔为超短效静脉β-受体阻滞剂,具有起效快、代谢快、方便调控等特点,通过持续静脉泵入,可迅速结合β肾上腺素受体,抑制儿茶酚胺及神经递质对β-受体激动效应,从而阻滞β-受体,稳定控制患者心率,对抗过度代谢状态,以降低心肌氧耗,增加冠脉供血,纠正外周组织低灌注,进而提高患者生存率[12-13]。同时,艾司洛尔还具有一定抗炎作用,可对儿茶酚胺经β-受体介导的TLR-4及其下游炎性因子表达产生抑制作用,在一定程度上减轻炎症反应。感染性休克的主要原因为脓毒症,脓毒症引发的心肌损伤是导致患者多器官功能障碍及功能衰竭的主要原因[14]。本次研究结果显示,观察组治疗后BNP及cTnI低于对照组。提示艾司洛尔联合CBP治疗感染性休克有利于降低BNP及cTnI水平,对患者心肌损伤具有保护作用。艾司洛尔在感染性休克治疗中,能够拮抗儿茶酚胺及神经递质对β受体起到的激动作用,可阻滞β受体,稳定患者的心率,降低心肌耗氧量,且对平均动脉压无明显影响,同时可增加冠脉血流灌注,改善心肌氧供及血供,具有明显的心肌保护作用,有利于改善心功能[15]。艾司洛尔与CBP联用后可协同增效,从不同作用环节发挥作用,以增强炎症控制效果,纠正多器官组织缺血缺氧状态,进而阻止病情恶化,提高预后效果。
综上所述,艾司洛尔联合CBP可迅速阻断感染性休克患者机体炎症蔓延,改善组织氧代谢状况及心功能,以稳定病情进展。

