内镜黏膜下剥离术治疗食管乳头状瘤癌变一例
徐文 刘晓波 郜元军 李胜保 贾冬梅
患者,女,64岁,2021年1月2日因“腹痛30余年”收入我院。患者30年前出现腹痛,间断胀痛,以剑突下明显,伴咽部异物感、嗳气,无进食梗阻感、反酸、恶心、呕吐、呕血、胸闷、胸痛、声音嘶哑等不适,院外自服“奥美拉唑”等药物后症状可缓解,为寻求进一步诊治遂收入我科治疗。既往无特殊病史、吸烟及饮酒史。入院体格检查:T 36 ℃,P 76次/分,R 18次/分,BP 130/84 mmHg。一般情况可,全身浅表淋巴结未触及,皮肤、黏膜、心、肺、腹部及四肢均未见异常。妇科检查:外阴发育正常,阴道通畅,少量白色分泌物,宫颈萎缩,双侧附件未及明显异常。实验室检查:血常规、肝功能、肾功能、电解质、凝血功能、尿常规均正常;大便常规+隐血试验结果为阴性;肿瘤标记物[甲胎蛋白(AFP)、细胞角蛋白19片段(CYFRA211)、鳞状细胞癌抗原(SCC)、癌胚抗原(CEA)、糖类抗原(CA)199、CA724]结果均正常;细胞免疫:总T细胞(CD3+)% 63.77%(65.00%~80.00%,括号内为正常参考值范围,以下相同),辅助性T细胞(CD4+)% 30.47%(35.00%~45.00%),CD4+/CD8+比值 0.93(1.00~2.00),其余淋巴细胞、CD8+均正常;体液免疫:IgG、IgA、IgM、IgE、C3、C4、IgG4、Kap、Lam均正常;乙肝五项:表面抗体及核心抗体均为阳性,其余项目均为阴性;感染性疾病筛查:丙型肝炎、HIV、梅毒均为阴性;食管白光及窄带成像(NBI)内镜检查结果:距门齿约18~33 cm见黏膜粗糙,多发白色半透明的扁平隆起,以距门齿22~25 cm隆起明显,呈环周生长,病变范围占食管腔4/5(图1)。NBI染色见隆起处颗粒样增生改变,中央可见血管,食管乳头内毛细血管环(IPCL)呈B1型改变。诊断:食管多处乳头状瘤伴上皮内瘤变(B1改变)、慢性浅表性胃炎伴糜烂隆起(Ⅱ-Ⅲ级)。胃镜组织病理检查结果:食管多处鳞状细胞乳头状增生,(取检位置:食管22 cm、25 cm)局灶鳞状上皮高级别上皮内瘤变,(取检位置:食管28 cm)局灶鳞状上皮低级别上皮内瘤变,伴人乳头状瘤病毒(HPV)感染,(取检位置:食管32 cm)黏膜慢性炎症;超声内镜检查结果:食管下段肌层增厚明显,管壁厚约0.7 cm,食管中上段黏膜层明显增厚,以距门齿约22~25 cm处明显,黏膜层中低回声,管壁厚约0.75 cm,黏膜层厚约0.4 cm,周围未见明显肿大淋巴结。心电图检查结果正常。心脏彩超检查结果:二、三尖瓣少量反流,左室舒张功能减退。胸部增强CT检查结果:1.食管上段局部壁稍厚;2.右肺中叶少许纤维灶;3.主动脉及冠脉硬化。全腹部增强CT检查结果:1.肝右叶胆管结石或钙化灶;2.子宫腔内积气。宫颈液基细胞检查结果:无上皮内病变或恶性病变。宫颈上皮细胞HPV筛查结果:高危HPV、疑似高危型HPV及低危型HPV均为阴性。针对患者组织病理检查结果,取得患者知情同意后,行食管上段病变(距门齿约20~25 cm病变)内镜黏膜下剥离术(ESD),术中见食管上段病变呈半透明扁平隆起(图2),部分病变呈环周生长,碘染色淡染,手术顺利。术后切除标本大小约2.0 cm×4.0 cm,术后病检结果:TypeⅡa,鳞状细胞癌形成,中分化(面积约3.3 cm×0.8 cm),侵及黏膜固有层,未见神经及脉管侵犯,周围食管黏膜呈高级别上皮內瘤变,少部分呈低级别上皮內瘤变,切缘阴性(图3)。免疫组化结果:P53(-)、Ki-67(+)、D2-40(-)、Desmin(黏膜肌层+)、HPV分型检测(28型)阴性。针对其余食管广泛病变,建议口服胸腺肽肠溶胶囊(每次15 mg,每日3次)增强免疫力,3个月后复查胃镜及必要时再次内镜下治疗。患者术后予禁食水72 h、艾司奥美拉唑肠溶片抑酸及营养支持治疗,术后第3天开始使用甲泼尼龙30 mg静脉滴注预防术后食管狭窄,并鼓励患者进食馒头等弹性食团扩张食管。患者病情稳定后出院,院外继续口服强的松片每日30 mg,每2周减量5 mg直至停药。截至2021年4月28日,随访过程中患者均未发生食管狭窄。
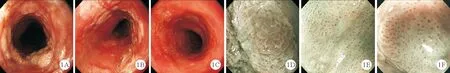
图1 2021年1月4日患者食管白光及NBI内镜检查结果(A、D:食管上段;B、E:食管中段;C、F:食管下段;A、B、C:白光内镜;D、E、F:NBI内镜)

图2 2021年1月7日患者食管上段病变ESD术中所见病灶 图3 2021年1月12日患者ESD后组织病理检查结果[A:食管鳞状上皮呈乳头状外生型生长,鳞状细胞癌形成,侵犯黏膜固有层(HE染色,×100);B:食管鳞状上皮乳头状瘤棘层可见散在挖空细胞(HE染色,×400);C:ESD后病理复原图,绿线代表正常鳞状上皮,蓝线代表低级别鳞状上皮内瘤变,黄线代表高级别鳞状上皮内瘤变,红线代表鳞状细胞癌]
讨 论
食管乳头状瘤(EP)是一种来源于食管复层上皮组织的息肉样良性肿瘤,一般不引起临床症状,患者通常因为胃部疾病行胃镜检查时偶然发现,体积较大及多发病灶时可有吞咽困难、胸骨后疼痛等症状[1]。EP相对少见,可发生于食管任何部位,最常见的位置是食管中下段,上段最少见[2]。我国EP内镜下检出率约0.114%,中老年群体多见[3]。很少有研究报道EP癌变,本文报道1例食管上段乳头状瘤患者,通过ESD治疗,术后病检证实癌变。
EP大多单发,像本文报道的食管广泛密集分布者少见。EP通常体积较小,直径多在0.2 cm~1.0 cm,>2 cm很少见[4]。根据才郎卓玛[5]的统计,EP在白光内镜下主要为3种形态:(1)乳白色的多乳头隆起,呈匍匐状,质地柔软,可观测到树枝状分支,部分可见乳头中心的细线样血管影,此型占总数86%;(2)淡红色的半球状隆起,表面可观察到排列紧密的乳头状结构,此型占总数10%;(3)偏白色的扁平微隆起,表面呈短绒毛状或细颗粒状,此型占总数4%。胃镜是发现和诊断EP的首选方法,需要与黏膜白斑、食管息肉、食管糖原棘皮病、疣状鳞癌等疾病鉴别,最终确诊依赖病理检查[6-7]。
EP的组织病理学常表现为肿瘤表面覆盖乳头状增生的鳞状上皮,伴有不全角化,部分上皮内可见挖空细胞,中央为纤维血管轴心,间质内有炎性细胞浸润,生长方式主要为外生型,次为内生型,峰型少见,三种类型可混合出现[8]。EP多呈局限生长,无明显突破基底层向深层浸润的表现,癌变极为罕见[8]。何明等[9]报道19例EP有轻至中度异型增生,1例直径7 cm的巨大EP发生癌变。Huart等[10]对78例EP患者进行的2年随访中,有2例发生癌变。因此对病灶较大的EP,建议积极内镜下治疗,警惕癌变。
EP的病因尚不明确。有学者认为HPV感染可能与EP有关,Syrjanen等[11]通过Meta分析纳入了427例不同地域的EP患者,其中132例(30.9%)患者被检测出HPV DNA阳性。本例患者ESD后标本可见较多的挖空细胞,但HPV免疫组化分型检测为阴性。文献报道与EP有关的常见亚型为HPV6及HPV11型[12],HPV感染后会被人体清除或处于潜伏状态,在肿瘤形成过程中,HPV首先整合人宿主DNA,破坏基因连续性,促使P53降解及pRb蛋白失活,从而阻断了这两种抑癌基因的抑制肿瘤作用,导致细胞过度增殖和恶性转化[13]。另一个被广泛认同的病因是食管黏膜的慢性损伤,如胃食管反流、食管支架置入、食管曲张静脉的硬化剂治疗、反复食管探条扩张等[14]。总之,EP是多因素共同作用的结果,HPV感染与黏膜慢性损伤起协同作用。
EP的自然病程有消退、生长、复发或癌变,临床进展过程缓慢,对体积较大的病灶建议积极治疗[1]。目前普遍认为单纯药物治疗对EP无效,应首选内镜下治疗[15]。但具体治疗方式的选择尚未达成共识。通过检索文献,根据EP瘤体直径可选择不同的治疗方法,大致总结如下:EP直径<0.5 cm可采用热活检钳除或电凝烧灼,也可用普通活检钳直接完整钳除;直径>0.5 cm建议圈套器完整切除病灶并送病理检查[15-16];直径>1.0 cm需警惕癌变,建议行ESD完整干净剥离病灶。
ESD逐渐成为上消化道早期癌的主要治疗方式[17-20],本例患者ESD术后病理提示局灶鳞状细胞癌侵犯黏膜固有层,水平及垂直切缘阴性,且无神经脉管侵犯征象,达到治愈性切除。因此,对于体积较大、表面有出血或表面不规则的乳头状瘤,完整干净的切除病变尤为重要[21],ESD能对病灶进行整块切除并获得完整的组织病理诊断,具有创伤小、不改变消化道的结构、避免外科手术风险及恢复快等优点,是一种安全有效的治疗方法[22]。对于食管广泛乳头状瘤的治疗方法尚无先例可循,本例患者食管上段及中段广泛病变,外科难以行全病变食管切除术,我们采取内镜微创手术联合免疫调节的治疗方式,并分阶段治疗,先采用ESD处理食管上段明显隆起的病变,考虑剥离标本环周>3/4,术后有发生狭窄的高风险,术后口服激素,同时院外口服胸腺肽增强免疫力[23],定期复查胃镜,必要时再次行内镜治疗,直至病变全部消除。
随着内镜检查的普及,EP的检出率逐渐升高,未来还需制定系统的治疗法。

