植物乳杆菌发酵人参中活性成分改变及抗氧化作用
刘士伟,刘胜楠,米倩雯,阴 裴,薛婷芳,于晓然,孟星坚,王丽娜,毕云枫,*
(1.吉林农业大学食品科学与工程学院,吉林 长春 130118;2.吉林医药学院药学院,吉林 吉林 132013)
人参为五加科人参属草本植物,主要分布于亚洲大陆东部的山林地带,在我国的东北地区常见,被誉为东北三宝之一。人参中富含多种成分,包括人参皂苷[1-2]、多糖、多肽、氨基酸[3]、酚酸、挥发油、甾醇、炔醇及维生素等[4],不同人参成分的性质及药理活性也各不相同。人参中天然皂苷Rb1、Rc、Rb2、Re和Rg1占人参皂苷总含量的70%~80%,但这些皂苷极性较大,不利于人体吸收,而人参中的稀有人参皂苷却具有较高的药理活性。大量研究表明稀有人参皂苷具有抗疲劳、抗氧化[5]、抗肿瘤[6]、增强免疫力[7]、抗炎[8]、辅助降低血糖、保护神经系统[9]等作用。人参于2012年被批准为新资源食品,对于人参发酵的研究成为近年来的研究热点。人参发酵的主要目的是使人参皂苷通过微生物酶的作用转化生成某些稀有人参皂苷。微生物转化法因其特异性强、节约成本、操作简单等优点已被广泛使用于稀有人参皂苷的转化[10]。夏晚霞等[11]筛选出发酵转化人参皂苷的乳酸菌,并分析发酵过程中人参皂苷的生物转化路径,证实发酵过程中常见皂苷向稀有皂苷的转化,使得稀有皂苷含量提高。陈旸等[12]探究发酵对中间产物人参皂苷Rd的转化作用,结果表明其转化机制为Rb1→Rd→Rg3,发酵后人参皂苷Rd含量显著提高。与之相比,使用人参粗提取物进行发酵,可以最大程度利用微生物分泌的酶分解消耗掉糖、蛋白质等杂质,提高人参皂苷纯度,同时得到更多种类的转化产物,也显著提高了稀有皂苷转化率。
本实验以人参提取物(ginseng extract,GE)为研究对象,采用益生菌植物乳杆菌对GE进行发酵,通过高效液相色谱(high performance liquid chromatography,HPLC)法对稀有人参皂苷成分进行定性和定量分析,测定并分析GE与发酵后人参提取物(fermented ginseng extract,FGE)中活性成分含量的变化,同时对GE与FGE的抗氧化能力进行评价。
1 材料与方法
1.1 材料与试剂
干参、黑参购于通化市人参交易市场,经吉林农业大学中药材学院教授鉴定均为五加科植物人参;植物乳杆菌B1由吉林农业大学食品科学与工程学院食品新资源团队筛选并鉴定。
人参皂苷标准品(Rh1、Rg2、Rd、Rk3、Rh4、Rg3、PPT、Ck、Rk1、Rg5、Rh2、PPD)成都曼思特生物科技有限公司;β-胡萝卜素、亚油酸、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2’-联氮双(3-乙基苯并噻唑啉-6-磺酸)(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)上海源叶生物科技有限公司;乙腈、甲醇(均为色谱纯)赛默飞世尔科技有限公司;苯酚、浓硫酸、冰乙酸 北京化工厂有限责任公司;过硫酸钾、水杨酸、铁氰化钾、三氯乙酸 成都科隆化学品有限公司;其他试剂均为分析纯。
1.2 仪器与设备
HH-4数显恒温水浴锅 江苏省金坛市荣华仪器制造有限公司;FLEXARTM型HPLC仪 美国Perkin Elmer有限公司;DGL-50B型灭菌锅 中国力辰科技有限公司;UV-2600I型可见分光光度计 岛津(中国)有限公司;GRP-9160型数显电热培养箱 上海深信实验仪器有限公司;TG16高速离心机 上海卢湘仪离心机仪器有限公司。
1.3 方法
1.3.1 植物乳杆菌发酵制备FGE
将干参以料液比1∶10分别用水和70%乙醇溶液在85 ℃提取2 h,将得到的人参提取液浓缩干燥后得到的粉末即为GE。将实验室保存的植物乳杆菌B1在37 ℃活化,将一定比例GE与无菌水加入到已灭菌的发酵罐中,随后加入在MRS培养基中活化好的植物乳杆菌使得乳杆菌终浓度为4%,活菌数达到3.15×108CFU/mL,37 ℃恒温发酵6 d。测定发酵过程中的pH值,使用0.1 mol/L NaOH溶液进行滴定,确定可滴定酸度,在发酵完成后将发酵液真空冷冻干燥,得到的粉末即为FGE。
1.3.2 HPLC法分析样品的制备
取适量GE、FGE、黑参粉分别过60 目筛,然后加入2 倍体积乙酸乙酯涡旋振荡,充分混匀进行萃取,5000 r/min离心5 min后吸取上清液,再次重复以上操作,将2 次上清液于85 ℃水浴加热直至蒸干,然后加入等体积的色谱甲醇,充分溶解,0.22 μm滤膜过滤,滤液用于HPLC检测。
1.3.3 GE与FGE中活性物质含量的测定
1.3.31 总酚含量的测定
使用没食子酸作为标准品,参考白周亚等[13]方法采用福林-酚比色法测定总酚含量。以没食子酸质量浓度为横坐标,吸光度为纵坐标,于750 nm波长处测定吸光度,绘制标准曲线为y=0.94729x+0.01119,R2=0.9993,总酚含量以每克干物质中没食子酸的质量表示。
1.3.32 多糖含量测定
使用葡萄糖作为标准品,参考李万从等[14]方法采用苯酚-硫酸法测定多糖含量。以葡萄糖质量浓度为横坐标,吸光度为纵坐标,于490 nm波长处测定吸光度,绘制标准曲线为y=7.95657x-0.00716,R2=0.9993,多糖含量以每克干物质中葡萄糖的质量表示。
1.3.33 总黄酮含量测定
使用芦丁作为标准品,参考Kim等[15]方法采用氯化铝比色法测定总黄酮含量。以芦丁质量浓度为横坐标,吸光度为纵坐标,于500 nm波长处测定吸光度,绘制标准曲线为y=2.81714x-0.00745,R2=0.9991,总黄酮含量以每克干物质中芦丁的质量表示。
1.3.34 总皂苷含量测定
使用人参皂苷Re作为标准品,参考杜金凤等[16]方法采用香草醛-冰醋酸法测定总皂苷含量。以人参皂苷Re质量浓度为横坐标,吸光度为纵坐标,于465 nm波长处测定吸光度,绘制标准曲线为y=2.97523x+0.01902,R2=0.9995,总皂苷含量以每克干物质中皂苷Re的质量表示。
1.3.4 人参皂苷成分的鉴定及定量分析
用HPLC对1.3.2节中制得样品液进行稀有人参皂苷成分鉴定,HPLC条件参考李秋阳等[17]方法,色谱柱:采用PerkinElmer C18色谱柱(250 mm×4.6 mm,5 μm),流动相为乙腈(A)-0.05%磷酸盐水溶液(B);检测波长203 nm,流速:1.0 mL/min,进样量10 μL,柱温35 ℃,进行梯度洗脱。梯度洗脱步骤:0~5 min,18% A,82% B;5~20 min,21% A,79% B;20~22 min,21%~26% A,79%~74% B;22~26min,26%~32% A,74%~68% B;26~46 min,32%~33.8% A,68%~66.2% B;46~51 min,33.8%~38% A,66.2%~62% B;51~57.7min,38%~49% A,62%~51% B;57.7~58 min,49%~49.1% A,51%~50.9% B;58~62 min,49.1% A,50.9% B;62~63 min,49.1%~50.6% A,50.9%~49.4% B;63~68 min,50.6%~59.6% A,49.4%~40.4% B;68~69.8 min,59.6%~65% A,40.4%~35% B;69.8~77 min,65% A,35% B;77~94min,65%~85% A,35%~15% B;94~120 min,18% A,82% B。根据人参皂苷标准曲线定量计算出样品中稀有皂苷的含量,按照每克提取物中的稀有皂苷质量表示,单位为mg/g。
1.3.5 抗氧化活性测定
1.3.51 DPPH自由基清除能力测定
参考Chen Fang等[18]方法对DPPH自由基清除能力进行测定。配制不同质量浓度发酵前后样品溶液(0.5、1.0、2.0、5.0、10.0、20.0 mg/mL),以抗坏血酸(VC)作为阳性对照。于517 nm波长处测定吸光度。按式(1)计算DPPH自由基清除率:
式中:A0为1 mL DPPH自由基溶液+1 mL双蒸水吸光度;A1为1 mL DPPH自由基溶液+1 mL样品吸光度;A2为1 mL无水乙醇+1 mL样品吸光度。
1.3.52 ABTS阳离子自由基清除能力测定
参考Cho等[19]方法并稍作修改,配制不同浓度发酵前后样品溶液(同1.3.5.1节),以VC作为阳性对照。于734 nm波长处测定吸光度,按式(2)计算ABTS阳离子自由基清除率:
式中:A0为4 mL ABTS阳离子自由基乙醇溶液+1 mL双蒸水的吸光度;A1为4 mL ABTS阳离子自由基乙醇溶液+1 mL样品的吸光度;A2为4 mL双蒸水+1 mL样品的吸光度。
1.3.53 羟自由基清除能力测定
参考Ganguly[20]和赵磊[21]等方法,配制不同质量浓度发酵前后样品溶液(同1.3.5.1节),以VC作为阳性对照,于510 nm波长处测定吸光度。按式(3)计算羟自由基清除率:
式中:A0为乙醇-水杨酸溶液+FeSO4溶液+H2O2溶液+双蒸水的吸光度;A1为乙醇-水杨酸溶液+FeSO4溶液+H2O2溶液+样品的吸光度;A2为乙醇-水杨酸溶液+FeSO4溶液+双蒸水+样品的吸光度。
1.3.54 还原力测定
参考李青等[22]方法,配制不同质量浓度发酵前后样品溶液(同1.3.5.1节),以VC为阳性对照。以蒸馏水代替FeCl3溶液作为空白调零,以去离子水为参比,于700 nm波长处测定吸光度。
1.3.55β-胡萝卜素漂白实验
参考Park等[23]方法,配制不同质量浓度发酵前后样品溶液(同1.3.5.1节),以2,6-二叔丁基对甲酚(butylated hydroxytoluene,BHT)为阳性对照,于470 nm波长处测定吸光度,以蒸馏水代替样品作为空白对照,按式(4)计算β-胡萝卜素和亚油酸偶联自氧化的抑制率:
式中:A1和分别为加入样品后0 h和6 h的吸光度;A0和分别为空白对照组0 h和6 h的吸光度。
1.3.56 抑制脂质过氧化能力测定
参考Jung等[24]采用硫氰酸铁法评估抑制脂质过氧化的能力。配制不同质量浓度发酵前后样品溶液(同1.3.5.1节),以BHT为阳性对照。于500 nm波长处测定吸光度,按式(5)计算对脂质过氧化的抑制率:
式中:A0为第0小时样品的吸光度;A1为第72小时样品的吸光度。
1.4 数据处理与分析
2 结果与分析
2.1 发酵过程中酸度变化
如图1所示,植物乳杆菌发酵GE过程中,pH值由6.61降至3.31,可滴定酸度由0.24%升至2.81%。因为在发酵过程中产生乳酸等有机酸,使产物的pH值降低,可滴定酸度增加[25]。
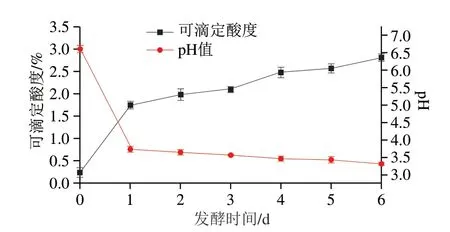
图1 植物乳杆菌发酵GE过程中pH值与可滴定酸度的变化Fig.1 Changes in pH and titratable acidity in GE during the fermentation process
2.2 发酵对GE中活性物质含量的影响
如图2 所示,与G E 相比,F G E 总酚的含量由11.775 mg/g提高到16.400 mg/g,提高了39.28%。这是由于在发酵过程中pH值的变化,影响了酚类物质的释放,微生物把复杂的大分子酚类物质转化成小分子酚类物质,使总酚含量增加[26]。这与之前研究[27],由酿酒酵母发酵黑参中总酚含量高于生参和黑参的结果相似。

图2 发酵对GE中总酚、多糖、总黄酮和总皂苷含量影响Fig.2 Effect of fermentation on the contents of total phenols,polysaccharides,total flavonoids and total saponins in GE
多糖的含量从630 mg/g降低到350 mg/g,降低了44.44%。这是由于发酵的进行,微生物不断生长,多糖作为微生物进行增殖和合成代谢的重要来源被不断的消耗。因此多糖含量的降低与微生物的生长利用有关。
总黄酮的含量从2.36 mg/g提高到4.18 mg/g,提高了79.01%。根据微生物的生长代谢特点,推测造成总黄酮含量提升可能是由于发酵过程中微生物分泌的酶类破坏了植物细胞壁,从而提高了FGE中总黄酮的含量。
总皂苷的含量从250.1 mg/g降低到156.2 mg/g,降低了37.54%。随着发酵时间延长,总皂苷含量降低,是由于人参中天然皂苷发酵过程中转化成了稀有人参皂苷所连糖基被水解掉,分子质量降低所致。
2.3 人参皂苷的转化结果分析
通过HPLC法对样品的稀有人参皂苷生成情况进行对比分析,图3为HPLC测定色谱图的对比。依据标准曲线算出样品中稀有人参皂苷的含量,结果如表1所示,经过发酵,人参皂苷含量与种类发生改变。发酵前,不含有Rk3、Rh4、Rg5等稀有人参皂苷,发酵后,生成了上述稀有人参皂苷,且与黑参中稀有皂苷含量对比,发现益生菌发酵生成稀有人参皂苷的含量高于黑参。夏晚霞等[11]和赵彩秀[28]根据研究结果推测,二醇型人参皂苷转化路径为Rb1/Rb2→Rd→Rg3→Rh2、Rb1/Rc→Rd→Rg1、Rb1→Rd→Rg3→Ck、Rg3→Rg5+Rk1。参考刘伟等[29]三醇型人参皂苷转化机理图,结合表1稀有皂苷含量结果,可以推测出人参皂苷的转化路径,二醇型人参皂苷为Rb1、Rb2、Rc→Rd→Rg3→Rg5+Ck+Rh2+Rk1→PPD(图4A),三醇型人参皂苷为Rg1、Re→Rh1+Rg2→Rh4+Rk3→PPT(图4B)。
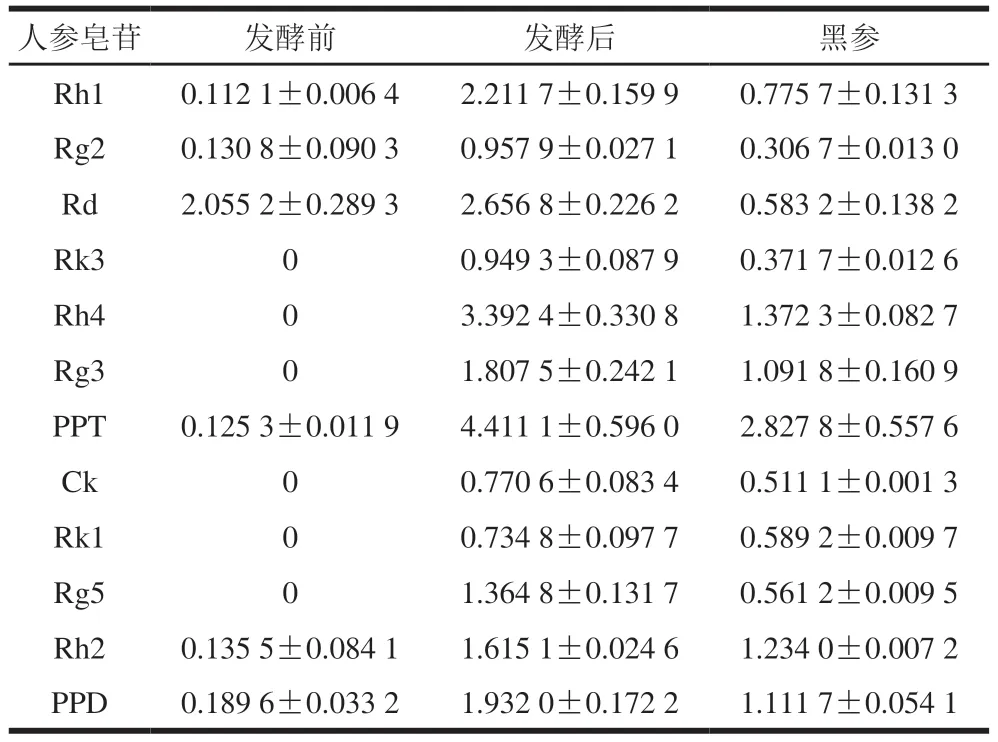
表1 发酵前后稀有人参皂苷含量对比Table 1 Comparison of rare ginsenoside contents before and after fermentation mg/g

图3 HPLC色谱图对比结果Fig.3 Comparison results of HPLC chromatograms
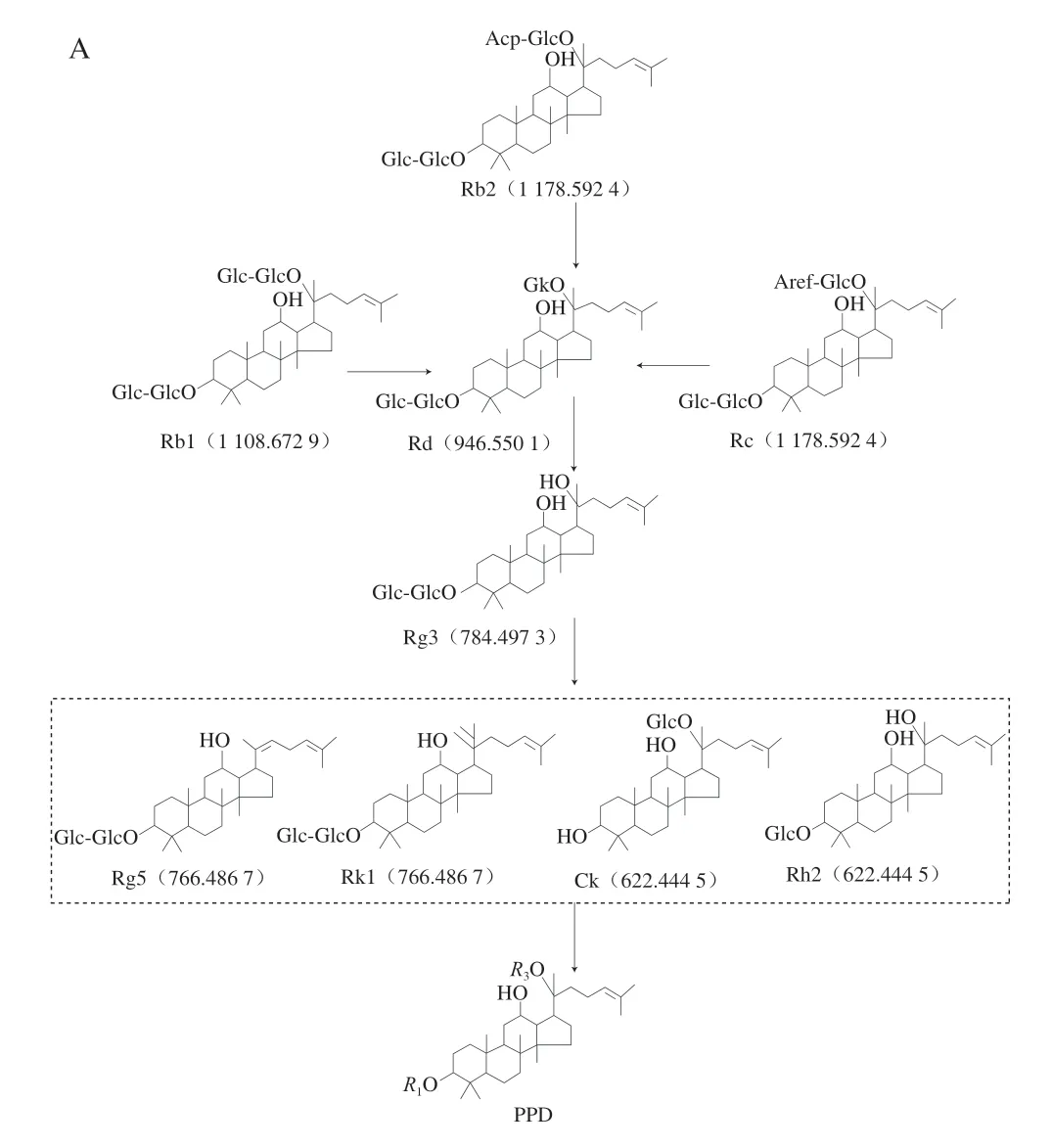
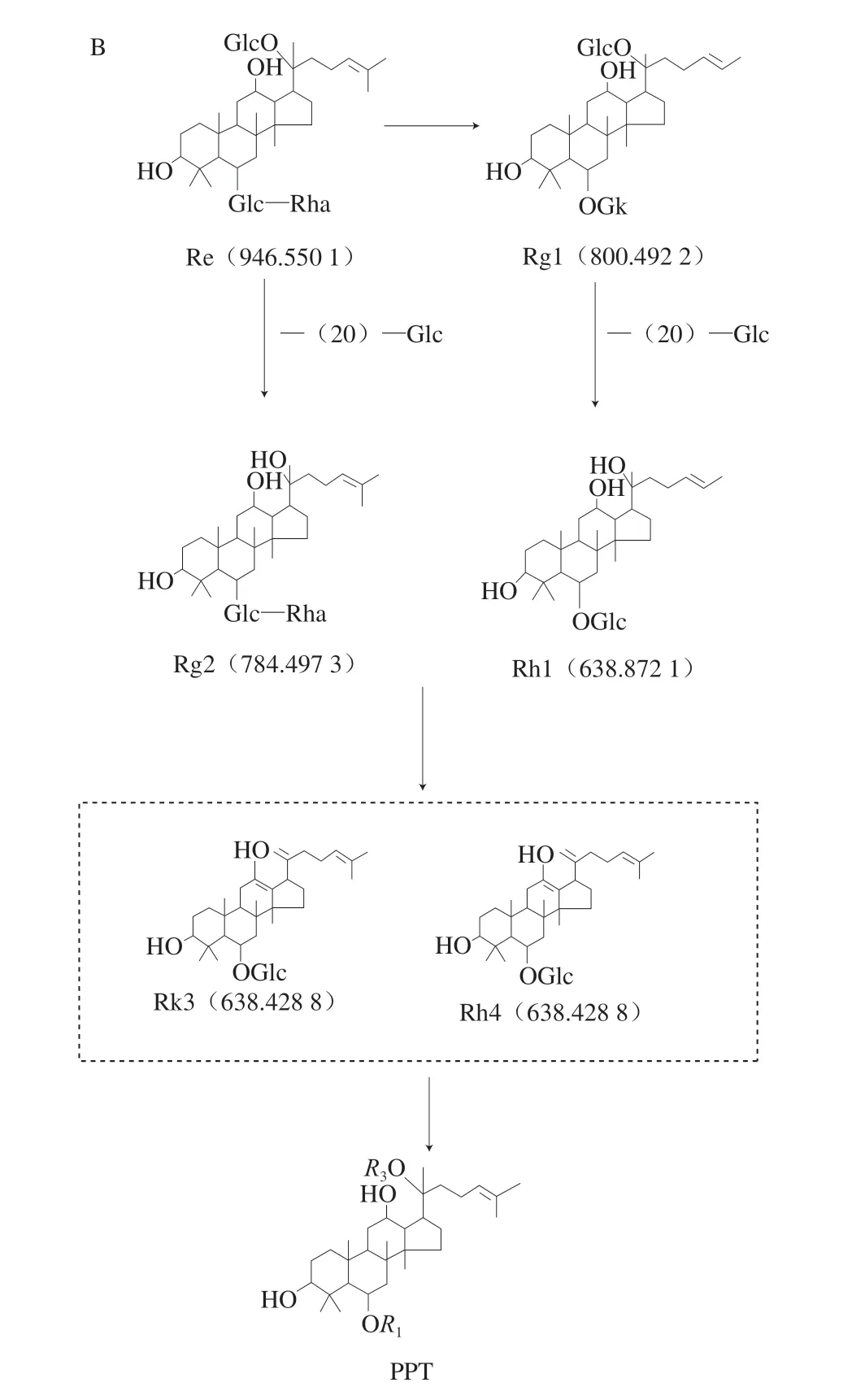
图4 二醇型人参皂苷(A)和三醇型人参皂苷(B)转化路径Fig.4 Transformation pathways of diol ginsenosides (A) and triol ginsenosides (B)
GE中主要二醇型人参皂苷为Rb1、Rc、Rb2,经发酵生成的次级代谢产物主要为稀有人参皂苷Rg3、Ck、Rk1、Rg5和Rh2,这几种稀有人参皂苷的含量分别增加了1.8075、0.7706、0.7348、1.3648 mg/g和1.4796 mg/g。GE中主要三醇型人参皂苷为Rg1和Re,经发酵生成的次级代谢产物主要为稀有人参皂苷Rh1、Rg2、Rk3和Rh4,这几种稀有人参皂苷的含量分别增加了2.0996、0.8271、0.9493 mg/g和3.3924 mg/g。菌体发酵过程中产生的酶能够将GE中人参二醇型皂苷的C3和C20位、三醇型皂苷的C6和C20位的糖基结构进行水解,使天然人参皂苷失去糖基,转化为稀有皂苷和苷元。
2.4 GE与FGE的抗氧化活性分析
2.4.1 对DPPH自由基的清除能力
DPPH自由基清除活性测定原理为紫色DPPH自由基被抗氧化剂还原为淡黄色联氨[30]。如图5A所示,GE和FGE都对DPPH自由基有清除能力。当质量浓度为0.5~20.0 mg/mL时,GE对DPPH自由基的清除率为3.43%~65.18%,FGE为14.64%~86.18%。与之相比,阳性对照VC的DPPH自由基清除率为83.15%~95.53%。随着GE和FGE质量浓度的增加,GE和FGE的DPPH自由基清除率均有明显提升,在同一质量浓度下,FGE的DPPH自由基清除率比GE更高,且发酵前后差异显著(P<0.05),说明发酵能够提升对DPPH自由基的清除能力。
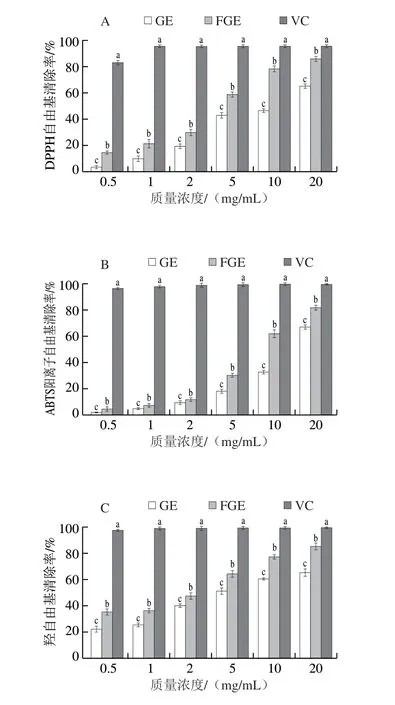
图5 GE及FGE在不同质量浓度下3 种自由基清除活性Fig.5 Three free radical scavenging activities of GE and FGE at different concentrations
2.4.2 对ABTS阳离子自由基的清除能力
如图5B所示,当质量浓度为0.5~20.0 mg/mL时,GE对ABTS阳离子自由基的清除能力为1.73%~64.75%,FGE为4.43%~81.24%。与之相比,阳性对照VC的ABTS阳离子自由基的清除率为99.05%~99.35%。随着GE和FGE质量浓度的增加,GE和FGE的ABTS阳离子自由基清除率均有明显提升,在同一质量浓度下,FGE的ABTS阳离子自由基清除率比GE更高,且发酵前后差异显著(P<0.05)。
2.4.3 对羟自由基的清除能力
如图5C所示,当质量浓度为0.5~20.0 mg/mL时,GE对羟自由基的清除能力为22.29%~68.14%,FGE为35.17%~82.29%。与之相比,阳性对照VC的羟自由基清除率为97.35%~99.37%。随着GE和FGE质量浓度的增加,GE和FGE的羟自由基清除率均有明显提升,在同一质量浓度下,FGE的羟自由基清除率比GE更高,且发酵前后差异显著(P<0.05)。
由于发酵提高了黄酮和酚类活性物质的含量,并将天然人参皂苷转化成了大量具有高抗氧化性的稀有人参皂苷。样品中稀有皂苷的含量越高,清除自由基能力越强,抗氧化能力越强,这也是FGE清除3 种自由基能力高于GE的原因,但同时多糖含量、分子质量下降也会影响自由基清除效果。
2.4.4 总还原能力测定
总还原能力的测定原理是将铁氰化钾的三价铁还原成二价铁,二价铁进一步和三氯化铁反应生成在700 nm波长处有最大吸收峰的普鲁士蓝,吸光度越高则表示样品的还原能力越强[31]。如图6所示,当质量浓度为0.5~20.0 mg/mL时GE吸光度为0.0741~0.6411,FGE为0.0821~0.9244。与之相比,阳性对照VC的吸光度为2.0145~4.2041。随着GE和FGE质量浓度的增加,GE和FGE的还原能力均有明显提升,在同一质量浓度下,FGE的吸光度高于GE,且发酵前后差异显著(P<0.05)。这是由于在发酵过程中形成了能够与自由基反应稳定的还原剂,提高了还原能力。
2.4.5 对β-胡萝卜素与亚油酸偶联自氧化的抑制作用
β-胡萝卜素是一种多烯橘黄色素,被氧化时易褪色,乳化液中的亚油酸会自动氧化,生成的自由基可以与β-胡萝卜素反应,使β-胡萝卜素颜色衰减,抗氧化剂可以减缓β-胡萝卜素颜色衰减的速度[32],因此该实验可用于测定抗氧化能力,并确定对亚油酸和β-胡萝卜素偶联自氧化的抑制作用。如图7所示,当质量浓度为0.5~20.0 mg/mL时,GE的抑制率为0.98%~75.76%,FGE的抑制率为4.04%~81.19%。与之相比,阳性对照BHT的抑制率为89.54%~99.69%。随着GE和FGE质量浓度的增加,GE和FGE的抑制率均有明显提升,在同一质量浓度下,FGE的抑制率高于GE,且发酵前后差异显著(P<0.05)。说明发酵能够提高对亚油酸和β-胡萝卜素偶联自氧化的抑制作用,FGE可作为天然抗氧化剂。
2.4.6 对脂质过氧化的抑制作用
如图8所示,在0.5~20.0 mg/mL下GE和FGE的脂质过氧化抑制率分别为28.43%~86.59%和47.58%~92.58%。与之相比,阳性对照BHT的脂质过氧化抑制率为83.65%~94.11%。结果表明,FGE的脂质过氧化抑制率高于GE,在同一质量浓度下,FGE脂质过氧化抑制率比GE更高,且发酵前后差异显著(P<0.05)。这是由于产生的稀有人参皂苷能抑制脂质过氧化活性、增加抗氧化酶[33],并且酚类化合物能够与金属离子发生络合作用,与脂类氧化生成的羰基化合物发生反应[34],使FGE具有更强的抑制脂质过氧化能力。

图8 GE及FGE在不同质量浓度下脂质过氧化抑制率的对比Fig.8 Comparison of inhibition of lipid peroxidation by GE and FGE at different concentrations
3 结论
人参皂苷是人参的主要功能性成分,利用微生物产生的葡萄糖苷酶的去糖基化作用,可将其转化为功能更强的稀有人参皂苷。植物乳杆菌发酵GE对pH值、可滴定酸度、总酚、多糖、总黄酮、皂苷含量、人参皂苷成分和抗氧化效果影响显著。总酚和总黄酮的含量增加,经HPLC分析发现,皂苷组成发生变化,天然人参皂苷经过水解作用,转化为稀有皂苷和苷元,如Ck、Rk1、Rh4、Rg5等。通过不同的方法评估发酵对抗氧化活性影响,FGE对3 种自由基具有明显的清除作用,均呈剂量依赖性增加,其中FGE对亚油酸的自氧化有着更强的抑制作用。本研究证明,发酵GE能够产生稀有人参皂苷,能够提高抗氧化能力的同时抑制脂质氧化。因此,FGE可作为潜在的天然抗氧化剂应用于食品和药品工业中。

