生物动力种植模式对‘赤霞珠’葡萄酒酵母菌群和香气成分的影响
陈学莲,藏 伟,刘 宇,姜站站,彭 帅,王 婧
(甘肃农业大学食品科学与工程学院,甘肃省葡萄与葡萄酒工程学重点实验室,甘肃 兰州 730070)
近年来,葡萄种植模式对酿酒微生物及葡萄酒品质的影响逐渐成为葡萄酒领域研究热点。目前,常见的葡萄种植模式分为常规(conventional,CV)种植、有机种植及生物动力(biodynamic,BD)种植。BD理念是由奥地利哲学家鲁道夫·斯坦纳于1924年提出,随着人们对健康农业的不断追求,BD理念逐渐在葡萄种植、葡萄酒生产中流行起来[1]。CV种植允许使用化肥、农药、除草剂、杀菌剂等化学合成物质,这些化学物质的大量使用造成生态系统的破坏[2],而BD种植禁止一切化学合成物质的使用,可以施用特殊的配制剂(草本植物和矿物元素)以防治病虫草害并使用堆肥、绿肥等有机肥料改良土壤,以此保护葡萄园的生态多样性[3-4]。同时,BD葡萄酒的酿造采用自然发酵方式,以避免影响葡萄园微生物结构,增加葡萄酒风味的复杂性[4]。
不同种植模式对葡萄园及葡萄浆果上附着的酵母菌群有一定影响[5]。据报道,BD种植增加了葡萄园微生物种群的丰富度和多样性[6-7]。Bagheri等[8]采用可培养方法分析了南非某葡萄酒产区BD和CV种植模式下‘赤霞珠’葡萄自然发酵期间酵母菌群动态,发现BD种植的可培养酵母多样性和物种丰富度均比较高。Perpetuini等[9]研究了不同种植模式对Montepulciano葡萄真菌多样性和葡萄酒品质的影响,发现BD种植的Montepulciano葡萄真菌多样性更好,葡萄酒品质更佳。与CV种植模式酿造的葡萄酒相比,BD种植模式酿造的葡萄酒口感更加醇厚,酒体协调,具有突出的花香、果香、植物性等复杂的气味,且香气更加浓郁[10]。Christopher等[11]也发现BD种植比CV种植模式下生产的葡萄酒有更好的香气复杂性。然而,我国葡萄酒产区关于不同葡萄种植模式对葡萄酒中酵母菌群以及葡萄酒香气品质的影响鲜见报道。
本研究采用酵母可培养方法和顶空固相微萃取-气相色谱-质谱联用(headspace-solid phase microextraction-gas chromatography-mass spectrometry,HS-SPME-GC-MS)分析方法,针对贺兰山东麓小产区博纳佰馥酒庄采用BD和CV方法种植的‘赤霞珠’葡萄,分析‘赤霞珠’葡萄自然发酵过程中酵母菌群和香气成分的动态变化,并对酵母菌群与香气成分进行了冗余分析(redundancy analysis,RDA),旨在明确不同种植模式对葡萄酒发酵过程中酵母菌群和香气成分的影响,为酒庄在酿酒葡萄种植模式的选择提供数据参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
供试酿酒葡萄原料‘赤霞珠’(Cabernet Sauvignon,Vitis viniferaL.)于2021年10月1日采自宁夏博纳佰馥酒庄的葡萄园。宁夏博纳佰馥酒庄位于贺兰山东麓葡萄酒产区(宁夏,银川),多年来分别采用BD和CV模式进行葡萄种植。酒庄‘赤霞珠’葡萄为2011年定植的自根苗,独龙干树形,南北行向,其中BD种植葡萄园近5年来按照“BD认证”要求进行管理,如禁止使用农药、化肥等化学合成制剂,施用牛粪堆肥、绿肥,田间自然生草,使用BD配制剂以增强葡萄园抗病性等;CV种植葡萄园按照产区葡萄园管理规范进行管理,如使用杀虫剂、杀菌剂预防葡萄疾病,施用化肥,采用清耕法除草等。
1.1.2 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)液体培养基:称取酵母浸粉10 g,蛋白胨20 g,葡萄糖20 g,加入1000 mL蒸馏水搅拌混匀;WL(Wallerstein Laboratory)固体培养基:称取80.25 g的WL营养琼脂培养基,加入1000 mL蒸馏水,加热煮沸混合均匀;赖氨酸培养基:称取6.63 g商业赖氨酸培养基,加入100 mL蒸馏水搅拌均匀,加入1 mL的乳酸钾溶液调节pH 4.8~5.2。所有培养基均于121 ℃灭菌20 min。
1.1.3 试剂
2-辛醇(色谱纯)Sigma-Aldrich(上海)贸易有限公司;微生物基因组DNA提取试剂盒 北京索莱宝科技有限公司。
1.2 仪器与设备
SW-CJ-2FD超净工作台 苏州安泰空气技术有限公司;SPX-150-II生化培养箱 上海跃进医疗器械有限公司;LDZX-50KBS立式压力蒸汽灭菌器 上海申安医疗器械厂;WS-113手持糖度计 浙江托普仪器有限公司;TRACE1310-ISQ GC-MS仪 美国Thermo Scientific公司;H2050R台式高速冷冻离心机 长沙湘仪离心机仪器有限公司;FOSS WineScan®葡萄酒分析仪丹麦福斯有限公司。
1.3 方法
1.3.1 自然发酵和取样
将从BD种植葡萄田和CV种植葡萄田采摘的‘赤霞珠’葡萄在田间混匀、除梗、破碎,转入灭菌的5 L玻璃发酵罐,发酵罐低温运输至实验室进行自然发酵(25~27 ℃),样品分别命名为BD样品和CV样品。每天早晚进行一次压帽处理,并测定糖度值。根据糖度值分别在发酵进程的4 个时期[12]进行采样及指标测定,即发酵前(糖度约23 °Bx,酒样编号BDB、CVB),发酵中期(糖度值下降1/3时,约15~16 °Bx,酒样为BDM、CVM);发酵后期(糖度值下降2/3时,约8~9 °Bx,酒样为BDL、CVL);发酵末期(糖度值降至4 °Bx以下,酒样为BDE、CVE)。发酵结束后进行皮渣分离,静置澄清。采用FOSS WineScan®葡萄酒分析仪分别测定未发酵葡萄醪(即BDB和CVB)和发酵末期样品(即BDE和CVE)的基本理化指标。
1.3.2 菌株的分离、纯化、保藏
参考高娉娉等[13]的方法,利用WL鉴别培养基,进行菌株的分离、纯化,将纯化后的菌株保存于40%灭菌甘油中,-80 ℃保藏。
1.3.3 菌株分子鉴定
1.3.31 酵母基因组DNA的提取
将保藏的酵母菌株从-80 ℃冰箱取出后放入4 ℃冰箱中解冻12 h,按照2%的接种量将酵母菌株加入YPD液体培养基中,在28 ℃培养箱中培养48 h,再以2%的接种量转接一次,使得菌株生物量达到(1~5)×107CFU/mL,取1.5 mL菌悬液于无菌离心管中,12000 r/min、4 ℃离心1 min。使用微生物基因组DNA提取试剂盒参照使用说明进行基因组DNA提取。
1.3.32 26S rDNA D1/D2区域序列分析
参照Wang Chunxiao等[14]的方法,使用N L 1(50-GCATCATCAATAGGGAGGAAAG-30)和NL4(50-GGTCCGGTTTCAAGAGCGG-30)引物扩增分离菌株的26S rDNA D1/D2基因区域。利用1.5%琼脂糖凝胶在90 V下电泳50 min,以检查聚合酶链式反应(polymerase chain reaction,PCR)产物的质量。PCR产物被送至北京擎科生物公司进行测序。使用BLAST(http://www.ncbi.nlm.nih.gov/BLAST)将所获得的序列与NCBI数据库(美国国家生物技术信息中心)进行比对,鉴定菌株。
1.3.4 香气分析
利用HS-SPME-GC-MS进行测定。对挥发性化合物进行定性定量分析,方法参照Gao Pingping等[15]并略作修改。
定性定量方法:香气成分质谱图经计算机在NIST、Wiley数据库检索比对,结合谱图进行定性分析。采用内标法进行半定量分析,内标物选用2-辛醇。
香气活力值(odor activity value,OAV)是评价香气物质对葡萄酒整体香气贡献程度的指标[16],是由单一香气物质的浓度除以该物质的阈值得到。香气物质的质量浓度和OAV计算如式(1)、(2)所示:
式中:C为香气物质的质量浓度/(µg/L);S为香气物质的峰面积;C1为内标物的质量浓度/(µg/L);S1为内标物的峰面积。
1.4 数据分析
实验数据采用Excel进行统计,并通过IBM SPSS Statistics 26进行单因素方差分析(One-Way ANOVA);通过SIMCA 14.1软件进行正交偏最小二乘判别分析(orthogonal partial least squares-discriminant analysis,OPLSDA);通过派森诺云平台(https://www.genescloud.cn)进行RDA;采用Origin 2018软件进行绘图。
2 结果与分析
2.1 发酵曲线
两种酒样的自然发酵均能够完成酒精发酵,从而得到干型葡萄酒,其酒精发酵进程如图1所示,在酒精发酵过程中,BD和CV样品的糖度下降趋势相似。第0~5天,BD和CV的发酵速率无明显差异,糖度值降至约18 °Bx;在第6~9天CV的发酵速率比BD快,而在第9~10天BD的发酵速率比CV快,CV的糖度值降至8.5 °Bx左右,BD的糖度值降至10 °Bx左右;而在第11~14天BD和CV的发酵速率相似,并均在第14天完成酒精发酵(糖度<4 °Bx)。

图1 酒精发酵过程中糖含量变化Fig.1 Changes of sugar content during alcoholic fermentation
2.2 基本理化指标
由表1可知,BDB和CVB总糖质量浓度分别为235.67 g/L和230.13 g/L,BDB的总糖含量略高于CVB。而BDE和CVE总糖质量浓度分别为0.60 g/L和0.77 g/L(<4 g/L),表明BD和CV均已完成酒精发酵,此时BDE的乙醇体积分数(13.95%)略高于CVE(13.5%),与糖含量的数据相对应。BDB和CVB样品中总酸质量浓度分别为3.82 g/L和3.20 g/L,而发酵末期样品BDE和CVE中总酸分别增加到7.41 g/L和5.60 g/L。pH值结果与总酸结果相对应,发酵末期(BDE和CVE)的pH值低于发酵初期(BDB和CVB)。此外,由总酸和pH值数据可知,BD样品酸度高于CV样品。

表1 BD和CV葡萄醪和葡萄酒的基本理化指标Table 1 Basic physicochemical indexes of grape must and wine from BD and CV
2.3 菌株分离、鉴定
通过对BD和CV自然发酵过程中分离的酵母菌株在WL培养基上菌落形态的差异(图2),结合26S rDNA D1/D2测序结果(表2),共分离到9 属11 种酵母菌,分别为Saccharomyces cerevisiae、Hanseniaspora uvarum、Hanseniaspora opuntiae、Starmerella bacillaris、Metschnikowia pulcherrima、Pichia kudriavzevii、Issatchenkia orientalis、Cryptococus flavescens、Kazachstania hellenica、Saccharomyces boulardii、Naganishia albida。
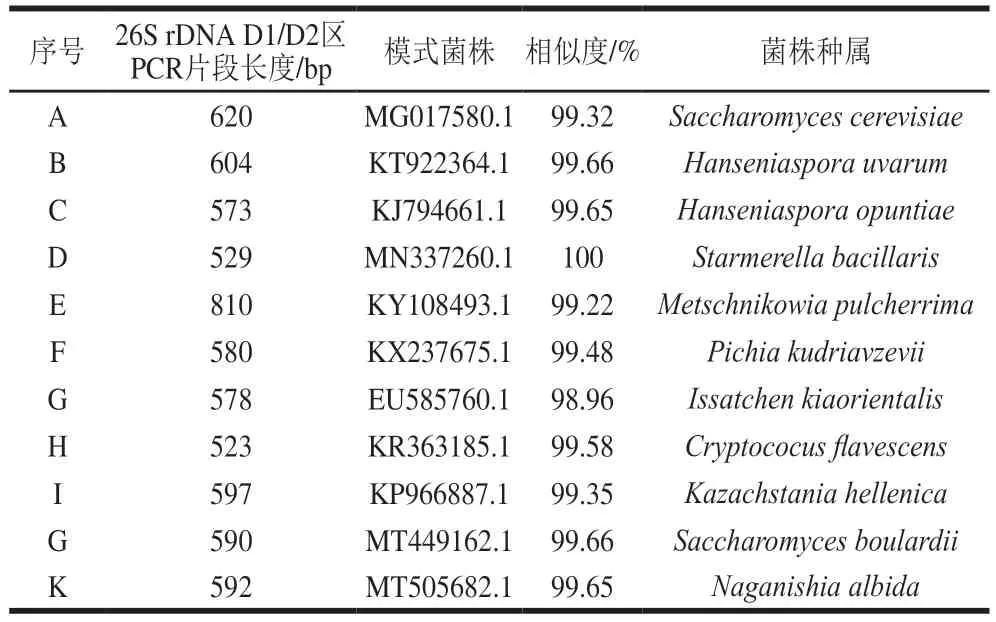
表2 酵母菌株鉴定结果Table 2 Identification results of yeast strains
2.4 酒精发酵过程中酵母菌群结构演替及差异比较
酒精发酵不同阶段分离的酵母菌群结构变化如图3所示。在所有样品中共检出11 种酵母菌。BDB样品中有5 种酵母菌,其中H.uvarum占酵母总数的83.33%为优势酵母,S.bacillaris、P.kudriavzevii、I.orientalis、C.flavescens占比分别为3.57%、3.57%、5.96%和3.57%;而CVB样品中有3 种酵母菌,其中H.uvarum为优势酵母,占酵母总数的75.34%,而M.pulcherrima和C.flavescens占比分别为23.28%和1.38%。随着发酵的进行,在BDM样品中酵母种类增多,衍生出4 种酵母菌,使BDM样品由9 种酵母菌组成,分别为非酿酒酵母H.uvarum(38.18%)、S.bacillaris(9.0%)、P.kudriavzevii(7.27%)、I.orientalis(9.09%)、C.flavescens(5.45%)、H.opuntiae(7.27%)、N.albida(1.81%)和酿酒酵母属的S.cerevisiae(18.3%)和S.boulardii(3.63%);同时CVM样品中也衍生出了4 种酵母菌,使CVM样品由7 种酵母菌组成,即为H.uvarum、H.opuntiae、M.pulcherrima、S.bacillaris、K.hellenica、S.boulardii以及S.cerevisiae,占比分别为39.21%、9.8%、3.92%、11.67%、11.67%、3.92%和19.81%。在B D L 样品中有7 种酵母菌,S.cerevisiae逐渐演替为优势酵母(57.14%),S.boulardii占比升高为5.35%,而非酿酒酵母比例降为37.51%,其中H.uvarum的比例为21.34%;CVL中S.cerevisiae成为了优势酵母(61.40%),而非酿酒酵母种类减少,此时H.uvarum、H.opuntiae、S.bacillaris和K.hellenica的比例分别为22.81%、5.26%、7.02%、3.51%。但是BDE样品中只有2 种酵母,S.cerevisiae占比达到84.21%,非酿酒酵母只有H.uvarum(15.79%);CVE样品中有4 种酵母菌,S.cerevisiae占比增长到78.57%,非酿酒酵母有H.uvarum(10.71%)、H.opuntiae(7.14%)、S.bacillaris(3.58%)。
本研究中,随着发酵进行,非酿酒酵母种类呈现了先增加后减少趋势,而S.cerevisiae占比逐渐增加,成为优势酵母,直到完成酒精发酵,这与葡萄酒自然发酵研究中酵母菌群变化规律一致[12,17-18]。BD与CV在发酵过程中酵母菌群结构存在明显区别,BD在发酵前期、中期和后期筛选出的酵母菌种类更多。Bagheri等[8]研究了不同种植模式对葡萄酒自然发酵过程中酵母种群动态变化,也发现BD的样品中可培养酵母多样性更高。但是发酵末期CV样品中检出的酵母种类比BD多,这可能是由于发酵末期BD样品中pH值更低,对酵母菌的生长产生抑制作用[19]。
本研究筛选出了酿酒酵母属的S.boulardii,其在葡萄酒微生物筛选中并不常见,通过基因分析可知,它与S.cereviseae亲缘关系较近[20]。关于S.boulardii在葡萄酒发酵中的作用机制研究较少,但有研究发现在发酵的蔬菜汁中,S.boulardii可以增加酚类物质含量,提高产品的抗氧化能力[21]。H.uvarum出现于BD和CV发酵的各个阶段,说明其具有耐高糖、乙醇等胁迫因素的能力[22]。P.kudriavzevii和I.orientalis只存在于BD样品中,其中P.kudriavzevii在葡萄酒发酵中可以产生酯类、醇类、甘油、乙酸等物质,同时它还具有降酸的作用,能够增加葡萄酒的风味,改善葡萄酒整体的品质[23-24];而I.orientalis具有高产乙醇和乙酸乙酯的能力并且具有耐乙醇、高温等胁迫的能力[25],在提高葡萄酒香气方面具有很大的潜力。
2.5 香气分析
葡萄酒中挥发性香气成分的种类、含量及其相互作用直接影响葡萄酒的品质,决定葡萄酒的风味和典型性[26]。在BD和CV发酵样品中共检测出67 种香气物质(表3),其中酯类和醇类物质种类最多,含量最高。在BDB样品中共检出31 种物质,BDM和BDL样品中均检出56 种物质,BDE样品中共检出47 种物质。在CVB样品中共检出34 种物质,CVM样品中共检出51 种物质,CVL和CVE样品中均检出47 种物质。而BD样品中香气化合物总质量浓度(75476.28 µg/L)显著高于CV(52182.32 µg/L)。为了准确分析香气物质对葡萄酒的贡献,采用OAV确定重要香气物质,以发酵末期(BDE和CVE)样品中的香气物质浓度除以该物质的阈值,得到该物质的OAV,并选用OAV>0.1的23 种物质进行挥发性香气成分的分析与讨论[16]。
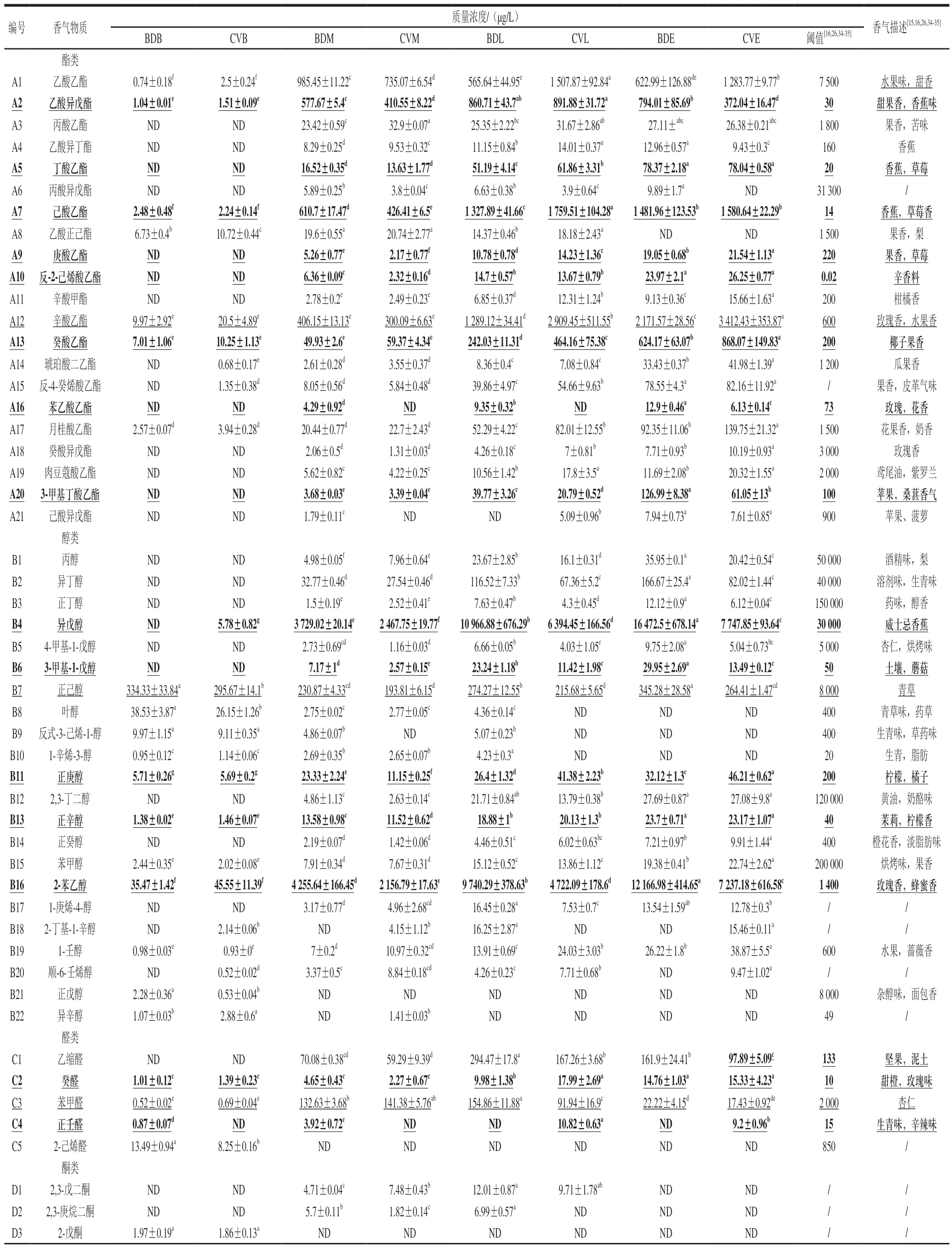
表3 BD和CV酒精发酵过程中挥发性香气物质及含量Table 3 Volatile aroma components and their contents in BD and CV during alcoholic fermentation
酯类是葡萄酒重要的香气成分,主要在葡萄酒发酵和陈酿过程中产生,可以赋予葡萄酒愉悦的果香和花香,对葡萄酒香气的形成起着至关重要的作用[27-28]。在BD和CV不同发酵阶段的样品中共检出21 种酯类物质(表3),而如图4A所示,CVE样品中酯类物质含量显著高于BDE。本研究共筛选出OAV>0.1的酯类物质有10 种,其中丁酸乙酯、庚酸乙酯、反-2-己烯酸乙酯、辛酸甲酯及3-甲基丁酸乙酯质量浓度在酿造过程中呈上升趋势,而3-甲基丁酸乙酯、乙酸乙酯、癸酸乙酯及苯乙酸乙酯在BDE中含量显著高于CVE,这些物质可为葡萄酒带来花香、玫瑰等香气。相比于BDE,CVE样品中出现了非酿酒酵母H.opuntiae与S.bacillaris(图3),而它们在发酵过程中可以代谢产生酯类物质,如乙酸乙酯、乙酸异戊酯等[29-30],这可能导致了CVE酯类含量高于BDE。
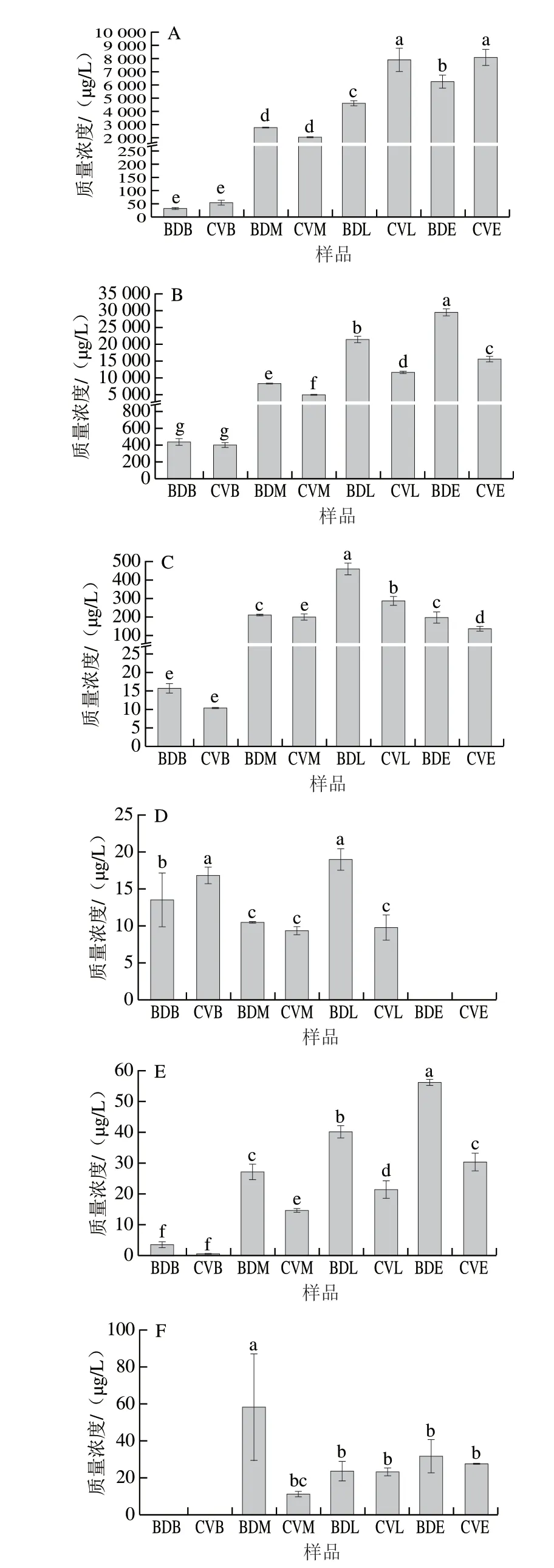
图4 BD和CV酒精发酵不同阶段挥发性香气物质及含量Fig.4 Volatile aroma components and their contents in BD and CV during alcoholic fermentation
醇类物质是酵母菌氨基酸代谢的副产物,对葡萄酒香气品质的影响较大[23]。在BD和CV不同发酵阶段的样品中共检出22 种醇类物质,且在发酵过程中含量呈上升趋势。如表3所示,OAV>0.1的醇类物质有5 种,其中异戊醇和2-苯乙醇在BDE样品中的质量浓度显著高于CVE。而有国外研究也发现BD葡萄酒中异戊醇含量更高[31]。除S.cerevisiae外,非酿酒酵母P.kudriavzevii、S.bacillaris、H.uvarum是葡萄酒发酵过程中异戊醇和2-苯乙醇合成的主要贡献菌[23-24,32],本研究发现P.kudriavzevii、S.bacillaris主要出现在BD发酵过程中,这可能导致异戊醇和2-苯乙醇含量的升高。
醛、酮类物质主要由酵母菌发酵引起的脂肪酸氧化和氨基酸降解产生,葡萄酒中醛酮类物质对葡萄酒香气的复杂性有积极影响[33]。在不同发酵阶段的样品中共检测出5 种醛类物质和8 种酮类物质,但在BDE和CVE样品中未检测出酮类物质(表3)。在发酵末期(BDE和CVE)样品中,OAV>0.1的醛类物质有乙缩醛、癸醛、正壬醛。乙缩醛在BDE样品中的含量显著高于CVE,其具有坚果、泥土等气味。正壬醛表现出生青、辛辣等香气特征,仅在CVE样品中被检出,而在BDE和CVE样品中癸醛含量则无明显差异(表3)。S.cerevisiae在发酵过程中可以产生少量醛、酮类物质[18],但是关于非酿酒酵母在葡萄酒发酵中产生醛、酮类物质的报道并不多,具体机制有待进一步研究。
萜烯类物质可以增加葡萄酒的花香、果香等香气特征[15]。在BD和CV不同发酵阶段的样品中共检测出5 种萜烯类物质(表3)。如图4E所示,在BD和CV酒精发酵不同阶段,萜烯类物质含量呈上升趋势,且BD样品各阶段的含量均高于CV。OAV>0.1的萜烯类物质有3 种,其中芳樟醇只出现在BD样品中,其散发出玫瑰、水果气味。葡萄酒中的萜烯类物质的产生主要依赖于一些非酿酒酵母[13],它们能够代谢出高酶活的β-葡萄糖苷酶水解糖苷键产生萜烯类物质,如芳樟醇、香叶醇等[22-23]。本研究发现在发酵前、中、后期中,BD样品中发现的非酿酒酵母种类均高于CV样品,而在发酵过程中更多的非酿酒酵母参与可能在葡萄酒产生大量的萜烯类物质。
脂肪酸可以赋予葡萄酒更多的脂肪、水果或干酪等气味,对葡萄酒香气的复杂性起着重要作用[12,36]。在BD和CV不同发酵阶段的样品中检测到2 种脂肪酸类物质(表3),即辛酸和2-甲基己酸。辛酸含量在发酵过程中逐渐增加,但在BDE中其含量略低CVE。2-甲基己酸只在BD样品中被检出,它在葡萄酒中表现出脂肪、奶油等香气。酵母菌可以在发酵过程中代谢产生少量脂肪酸类物质[23,37],但具体的代谢途径还不清晰,值得进一步关注。
由上述香气物质的分析结果发现,在BDB和CVB样品中各类香气物质含量没有显著差异,但是随着发酵的进行,香气物质含量发生了明显变化。葡萄酒发酵过程中微生物群落的演替和代谢过程能够影响葡萄酒香气成分的含量[12,36]。为了进一步研究酵母菌群与香气成分之间的相关性,采用OPLS-DA分析BD和CV不同发酵阶段样品的全部香气成分,并筛选出两组样品中的特征香气物质,并且利用RDA研究发酵过程中酵母菌群与特征香气物质之间的潜在相关性。
2.6 OPLS-DA
OPLS-DA是基于偏最小二乘法的一种回归分析,对香气物质进行可视化趋势分析[38],本研究选用表3中BD和CV酒精发酵不同阶段的香气物质和含量进行了OPLSDA。如图5A所示,BD和CV不同发酵阶段的样品被明显区分为3 类,2 个主成分可以反映总体94.42%的原始变量信息,其中和Q2分别为 0.999、0.812和0.848,说明模型可以反映样品间香气成分的总体情况,且模型稳定。BDB、CVB、BDM、CVM均分布于第1象限,BDL、BDE均分布于第2象限,CVL、CVE均分布于第3象限,说明BD和CV发酵阶段的样品之间存在差异,其中BD和CV发酵前期(BDB和CVB)与发酵中期(BDM和CVM)样品间差异较小,而随着发酵的进行,发酵后期及末期BD与CV样品的差异明显,但同一处理条件下,样品间并没有明显区别。
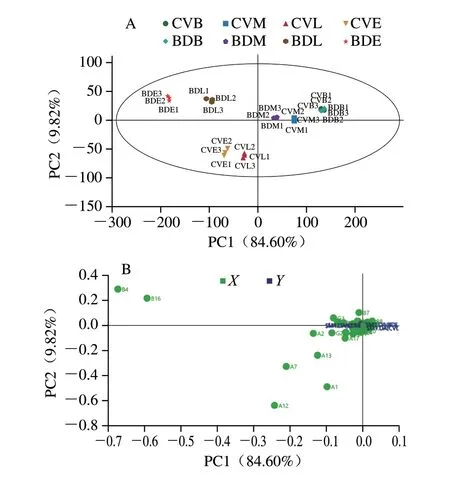
图5 酒精发酵阶段葡萄酒香气物质OPLS-DAFig.5 OPLS-DA analysis of wine aroma components during alcoholic fermentation
VIP可以用于筛选特征香气物质[39],图5B为不同香气物质(X)与不同发酵阶段(Y)OPLS-DA主成分载荷图,代表了该主成分对该类香气物质贡献程度的大小。物质与中心点越远,该物质的载荷值越大,则该物质的VIP值越大。本研究以VIP>1为指标,共筛选出11 种特征香气物质(表3)用于后续RDA。
2.7 RDA
由图6所示,S.cerevisiae与异戊醇、2-苯乙醇、辛酸乙酯、乙酸乙酯、己酸乙酯、乙酸异戊酯、癸酸乙酯、正己醇、乙缩醛呈正相关,S.boulardii与苯甲醛、乙酸乙酯、乙酸异戊酯呈正相关。研究表明S.cerevisiae在酒精发酵期间可以产生酯类和醇类、醛类等次级代谢物质,同时可以分泌果胶酶和纤维素酶并且释放葡萄表皮的色素和风味物质,对葡萄酒的感官特性产生积极影响[18,39]。然而,关于S.boulardii的研究主要集中在其益生菌特性上,该菌种对葡萄酒香气品质的影响还有待研究。H.uvarum和M.pulcherrima与正己醇呈正相关,H.opuntiae、S.bacillaris、K.hellenica、P.kudriavzevii、N.albida与苯甲醛、乙酸乙酯呈正相关,而C.flavescens与苯甲醛呈正相关。非酿酒酵母能分泌酯酶、糖苷酶等一些胞外酶,这些酶可以利用葡萄原料中的香气前体物质,形成酯类、醇类、醛类等香气物质[29]。特别是H.opuntiae和S.bacillaris在发酵过程中能够生成乙酸乙酯、苯甲醛等香气物质,提升了葡萄酒香气的复杂性[22,30],也有研究表明P.kudriavzevii在葡萄酒中能够产生乙酸乙酯,从而提高葡萄酒品质[24]。

图6 酵母菌群和香气物质的RDAFig.6 RDA plot showing the correlation between yeast community and aroma components
3 结论
宁夏贺兰山东麓产区博纳佰馥酒庄通过CV和BD种植管理的‘赤霞珠’葡萄,在自然发酵过程中酵母群落结构差异显著,其中BD种植模式下的葡萄酒酒精发酵过程中出现了7 属9 种酵母菌,即H.uvarum、S.bacillaris、P.kudriavzevii、I.orientalis、C.flavescens、H.opuntiae、N.albida、S.cerevisiae和S.boulardii,其中H.uvarum为发酵前期优势酵母,S.cerevisiae为发酵后期和末期的优势酵母。而CV种植模式下的发酵过程中出现了6 属8 种酵母菌,分别为H.uvarum、C.flavescens、H.opuntiae、M.pulcherrima、S.bacillaris、K.hellenica、S.boulardii以及S.cerevisiae,H.uvarum也为发酵前期的优势酵母,S.cerevisiae为发酵后期和末期的优势酵母。在葡萄酒香气物质的表现上,BD种植模式下的葡萄酒酒精发酵过程中香气物质总含量高于CV种植模式。通过RDA,S.cerevisiae与除苯甲醛外的特征香气物质呈正相关,而S.boulardii与苯甲醛、乙酸乙酯、乙酸异戊酯呈正相关;非酿酒酵母主要影响醇类、醛类和酯类香气物质,其中H.uvarum和M.pulcherrima与正己醇呈正相关,C.flavescens与苯甲醛呈正相关,H.opuntiae、S.bacillaris、K.hellenica、P.kudriavzevii、N.albida与苯甲醛、乙酸乙酯呈正相关。结果表明BD种植模式能够丰富酵母菌群多样性,进而影响葡萄酒香气的复杂性。

