龙胆苦苷对肝纤维化大鼠TGF-β1 和TIMP-1表达的影响
苗长瑜 刘东璞 杨晓帆 张辉
(佳木斯大学基础医学院微生态-免疫调节网络与相关疾病重点实验室,黑龙江 佳木斯 154000)
肝纤维化最突出的病理特点之一是肝组织细胞外基质(ECM)过度增多和沉积,也就是出现了ECM的代谢障碍,即合成增加,降解减少。当ECM沉积在窦周隙,必然伴有窦内皮细胞的改变,使得肝细胞与血液之间的通透性出现障碍,影响血流与肝细胞之间的物质交换。大鼠肝组织病理性增生ECM的主要来源细胞是门管区成纤维细胞〔1〕。在生理情况下,组织内门管区成纤维细胞是一个较为稳定、静止型的细胞,肝纤维化发生时,门管区成纤维细胞受到转化生长因子(TGF)-β1等细胞因子的刺激,变成活化的门管区成纤维细胞,产生过多的胶原纤维沉积造成肝血窦毛细血管化,影响肝细胞的新陈代谢。门管区成纤维细胞主要的产物是细胞外基质中的胶原纤维,除此之外,还可表达基质金属蛋白酶类(MMPs)及其抑制物。MMPs是鼠类细胞外基质降解酶类,可降解Ⅰ、Ⅱ和Ⅲ型胶原纤维〔2〕。金属蛋白酶组织抑制物(TIMP-1)是MMPs主要生理抑制物,能调节MMPs活性。TIMP-1是大多数MMPs的抑制物。门管区成纤维细胞表达的最重要的细胞因子之一是TGF-β1,TGF-β1是TIMP-1的上游激活物,可以引起TIMP-1的表达量增加,是最重要的促进肝纤维化的细胞因子之一。四氯化碳(CCl4)诱导的肝纤维化可以在早期被逆转,龙胆苦苷是一种被证明治疗器官纤维化有效的药物,秋水仙碱具有明显的抑制肝纤维化作用,本实验计划以秋水仙碱作为阳性对照药物,研究龙胆苦苷对大鼠肝纤维化的治疗效果,并检测肝组织中TGF-β1和TIMP-1表达水平的影响,进一步阐明龙胆苦苷对肝纤维化的保护作用及其作用机制,为临床药物治疗肝纤维化提供相关的理论数据和技术支持。
1 材料与方法
1.1实验动物 80只清洁级雄性SD大鼠,体质量120~150 g。购自辽宁长生生物技术股份有限公司。在佳木斯大学动物实验中心饲养并进行动物实验。
1.2材料 龙胆苦苷购自南通凯恒生物科技发展有限公司。CCl4、橄榄油试剂购自南通凯恒生物科技发展有限公司。高级切片石蜡购自上海华玲康复器械厂。秋水仙碱片购自江苏万邦生化医药集团有限责任公司。苏木素-伊红(HE)试剂盒、Masson三色染色液、抗TIMP-1抗体试剂、抗TGF-β1抗体试剂、链霉亲和素-生物素-辣根过氧化物酶(SABC-HRP)试剂盒购于北京索莱宝科技有限公司。
1.3肝纤维化动物模型建立及其计分标准 大鼠正常喂养2 w后随机分成4组,正常组5只,模型组、秋水仙碱组、龙胆苦苷组各25只。各组普通饲料喂养。模型组、秋水仙碱组和龙胆苦苷组每周腹腔注射两次40%CCl4橄榄油溶液(1 ml/kg),正常组和模型组大鼠每周灌胃10 ml/kg的生理盐水3次,龙胆苦苷组每周灌胃龙胆苦苷(100 mg/kg)3次〔3〕,秋水仙碱组每周灌胃秋水仙碱(0.12 mg/kg)3次,龙胆苦苷与秋水仙碱均溶于生理盐水中,按10 ml/kg灌胃。实验中实时监测大鼠体质量变化。在第3、5、7周各处死1只大鼠,取肝组织,进行HE染色观察肝纤维化程度。第8周处死全部大鼠,取肝组织进行HE染色、Masson染色和免疫组化染色。
根据纤维化计分系统〔4〕对各组肝纤维化程度进行比较:计分公式为L+P+2(N+W),L指肝小叶内的肝血窦周围和中央静脉周围,P指门管区,N代表纤维间隔数目,W指纤维间隔宽度。标本内仅一条细纤维间隔,W计为0.5分。本实验中大鼠的肝组织取材长度都是至少1 cm。光镜下肝组织无病理变化,计0分;中央静脉周围、肝血窦周围出现纤维间隔,分布局限,数量较少,计1分;弥漫性分布,数量较多,计2分。门管区扩大,无纤维间隔出现,计1分;门管区扩大,同时有纤维间隔出现,计2分;门管区周围出现肝硬化,计3分。每1 cm长度的肝组织纤维间隔数目少于等于6个,计1分;多于6个,计2分;出现肝硬化,计3分。纤维间隔宽度细计1分;纤维间隔宽,分布疏松,计2分;纤维间隔宽,分布致密,计3分;纤维间隔分布面积≥2/3标本面积计4分。
在免疫组化结果分析中,根据细胞染色强度分为4级,无阳性着色(阴性)计0分,淡黄色(弱阳性)计1分,棕黄色(阳性)计2分,棕褐色(强阳性)计3分;根据阳性细胞百分比评为4级,≤25%计1分,26%~50%计2分,51%~75%计3分,>75%计4分,将两项评分相乘得出最终积分结果〔5〕。
1.4HE染色 常规HE染色。光镜下观察各组大鼠肝组织的显微形态结构变化。
1.5Masson染色 光镜下分析各组大鼠肝组织纤维间隔的数目与宽度及纤维间隔分布情况。
1.6免疫组织化学染色 烤片;脱蜡和水化;抗原修复;细胞膜通透;灭活内源性过氧化物酶;正常血清封闭;滴加第一抗体抗TGF-β1抗体试剂〔用磷酸盐缓冲液(PBS)稀释为1∶100〕、抗TIMP-1抗体试剂(用PBS稀释为1∶100)20 μl,37 ℃孵育2 h;滴加生物素化第二抗体孵育;二氨基联苯胺(DAB)显色。重点观察各组TGF-β1和TIMP-1的阳性表达细胞种类及位置,比较各组肝组织TGF-β1和TIMP-1表达。
1.7统计学分析 采用SPSS29.0软件进行F检验和t检验。
2 结 果
2.1各组肝纤维化程度比较 正常组肝组织无纤维化,与正常组相比,模型组肝组织肝小叶结构被破坏,大量纤维间隔形成,肝纤维化程度计分显著增加(P<0.05)。与模型组比较,秋水仙碱组与龙胆苦苷组肝纤维化程度较模型组显著改善(P<0.05);秋水仙碱组与龙胆苦苷组肝纤维化程度计分比较无显著性差异(P>0.05)。见表1。

表1 各组肝纤维化程度计分及免疫组化中TGF-β1和TIMP-1表达比较
2.2各组肝组织形态变化 光镜下,正常组肝细胞索围绕中心静脉呈放射状排列,未见病变。模型组大量增生胶原纤维向肝小叶内穿插,形成较宽大的纤维间隔,从中心静脉通过肝血窦到门管区或从门管区到门管区或从中心静脉到中心静脉,即形成桥接纤维化,出现弥漫的纤维组织增生,广泛的纤维间隔分割肝小叶。纤维间隔中可见大量成纤维细胞。肝细胞肿胀,肝细胞索增厚,肝实质结构呈现不规则,且出现小叶内少数几个肝细胞坏死,即出现点状坏死,可见中心静脉旁有淋巴细胞浸润。与模型组相比,龙胆苦苷组和秋水仙碱组纤维组织明显减少,且纤维间隔变窄,纤维间隔中成纤维细胞明显减少。肝细胞变性、炎症得到明显改善。见图1。
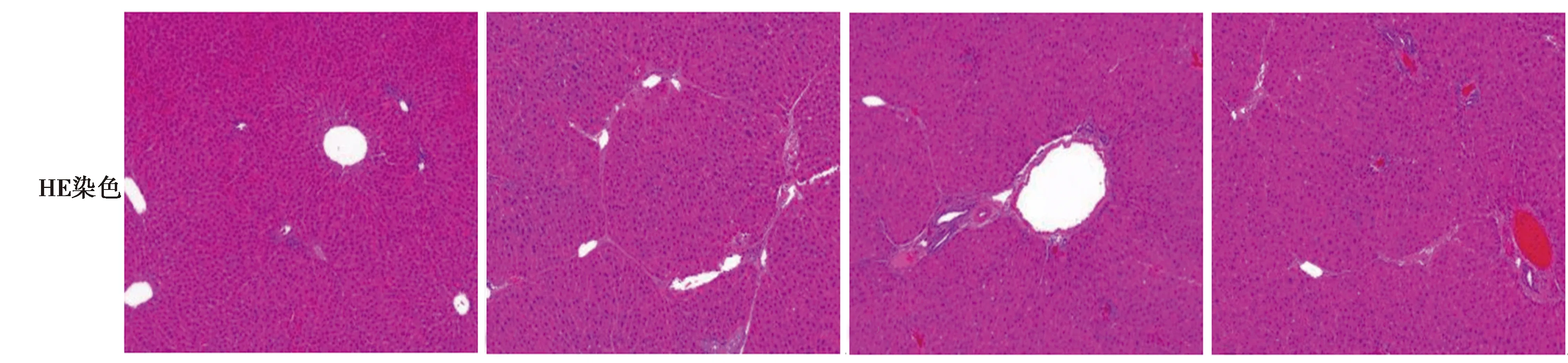
图1 各组肝组织形态(×100)
2.3各组肝组织TGF-β1、TIMP-1表达 光镜下,正常组中无阳性着色,模型组中TGF-β1和TIMP-1广泛表达在门管区、肝血窦周围及纤维间隔中,门管区成纤维细胞是主要的表达细胞,表达强度为棕褐色(强阳性),阳性细胞百分比为51%~75%,其中肝细胞出现明显小泡型脂肪变,中央静脉及肝血窦出现不同程度的扩张。秋水仙碱组与龙胆苦苷组TGF-β1和TIMP-1大部分分布于门管区及纤维间隔中,阳性表达范围与模型组相比明显减弱,阳性细胞百分比为25%~50%。见图2。经免疫组化检测结果显示:TGF-β1和TIMP-1在正常组肝组织中无表达,在模型组中表达强阳性,在秋水仙碱组、龙胆苦苷组中的表达量较模型组显著下降(P<0.05);秋水仙碱组与龙胆苦苷组表达情况相比较无显著性差异(P>0.05)。见表1。

图2 各组肝组织TGF-β1、TIMP-1表达(免疫组织化学染色,×200)
3 讨 论
光镜下可见门管区及其周围胶原纤维增生,并且沿肝血窦散在分布,互相连接,门管区及其周围有大量成纤维细胞浸润,门管区附近的肝细胞最先获得营养物质和氧气的供应,细胞代谢极为活跃,门管区成纤维细胞增生活跃的原因,早期主要源于门管区浸润的巨噬细胞旁分泌的TGF-β1,中晚期则主要源于其自分泌的TGF-β1,所以可以说TGF-β1是造成肝纤维化严重的重要原因之一〔6〕。在肝纤维化中,增生的胶原纤维是过度沉积ECM的最主要成分,尤其是Ⅰ、Ⅱ和Ⅲ型胶原纤维,即Masson染色中所见的纤维间隔〔7〕。纤维间隔的出现是肝纤维化诊断的金标准〔8〕。
一般慢性肝脏病变会随着肝纤维化程度的加重,纤维间隔的数目和宽度会相应地增加,并且纤维间隔波及范围会从门管区逐渐深入到小叶内窦周区乃至中央静脉区〔9〕。本实验中,大鼠肝纤维化形成区域主要集中在门管区及其周围区域,造成大量门管区成纤维细胞的活化,活化后的门管区成纤维细胞合成ECM的能力显著提高〔10〕。TGF-β1和TIMP-1的主要来源细胞之一就是活化的门管区成纤维细胞〔11〕。通过药物影响活化的门管区成纤维细胞,干预其表达TGF-β1和TIMP-1的作用,实现对肝纤维化的预防乃至治疗作用是本实验的中心主题。
秋水仙碱可以抑制ECM合成与分泌,能抑制肝脏纤维化,又能促进纤维化基质降解,可以解聚细胞骨架,抑制细胞的分裂增殖,在本实验中可以抑制活化的门管区成纤维细胞的增殖分裂,达到减少TGF-β1和TIMP-1的表达的作用〔12〕。王国英等〔13〕研究提示龙胆苦苷有明显抗CCl4损肝及保肝作用。龙胆苦苷对CCl4诱导的肝纤维化大鼠具有一定保护肝脏功能等〔14〕。
门管区成纤维细胞可表达多种MMPs和TIMPs,具有明显的随时间变化的程序性表达,即早期主要表达产物是MMPs,但没有TIMPs。随病变时间发展,主要表达产物变为TIMPs〔15〕。在肝纤维化形成后,TIMP-1及其上游激活物TGF-β1〔16〕是门管区成纤维细胞的主要表达产物,且在门管区成纤维细胞之间彼此作用,形成恶性循环〔17〕,TGF-β1会刺激门管区成纤维细胞合成大量的ECM〔18〕,且会抑制ECM降解酶〔19〕,是最重要的促纤维化因子之一〔20~22〕。本实验提示龙胆苦苷与秋水仙碱均具有抑制成纤维细胞增殖,减少胶原纤维沉积的作用效果,且可能是通过减少TGF-β1和TIMP-1的表达水平的作用机制实现的。
感谢黑龙江省北药与功能食品特色学科项目、微生态免疫调节网络与相关疾病重点实验室的大力支持。

