首发抑郁症双侧海马静息态和动态功能连接特征的fMRI研究
曹久冬,王小玲*,张磊,洪洋,张国雷,包岩,2,罗萍,孙黎,韩铭,吕学玉,刘军,姚晓燕,李珊珊,孙继飞,方继良
作者单位:1.中国中医科学院广安门医院放射科,北京 100053;2.中国医科大学附属盛京医院大连医院放射科,大连,116600
0 前言
抑郁症(major depressive disorder, MDD)是临床中常见的精神系统疾病,严重影响患者工作和生活质量,具有高发病率、高复发率、高致残率特点,预计到2030年底,将成为全球首要经济负担疾病[1-3]。因此,从不同领域研究MDD 的发病机制,对于探寻有效的治疗方法具有十分重要的临床价值。
近年来,静息态功能MRI(resting-state functional MRI, rs-fMRI)技术逐渐应用到MDD、双向障碍和精神分裂症等精神疾病领域[4-6]。研究表明[7],大脑在静息状态下不同脑区之间不仅仅是静态的,也存在动态性变化。其中,静息态功能连接(static functional connectivity, sFC)反映了不同大脑区域之间血氧水平依赖(blood oxygenation level dependent, BOLD)信号的相关性。动态性功能连接(dynamic functional connectivity, dFC)可以反映区域间BOLD 信号在时间尺度上波动的动态特征[7-8]。目前,多项研究已采用dFC 方法观察MDD 等精神疾病研究[9-10]。将sFC 和dFC 方法共同研究有利于对大脑活动提供全面的解释[8]。海马作为默认网络和边缘系统的重要组成部分,参与人体情感、记忆和认知等功能,与情感疾病密切相关[11-12]。因此,本研究观察首发抑郁症(first depressive episode,FDE)在静息状态下双侧海马的sFC 和dFC 的异常改变,并探索其与临床症状之间的相关性,以期为临床靶向治疗提供一定参考价值。
1 材料与方法
1.1 一般资料
收集2014 年1 月至2018 年10 月就诊于中国中医科学院广安门医院的26 例FDE 患者病例作为FDE组,另外通过广告招募20 例健康对照(healthy controls, HCs)作为HCs 组。两组在性别、年龄和受教育程度上相对匹配。本研究遵守《赫尔辛基宣言》,经中国中医科学院广安门医院伦理委员会批准,批准文号:2014EC084-01,所有患者及健康受试者均已签署知情同意书。
1.2 诊断标准
采用美国精神病学会精神障碍诊断和统计手册第四版(Diagnostic and Statistical Manual of Mental Disorders-Ⅳ, DSM-Ⅳ)有关MDD 的诊断,患者须满足未经治疗且首次发病。
1.3 纳排标准
FDE 组纳入标准:(1)符合MDD 诊断标准,且为首次 发 病;(2)24 项 汉 密 尔 顿 抑 郁 量 表(24-item Hamilton Rating Scale for Depression, HAMD-24)评分在20~35 分之间;(3)年龄在18 到60 岁之间;(4)右利手。排除标准:(1)患有其他精神疾病者;(2)存在严重的心、脑及神经系统疾病者;(3)存在自杀风险者;(4)妊娠和哺乳期女性;(5)药物或酒精成瘾者;(6)正在接受其他治疗者。
HCs 组纳入标准:(1)HAMD-24 评分<8 分;(2)年龄在18 到60 岁之间;(3)无精神疾病发作史;(4)右利手。排除标准:(1)存在严重的心、脑及神经系统疾病者;(2)存在自杀风险者;(3)MRI 扫描禁忌者;(4)妊娠和哺乳期女性;(5)药物或酒精成瘾者。
1.4 临床量表评估
本研究所有受试者均采用HAMD-24、汉密尔顿焦虑量(Hamilton Anxiety Scale, HAMA)进行评估。
1.5 rs-fMRI图像数据采集
所有受试者均在中国中医科学院广安门医院放射科进行Magneton Skyra 3.0 T 磁共振扫数据采集。扫描过程中患者佩戴降噪耳机,避免主动思维活动,并安静、清醒地平卧在检查床上。
血氧水平依赖(blood oxygenation level dependent, BOLD)成像参数为:TR 750 ms,TE 30 ms,FA 90°,矩阵64×64,层距0.6 mm,32层,层厚3.5 mm,FOV 224 mm×224 mm,扫描时间6 min 46 s。T1WI结构像参数为:TR 5000ms,TE 2.98 ms,层距/层厚1.0 mm/1.0 mm,176 层,FOV 240 mm×256 mm,FA 7°,矩阵256×256,扫描时间8 min 22 s。
1.6 fMRI预处理
采用Matlab 2021a 平台的DPARSF 6.0 工具包对图像数据进行处理,具体操作流程如下:(1)首先将DICOM 格式转换为NIFTI 格式;(2)将前10 个时间点进行去除,以防止数据不稳定;(3)时间层校正;(4)头动校正,将在任意方向头动大于2.5 mm及2.5°的数据进行去除;(5)空间标准化,将被试功能像转换到蒙特利尔神经病学研究所(Montreal Neurological Institute, MNI)空间,重采样为3 mm×3 mm×3 mm空间分辨率;(6)采用平滑核为6 mm进行空间平滑;(7)去线性漂移;(8)回归协变量,去除脑白质信号、24 个头动参数以及脑脊液信号;(9)对预处理的图像进行0.01~0.08 Hz滤波。
根据既往研究[13-14],采用与MDD 发病密切相关脑区海马作为种子点,采用基于Matlab 2021a 平台的WFU_Pick Atlas_v 3.0 软件对左、右海马种子点提取。sFC采用DPARSF 6.0软件分析,计算种子点并与全脑体素时间序列的均值进行相关性分析,得到大脑功能连接(functional connectivity, FC)图,然后利用FisherZ变换将其转换为Z值,最终得到FC强度值。dFC采用Dynamic BC软件分析,通过滑窗法计算,以步长1 TR、窗宽50 s,对每个滑动时间窗口计算每个功能连接的标准差,并对每个连接的平均值进行归一化,从而得到每个连接的变异系数值。将种子点与大脑中所有其他体素的时间序列进行相关,得到大脑dFC 图,然后利用FisherZ变换将其转换为Z值,最终得到个种子点与每个体素dFC 强度值。
1.7 统计学方法
临床资料采用SPSS 26.0 统计软件进行分析。计量资料如年龄、受教育年限、HAMD-24评分、HAMA评分采用均数±标准差(xˉ±s)表示,符合正态分布的资料采用t检验,不符合正态分布的资料采用Mann-WhitneyU检验,计数资料如年龄采用卡方检验,均以P<0.05为差异有统计学意义。
图像数据处理采用DPARSF 6.0 工具包进行分析。两组之间sFC 和dFC 采用t检验进行比较,并将性别、年龄、受教育程度及头动移位作为协变量。采用高斯随机场(Gaussian random fields, GRF)进行多重比较校正,体素水平P<0.005、簇水平P<0.05 认为差异具有统计学意义,最小核团体素个数阈设定为50。此外,采用DPARSF 6.0 软件分别提取两组sFC 和dFC 的差异脑区值,运用SPSS 26.0 进行组间双样本t检验,P<0.05 为差异有统计学意义。为进一步观察异常脑区与临床症状的相关性,将FDE组的临床量表分别与异常脑区的sFC 和dFC 值进行偏相关性分析,并控制性别、年龄、受教育年限及头动移位,以P<0.05为差异有统计学意义。
2 结果
2.1 两组社会人口学资料
FDE组和HCs组在年龄、性别、受教育年限上差异无统计学意义(P>0.05),在HAMD-24、HAMA评分上差异具有统计学意义(P<0.05),见表1。

表1 两组社会人口学资料及临床资料比较Tab.1 Comparison of socio-demographic data and clinical data between the two group
2.2 脑影像学结果
2.2.1 sFC组间差异
与HCs 组相比,FDE 组左侧海马与右侧眶部额中回的sFC 降低,右侧海马与右侧中央前回的sFC 降低,见表2、图1。
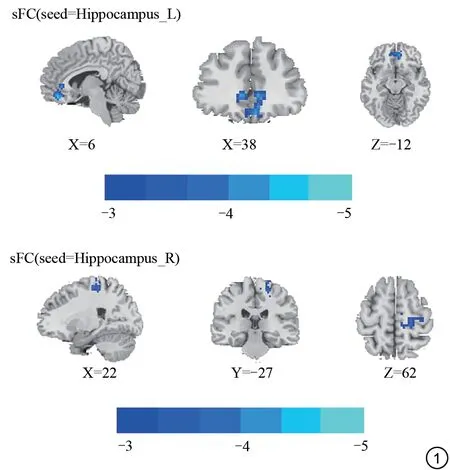
图1 FDE 组和HCs 组sFC 的差异比较,color bar 代表t 值。FDE:首发抑郁症;HCs:健康对照;sFC:静息态功能连接;seed:种子点;Hippocampus:海马。Fig.1 Comparison of differences in sFC between the FDE and HCs groups,color bar indicates t values.FDE: first episode depression; HCs: healthy controls; sFC: dynamic functional connectivity; seed indicate seed point.

表2 FDE组和HCs组sFC的差异比较Tab.2 Comparison of the differences in sFC between FDE and HCs group
2.2.2 dFC组间差异
与HCs 组相比,FDE 组左侧海马与右侧辅助运动区,右侧中央前回的dFC 降低,右侧海马与左侧中央前回的dFC 降低,与右侧枕下回的dFC 升高,见表3、图2。

图2 FDE 组和HCs 组dFC 的差异比较,color bar 代表t 值。FDE:首发抑郁症;HCsW:健康对照;dFC:动态功能连接;seed:种子点;Hippocampus:海马。Fig.2 Comparison of differences in dFC between the FDE and HCs groups, color bar indicates t values.FDE: first episode depression; HCs:healthy controls; dFC: resting-state functional connectivity; seed indicate seed point.
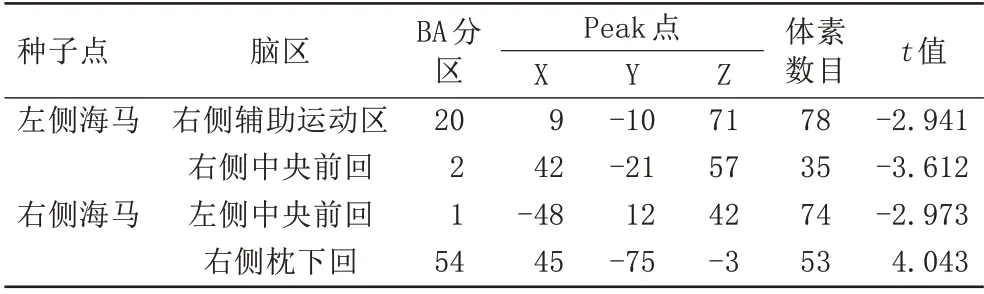
表3 FDE组和HCs组dFC的差异比较Tab.3 Comparison of the differences between the dFC in the FDE and HCs group
2.2.3 验证分析
设置窗宽为30 s、60 s,步长为1 TR 重复试验,验证分析结果与50 s大致一致(表4)。

表4 FDE组和HCs组dFC的验证分析差异比较Tab.4 Comparison of differences in validation analysis of dFC between FDE and HCs group
2.2.4 相关性分析
相关性分析发现,FDE 组右侧海马与右侧枕下回的dFC 值 和HAMD-24 评 分 呈 正 相 关(r=0.474,P=0.015),见图3。
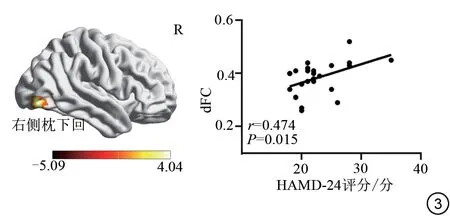
图3 FDE患者相关性分析图。FDE:首发抑郁症;dFC:动态功能连接;HAMD-24:24项汉密尔顿抑郁量表。Fig.3 Correlation analysis graph for FDE patients.FDE: first episode depression; dFC: dynamic functional connectivity; HAMD-24: 24-item Hamilton Rating Scale for Depression.
3 讨论
在本研究中,我们采用静息态和动态FC 方法观察FDE 患者海马的脑功能网络活动异常。结果发现在静息状态下,FDE 患者海马与右侧眶部额中回和右侧中央前回的sFC 存在功能异常。在动态状态下,FDE 患者海马与右侧辅助运动区、双侧中央前回和右侧枕下回的dFC 存在功能异常,且FDE 组右侧海马与右侧枕下回的dFC 值和HAMD 评分呈正相关,这项研究为FDE 患者的海马神经功能网络的神经病理机制提供了新的见解。
3.1 FDE存在左侧海马和奖赏网络之间sFC异常
本研究发现,与HCs组比较,FDE组左侧海马与右侧眶部额中回的sFC 降低。眶部额中回位于眶额皮层(orbital frontal cortex, OFC),OFC不仅对人的社会行为和情绪行为具有重要调节作用,还参与人体的奖赏、决策、目标和动机等行为,是奖赏网络的重要组成部分[15-16]。研究表明[17-18],OFC功能损伤容易引起情绪低落、冷漠、情绪异常和社会功能退缩等症状,这些临床表现与FDE发病密切相关。既往研究发现[19],患有创伤后的MDD 患者存在OFC 和边缘系统之间FC 的功能损伤,这表明其发病机制与恐惧和奖赏系统中的FC 异常改变有关。另一项研究表明[20],与HCs 组比较,家庭冲突引起的青少年MDD 患者左侧海马和双侧OFC 的FC 降低,这表明海马和OFC 的FC 在青少年MDD中扮演着重要调节作用,这可能是未来防治家庭冲突引起的青少年MDD患者的重要靶点,这与本研究结果一致。也有研究表明[21],针灸可以通过增强MDD 患者的海马和奖赏网络之间FC 起到改善抑郁症状的作用。因此,我们推测FDE患者的发病机制可能与左侧海马和OFC之间的FC损伤密切相关。
3.2 FDE存在双侧海马和右侧感觉运动网络之间sFC和dFC异常
此外,我们也发现与HCs组比较,FDE组右侧海马与右侧中央前回的sFC 降低。右侧中央前回位于顶叶,是大脑运动皮层和体感皮层的重要部位,主要参与认知学习、工作记忆和空间想象等功能[22-23]。既往研究表明[24-25],MDD患者存在中央前回的结构和功能异常改变。LIU 等[26]研究发现与没有躯体障碍的MDD 组相比,患有躯体障碍MDD组存在更为严重的抑郁症状,且中央前回和中央后回的低频振幅降低。QIAO等[27]研究表明,焦虑性MDD 患者较HCs 组比较在边缘系统与右侧中央前回的FC 降低。因此,本研究结果提示右侧海马与感觉运动网络的sFC 可能是FDE 的重要神经病理机制。
本研究结果发现与HCs组比较,FDE组左侧海马与右侧补充运动区、右侧中央前回的dFC降低,右侧海马与左侧中央前回的dFC降低。右侧辅助运动区和左/右侧中央前回和小脑均属于感觉运动网络[22]。既往研究表明[28],与HCs组比较,MDD组在左侧背侧壳核和左侧辅助运动区的dFC存在异常的改变,这表明MDD患者存在纹状体感觉运动回路的功能改变。SHUNKAI等[29]研究发现,忧郁型MDD患者的左侧海马和左侧小脑前叶的dFC降低,且左侧海马与左侧小脑前叶的dFC值和MDD的临床症状呈正相关,这提示海马与感觉运动网络的动态功能异常改变可能是FDE患者的神经病理机制之一。
3.3 FDE存在右侧海马和视觉加工皮层dFC异常
本研究结果发现与HCs 组比较,FDE 组右侧海马与右侧枕下回的dFC增高。枕下回位于枕叶,属于视觉加工皮层的一部分,主要参与视觉信息的收集、整合和处理以及情绪的加工[30]。既往研究表明[31],边缘系统中的杏仁核和枕中回的dFC损伤可能是伴有儿童虐待的MDD 患者重要神经病理机制。另一项研究表明[32],右侧前岛叶和右侧枕中回的dFC 是鉴别MDD 和双向障碍患者的重要脑区。因此,海马与视觉加工皮层功能损伤可能是FDE患者的重要神经病理机制。此外,相关性分析发现,FDE组右侧海马与右侧枕下回的dFC 值和HAMD-24 评分呈正相关,这表明右侧海马与右侧枕下回的dFC是FDE患者的重要神经影像标记。
3.4 本研究的局限性
本研究还存在一定不足之处。首先,本研究样本量较少,未来应开展多中心、大样本的临床研究以进一步验证本研究结果。第二,本研究采用横断面进行研究,未来可进一步观察纵向的海马sFC 和dFC特征变化,并可采用机器学习方法进一步筛选与FDE患者相关的神经影像标记。第三,本研究患者年龄跨度较大,因此在未来研究中可进一步筛选不同年龄段患者的海马sFC和dFC差异变化。
4 结论
综上所述,本研究基于fMRI 技术,观察FDE 患者的双侧海马sFC和dFC改变特征。结果发现FDE患者双侧海马与奖赏网络、感觉运动网络的sFC存在异常改变,与感觉运动网络和视觉加工皮层的dFC存在异常改变,这为理解FDE患者的神经病理机制及靶向治疗提供一定借鉴意义。
作者利益冲突声明:全体作者均声明无利益冲突。
作者贡献声明:王小玲设计本研究的方案,对稿件重要的内容进行了修改,获得了国家自然科学基金和中国中医科学院科技创新工程项目的资助;曹久冬起草和撰写稿件,获取、分析或解释本研究的数据;张磊、洪洋、张国雷、包岩、罗萍、孙黎、韩铭、吕学玉、刘军、姚晓燕、李珊珊、孙继飞、方继良获取、分析或解释本研究的数据,对稿件重要的内容进行了修改;全部作者都同意发表最后的修改稿,同意对本研究的所有方面负责,确保本研究的准确性和诚信。

