水产品中致病与腐败菌的群体感应抑制剂研究进展
檀茜倩,裴建博,崔方超,李秋莹,吕欣然,孙 彤,励建荣,*
(1.渤海大学食品科学与工程学院,辽宁 锦州 121013;2.渤海大学海洋研究院,辽宁 锦州 121013;3.天津科技大学食品科学与工程学院,天津 300457)
水产品营养丰富,含有蛋白质、必需氨基酸、生物活性肽、多不饱和脂肪酸、维生素和矿物质等多种营养物质。但消费者食用水产品也会面临一些潜在风险,主要包括物理因素(夹杂异物)、化学因素(重金属、鱼药残留、生物毒素)以及生物因素(细菌、病毒、寄生虫)[1-2]等。其中生物因素对消费者健康和渔业经济影响更大。致病菌(副溶血弧菌、金黄色葡萄球菌、大肠埃希氏菌等)以及腐败菌(假单胞菌、希瓦氏菌等)的存在可能引发食源性疾病或水产品腐败变质[3],影响消费者身体健康,同时也会造成一定浪费和经济损失。因此如何保证水产品新鲜度以及微生物安全性是目前非常值得关注的问题[4-5]。
研究发现,细菌的某些生物行为受到信号系统的调控[6],群体感应(quorum sensing,QS)系统就是其中之一。细菌的QS系统是指细菌通过感知信号分子(也叫做自诱导物(autoinducers,AIs))的浓度来实现菌群内部和菌间的交流以及调控多种毒力行为的产生[7-8]。而以细菌QS系统为靶点的群体感应抑制剂(quorum sensing inhibitors,QSIs)可以起到阻断或干扰QS系统的作用,且QSIs对细菌生长的影响较小,与抗生素等物质对细菌的抑制机制不同,因此使用QSIs抑制细菌QS系统毒力因子的产生,不仅能够保证水产品食用的新鲜度和微生物安全性[9],也可以在一定程度上抑制细菌耐药性形成[9]。为了更全面了解QSIs对水产品中细菌的控制作用,本文概述水产品中常见的几种致病和腐败菌QS系统的类型及其对毒力因子的调控方式,着重介绍目前天然来源(微生物源、植物源、动物源)以及人工合成QSIs的研究进展,为水产品保鲜和安全控制技术开发提供参考。
1 细菌群体感应系统概述
在细菌QS系统中,AIs对细菌的基因表达和毒力因子产生的调控起到了非常重要的作用[10]。常见的AIs主要分为三大类(表1):第一类为高丝氨酸内酯(homoserine lactone,HSL)类(AI-1),主要存在于革兰氏阴性细菌(G-)中[11],其结构因合成酶不同而有所差异,以N-酰基-高丝氨酸内酯类(N-acyl-homoserine lactones,AHLs)最常见,其由S-腺苷甲硫氨酸(S-adenosylmethionine,SAM)通过LuxI合成酶产生,4~16 个C组成的脂肪酰链通过酰胺键连接到内酯化的高丝氨酸上,通过与LuxR受体结合开启全局调控[12];第二类为自诱导肽(autoinducing peptides,AIPs),主要存在于革兰氏阳性细菌(G+)中,一般包含5~17 个氨基酸,AIPs由G+菌核糖体合成并完成对自身稳定和功能的修饰后,通过ABC转运蛋白运输到环境中,当环境中AIPs浓度超过一定阈值时会引起细菌基因表达改变并引发相应生物行为[13];第三类是AI-2,在G-和G+菌中均有存在,被认为是细菌种间交流的一种通用信号,S-腺苷高半胱氨酸(S-adenosyl-homocystein,SAH)在S-腺苷高半胱氨酸核苷酸酶和LuxS酶的作用下转化成高半胱氨酸和4,5-二羟基-2,3-戊二酮(4,5-dihydroxy-2,3-pentanedione,DPD),再经DPD自发环化形成呋喃酮类化合物[14]。

表1 常见AIs类型Table 1 Types of common autoinducers (AIs)
2 水产品中常见致病和腐败菌的群体感应系统类型
水产品中常见致病菌有金黄色葡萄球菌(Staphylococcus aureus)、单核细胞增生李斯特菌(Listeria monocytogenes)、铜绿假单胞菌(Pseudomonas aeruginosa)、弧菌等。在G+菌中,S.aureus主要存在于冷冻水产品,其QS系统调控生物被膜和毒力因子的过程需要辅助基因调节(accessory gene regulator,Agr)系统参与,其中Agr系统中的agrB和agrD基因编码跨膜蛋白和AgrD前肽,AgrB蛋白参与AgrD转化为AIP并释放的过程,agrC和agrA基因则用来编码感应激酶和对AgrC/AgrA两组分系统做出应答调控[15]。另一种常见的G+食源性细菌L.monocytogenes的QS系统与S.aureus类似,虽然L.monocytogenes基因组中已被证实包含与AI-2有关的pfs和luxS基因,但后续研究发现AI-2并不是L.monocytogenes的AIs,L.monocytogenes的基因组中不含与诱导、跨膜蛋白和双组分系统相关的comX、comQ和comP/comA基因,agrD基因比agrA基因对L.monocytogenes致病和生物被膜形成等毒力行为的影响更大[16]。
在G-菌中,P.aeruginosa已经被证实包含4 种QS系统:LasI/LasR系统、RhlI/RhlR系统、PqsR参与的喹诺酮(Pseudomonasquinolone signal,PQS)系统以及在低磷酸盐条件下起作用的2-(2-羟基苯基)-噻唑-4-甲醛(2-(2-hydroxyphenyl)-thiazole-4-carbaldehyde,IQS)系统[17],这4 个系统通过一系列的级联反应实现对细菌毒力行为的调控。其中LasR位于级联反应上游,可与特定AHLs结合,激活下游包括lasI、rhlI/R、pqsR和pqsABCDE在内的大量基因表达[18]。副溶血弧菌(Vibrio parahaemolyticus)是另一种水产中比较常见G-弧菌,常污染牡蛎等贝类,未经煮熟食用可引起胃肠炎和败血症等疾病,其为AI-2型QS系统,低AIs浓度可促进V.parahaemolyticus中aphA基因的表达进而促进其III型分泌系统(type III secretion system,T3SS)分泌毒素,高AIs浓度时AI-2可与受体蛋白OpaR结合抑制T3SS1中转录激活蛋白ExsA的活性,降低V.parahaemolyticus生物被膜的形成、运动能力和毒素的分泌[19-20];哈维弧菌(Vibrio harveyi)同属AI-2型QS系统[21]。
水产中的腐败菌以G-菌居多,包括荧光假单胞菌(Pseudomonas fluorescens)在内的多种假单胞菌、希瓦氏菌(Shewanella)和蜂房哈夫尼菌(Hafnia alvei)等。其中P.fluorescens主要为AHLs型QS系统,已发现LuxI/LuxR以及Pcol/PcoR两种类型[22]。Shewanella是鱼和虾等水产品冷藏过程中的特定腐败菌[23],其QS系统主要包含AI-1和AI-2两种信号分子,其产生的二酮哌嗪类(diketopiperazines,DKPs)化合物可与LuxR结合通过上调torT和trxB基因表达增强致腐能力[24-25]。H.alvei则经常引起真空包装水产品的腐败,并对低温有较强适应性,目前研究认为H.alvei为AHLs型QS系统,已发现其产生的AHLs信号分子类型有N-己酰-高丝氨酸内酯(N-hexanoyl-homoserine lactone,C6-HSL)、N-氧代辛酰-高丝氨酸内酯(N-octanoyl-homoserine lactone,OC8-HSL)[26]、N-丁酰-高丝氨酸内酯(N-butyryl-homoserine lactone,C4-HSL)[27]等。
3 群体感应抑制剂概述
QSIs可以通过阻断或干预QS系统抑制细菌毒力因子产生(图1)。QSIs的作用机制主要包括以下几种方式:抑制信号分子合成;酶解或清除信号分子;与信号分子竞争性结合受体位点;通过干扰信号分子和基因启动子结合影响基因表达等[28-31]。QSIs筛选需满足以下几个原则:第一,候选QSIs可有效降低QS相关基因表达;第二,候选QSIs与相应QS调控因子具有专一对应性并在使用后不具有副作用;第三,候选QSIs有很好的化学稳定性,不会被宿主细胞代谢活动降解[32]。QSIs根据其来源可分为天然来源抑制剂和人工合成抑制剂。天然来源抑制剂主要来自微生物代谢物、植物提取物和动物等。人工合成抑制剂从偶然发现到高通量筛选主要是根据QSIs的特点,基于经验、半经验方法有目的地对前体化合物进行改造和合成。目前QSIs筛选常用的报告菌株有根癌农杆菌A136、紫色杆菌CV026或12472、P.aeruginosaqsc 119等(对AHLs信号分子产生响应)[33-34],V.harveyiBB120或JMH612(对AI2或AHL类信号分子产生响应)[35],含有绿色荧光蛋白表达质粒的大肠杆菌等[36]。

图1 QSIs对细菌QS系统作用示意图Fig.1 Schematic diagram of action of QSIs against bacterial QS system
4 天然来源的群体感应抑制剂
天然来源的QSIs主要包括三大类:微生物源、植物源和动物源。
4.1 微生物源群体感应抑制剂
细菌素是一类对细菌有抑制作用的多肽,其抑菌谱和抑菌机理一直被广泛研究[37],目前研究发现部分细菌素可作为某些水产品致病和腐败菌的QSIs,通过影响QS信号分子活性或作为信号分子类似物竞争性与QS受体结合达到抑制细菌QS通路的目的。例如乳杆菌素AL705(由弯曲乳杆菌产生)可抑制AI-2信号分子的活性,并影响L.monocytogenes生物被膜的形成[38];豆素(分子质量为484 Da,由芽孢杆菌BR4产生)可作为PQS信号分子类似物,因其与PqsR上的4 个氨基酸残基结合能力较强,所以可竞争性地与PqsR结合,因此可抑制P.aeruginosaQS系统调控的生物被膜的形成以及胞外蛋白产生[39]。
另一类微生物源群体感应抑制剂为具有群体感应淬灭(quorum quenching,QQ)作用的酶类。QQ酶最早在芽孢杆菌中发现,包括内酯酶、酰基转移酶、氧化还原酶和对氧磷酯酶等[40]。芽孢杆菌中比较有代表性的QQ酶为内酯酶,例如在地衣芽孢杆菌T-1中发现的由ytnp编码的AHLs内酯酶[41],这种酶可裂解AHLs分子的高丝氨酸内酯环,抑制其与靶转录调节剂结合,通过减弱AHLs有效性来干扰QS系统[42];另外,芽孢杆菌属也能够产生AHLs酰化酶或氧化还原酶,可部分或完全降解AHLs信号分子[43]。乳酸菌中也发现多种QQ酶,本团队在乳杆菌ZHG2-1[44]和植物乳杆菌CY1-1[45]中发现可能存在AHLs内酯酶或者酰化酶,前者通过抑制LasI/R和RhlI/R蛋白合成基因的表达抑制QS系统,后者通过降解AHLs信号分子抑制QS过程。分泌QQ酶的微生物、QQ酶种类及作用机制还有待于进一步挖掘和研究。
除了细菌素和QQ酶,从微生物中也分离到了可作为QSIs的其他代谢物。枯草芽孢杆菌R-18(从植物根系中分离)的代谢产物2,4-二叔丁基苯酚是AHLs信号分子类似物,可通过阻止AHLs与其受体结合来抑制QS通路[46]。链霉菌(从鱿鱼中分离)提取物也可抑制紫色杆菌MTCC2656紫色素产生[47]。微生物代谢物的组成受到微生物培养条件(碳源、氮源和矿物质)的影响,因此也是在对微生物源QSIs获取和研究中需要考虑的因素。另外,现有研究虽证实某些微生物代谢物可作为潜在QSIs,但是其作用机制还有待于进一步研究。
4.2 植物源群体感应抑制剂
植物来源的QSIs主要包括植物提取物、精油以及从其中分离的各种单体。植物提取物和精油一直以来被认为具有抑菌功能。植物来源QSIs的抑制机制主要包括两种:一是干扰信号分子与受体结合,因为部分植物提取物的化学结构与某些AIs类似,可与AIs竞争性与受体结合影响QS过程;第二种是通过影响AIs的合成来起到干扰QS的作用。和其他来源的QSIs相比,植物来源QSIs应用相对广泛,可对多种QS系统起到抑制作用[48]。
小蘖碱(黄连素)是一种异喹啉生物碱,为广谱抗菌药物,其对病毒、真菌、和各类细菌(尤其是一些耐药菌株)都有抑制作用,它还可抑制多种细菌的QS系统,显示出相对广谱的QS抑制能力。小蘖碱在质量浓度为1.6 mg/mL时可抑制紫色杆菌12472以及CV026产生紫色素以及P.aeruginosa生物被膜的形成,通过分子对接和同源建模发现其对P.aeruginosaQS系统的干扰是由于可与信号分子竞争性地同受体LasR和RhlR结合[30]。另有研究表明,在1/2最小抑菌质量浓度(0.64 mg/mL)下,小蘖碱可以抑制耐药性大肠杆菌生物被膜的形成,通过激光扫描共聚焦显微镜发现在该浓度下小蘖碱对生物被膜的抑制作用明显,细胞形状发生改变,产生溶胀和伸长现象,说明其对生物被膜产生比较大的破坏;实时荧光定量聚合酶链式反应实验结果显示在1/2最小抑菌质量浓度(0.64 mg/m L)和1/4 最小抑菌质量浓度(0.3 2 m g/m L)下,小蘖碱可显著下调大肠杆菌AI-2 QS系统相关基因(luxS、pfS基因、与luxR基因功能相似的sdiA基因、参与细胞分化的hflX基因、鞭毛驱动合成基因fliA基因以及此基因控制的操纵子motA基因)的表达[49];研究还发现苦参碱也具有与小蘖碱类似的QS抑制效果,但是在对QS抑制浓度和相关基因的干扰上存在一些差别,说明不同中药单体对同种细菌的QS抑制能力不同;小蘖碱也可抑制表皮葡萄球菌生物被膜的形成,推测其与干扰表皮葡萄球菌QS系统有关,但是具体的机制还未得到证实[50-51]。
姜黄素是从姜黄中提取的一种生物活性物质,其核心结构带有2 个芳香环和7 个C碳链二芳基庚烷,可抑制在C6-HSL信号分子存在下的紫色杆菌CV026和在C8-HSL存在下的根癌农杆菌色素的产生[52],也可以抑制V.harveyi在QS系统调控作用下的生物发光行为,对弧菌属生物被膜形成的抑制作用明显,在质量浓度为100 μg/mL时对V.harveyi、V.parahaemolyticus、创伤弧菌生物被膜形成的抑制率分别为69%、56%和79%;姜黄素处理上述弧菌成熟生物被膜,会使生物被膜的厚度变薄并呈现出不完整状态;并且分泌胞外多糖、阮藻酸盐以及群集和泳动等QS调控的毒力行为产生也明显降低[53]。除了对弧菌属QS的抑制作用,姜黄素还可以通过与LuxI型的AHLs合成酶结合干扰温和气单胞菌QS系统[52],通过影响AHLs合成酶ahlI基因以及AHL结合受体合成酶ahyR基因的表达干扰嗜水气单胞菌的QS系统等[54]。
研究发现,与其他化学和物理方法协同作用可增强植物源QSIs的QS抑制能力,例如在光催化条件下,姜黄素可使得P.aeruginosa的lasI/R和rhlI/R基因发生明显下调[55],对其生物被膜的抑制效果相比姜黄素单独作用显著增强,因此也可作为植物源QSIs应用发展的一个方向。
4.3 动物源群体感应抑制剂
动物细胞和组织中也有部分QSIs存在。当真核宿主被一些具有QS系统的病原菌侵染后,会对不同AIs产生响应,产生可分解AIs的代谢物。Maurice等[56]发现P.aeruginosa感染肺上皮细胞的线粒体后,其会分泌去乙酰化酶1(sirtuin 1,SIRT1)和磷酸腺苷依赖性激酶(AMP-dependent kinase,AMPK)来减弱P.aeruginosa信号分子3-oxo-C12-HSL对线粒体的影响,因此这两种酶具有潜在QSIs功能。另有研究表明,碎牛肉提取物可抑制AI-2信号分子的活性,抑制大肠杆菌O157:H7的生长以及其yadK和hhA基因的表达[57]。驴初乳中分离的多聚己糖可显著抑制紫色杆菌12472紫色素产生,也可以抑制S.aureus溶血素、蛋白酶和脂肪酶等毒力因子的产生和生物被膜的形成,并且同时具有降解C4-HSL和C12-HSL两种信号分子的功能[58]。一种南非的蜂胶也可作为潜在QSIs,其中所含的黄酮类物质乔松素、高良姜素和白杨素,比香草醛对紫色杆菌12472产紫色素的抑制率高,且3 种物质综合的效果大于单一作用效果,可同时抑制G+L.monocytogenes、G-大肠杆菌和真菌中的白色念珠球菌的生物被膜形成,表现出广谱的抑菌活性和抗QS特性,丰年虾急性毒性实验证实其无毒,在水产品工业上具有潜在的应用价值[57];另外一种从蜜蜂毒液中分离的蜂毒肽也具有抑制S.aureus、大肠杆菌和P.aeruginosa的生物被膜形成的功能,但是其活性成分以及作用机制还有待于进一步评估[59]。
有代表性的不同天然来源QSIs及其对QS系统的主要影响见表2。

表2 常见天然来源QSIsTable 2 Common natural QSIs
5 人工合成群体感应抑制剂
5.1 群体感应淬灭酶的设计合成
因为天然QQ酶具有分离困难、产量低等不利因素,使其工业应用受到限制,目前研究可考虑通过生物工程的方法根据已经报道的QQ酶基因合成QQ酶(图2)。本团队通过对P.fluorescens的基因序列分析,利用pET28a载体在大肠杆菌DE3中成功表达了具有AHLs淬灭活性的QQ酶PF2571和PF1240,PF2571能够抑制维氏气单胞菌BY-8中包括生物被膜、蛋白酶、脂肪酶、藻朊酸盐等QS调控的毒力因子的形成,并有效控制鲷鱼的腐败[62];PF1240与AHLs酰基转移酶的结构相似,能够分解不同长度碳链的多种AHLs,可抑制H.alvei菌生物被膜、蛋白酶和脂肪酶的产生及其泳动能力[63]。另有报道成功对从健康虾中分离的Ruegeria mobilisYJ3菌株的胞外群体感应淬灭酶RmmL序列在体外进行了克隆表达,其可以降解长链的C12-HSL信号分子,能够抑制P.aeruginosa产生绿脓菌素,同时RmmL被认为可以作为水产的治疗药剂[64]。

图2 异源表达QQ酶流程示意图Fig.2 Schematic diagram of heterogenous expression of quorum quenching enzyme
5.2 新型QSIs的设计和有机合成
除了采用生物工程的方法,在已有经验的基础上,QSIs可通过骨架跃迁的方法(即从已知活性的化合物出发,通过改变其核心结构,得到新的具有相似活性的化合物)设计合成,其QS抑制效果可以利用分子对接实验初步证实(图3)。一种策略是根据不同类型AIs结构设计相关类似物,这种类似物可与AIs竞争性与其对应受体结合,进而影响毒力基因表达。例如可以通过改变AHLs的内酯环以及对其酰胺基和脂肪链进行一定化学修饰合成新QSIs[31],其中内酯环可用噻唑、二氢噻唑、苯并咪唑、吡啶和咪唑啉等杂环代替,一般来说氨基酸基团和侧链可相对保持不变,而侧链基团的长度可进行一定调整。研究发现采用此种策略合成的大部分AHLs类似物都具有抑制AHLs型QS系统的功能,分子对接模拟结果显示这些类似物与紫色杆菌CviR受体的结合能力大于天然AHLs信号分子。这种合成策略需要根据目标AIs特点选择合适的先导化合物作为核心结构,同时对其他基团进行有针对性地修饰[65]。另一种策略是利用已知结构的QSIs来设计和合成具有类似结构的新型QSIs。有研究合成了与对P.aeruginosa毒力因子有抑制作用的5-硝基咪唑类甲硝唑这种类型的QSIs结构类似的一系列塞克硝唑化合物,并证实了这类化合物可同时下调群体感应信号分子合成酶基因lasI、rhlI、pqsA和信号分子受体lasR、rhlR和pqsR基因的表达,从而抑制P.aeruginosa毒力因子产生[66]。
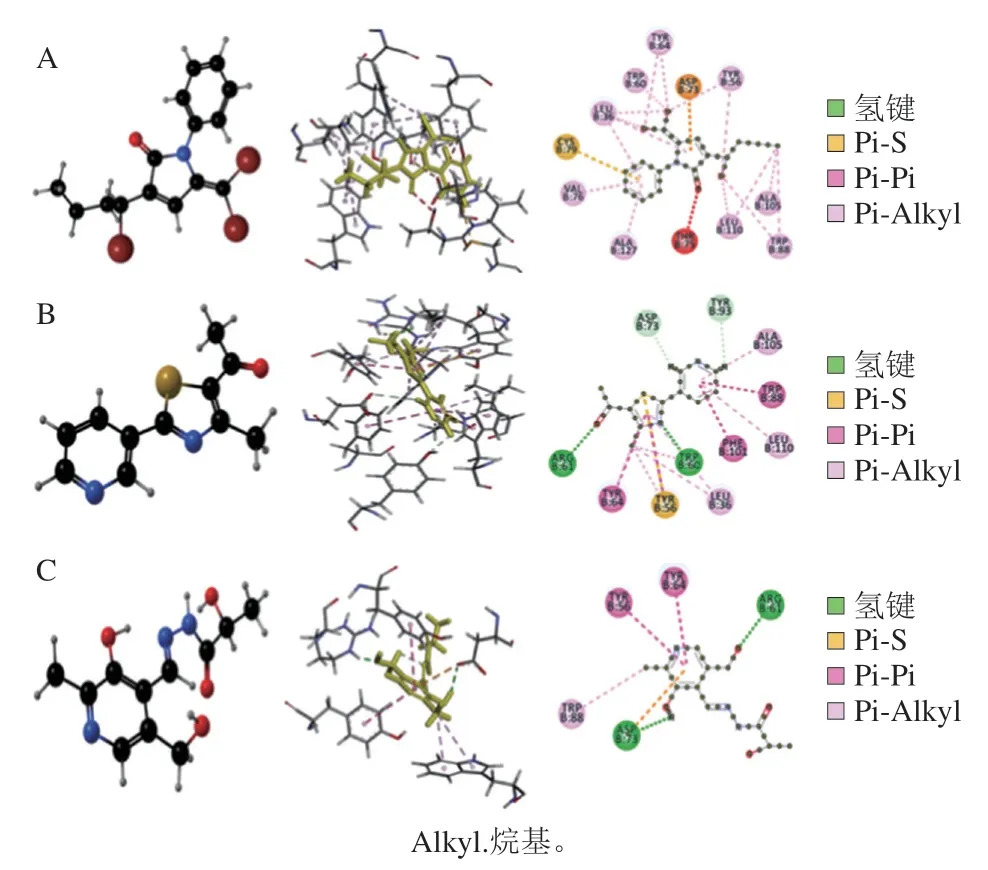
图3 1,5-二氢吡咯-2-酮(A)[9]、5-乙酰基-4-甲基-2-(3-吡啶)噻唑(B)[67]、吡哆醛乳腙(C)[68]与LasR蛋白模型分子对接结果示意图Fig.3 Schematic diagram of the molecular docking of 1,5-dihydropyrrol-2-ones (A)[9],5-acetyl-4-methyl-2-(3-pyridyl) thiazole (B)[67]and pyridoxal lactohydrazone (C)[68] with the LasR protein model
除了依据经验对QSIs进行设计合成,基于计算方法的大规模筛选也被应用在QSIs的设计和开发中。Grossman等[69]从诺丁汉化合物数据库(包含85 000 种不同的化合物)筛选出结构内核与PQS和2-庚基-4-喹啉酮(2-heptylquinolin-4(1H)-one,HHQ)的内部配体具有一定相似性的喹唑啉酮骨架化合物,可以作为PasR的拮抗物进而干扰QS过程。在虚拟筛选过程中,首先需要选择适合的数据库,目前常用的化合物公共数据库有Pubchem(小分子信息)、Drugbank(常见药物信息)、中药资源的数据库TCM(中药信息)等,同时也可以根据经验建立有针对性的化合物数据库以应用于QSIs的虚拟筛选。
5.3 纳米颗粒QSIs的设计和合成
纳米颗粒是一类尺寸1~100 nm、形状多样、具有特殊化学和物理特性的物质,已经应用在包括诊疗、催化、药物递送、传感等诸多领域,同时其也可作为抗菌剂,对很多耐药菌有很好的抑制作用。现研究发现一部分纳米颗粒可作为QSIs,对QS的抑制效果取决于纳米颗粒的类型、合成方法以及作用浓度大小等[70]。
银纳米颗粒(silver nanoparticles,AgNPs)是目前研究较多的一类纳米颗粒,对多种QS系统都有抑制作用。AgNPs对QS系统的抑制机制主要由于AgNPs具有破坏细胞膜(尤其是肽聚糖层)、破坏细菌的呼吸链(呼吸链酶ATPase)、干扰DNA的复制、产生活性氧(reactive oxygen species,ROS)等作用,而这些作用会对细菌QS系统产生干扰。以AgNPs对P.aeruginosaPAO1的QS系统影响为例,首先AgNPs引发的DNA损伤和ROS产生会激活编码σ因子的rpoS基因的上调表达,而RpoS(σ因子)能激活细胞对DNA损伤和ROS的保护作用,并可同时激活RsmA表达,在RpoS和RsmA的联合作用下,rhl和las家族的基因表达受到抑制并随后影响到下游QS相关基因表达[71]。
AgNPs的合成方法很多,采用植物提取物或微生物代谢物对AgNPs进行绿色合成因为方法简单、安全以及对环境污染小近年来受到很多关注[72](图4)。植物或微生物提取物在AgNPs的合成过程中既可以作为还原剂,也具有稳定AgNPs的作用。有研究利用大花紫薇叶的水提取物合成的AgNPs可成功抑制P.aeruginosa生物被膜形成[73];采用印度藏茴香种子的水提取物合成的AgNPs在质量浓度为1、2、3 μg/mL和4 μg/mL时能使紫色杆菌12472产紫色素能力分别下降34.2%、47.0%、65.6%和74.7%,在质量浓度为1~15 μg/mL时可在不同程度抑制P.aeruginosa绿脓菌素、鼠李糖脂和弹性蛋白酶以及黏质沙雷氏灵杆菌素的产生[74];采用真菌(烟草内生菌)提取物合成的AgNPs可以显著抑制两种P.aeruginosa的泳动能力、绿脓菌素和胞外多糖的产生以及生物被膜的形成[72]。
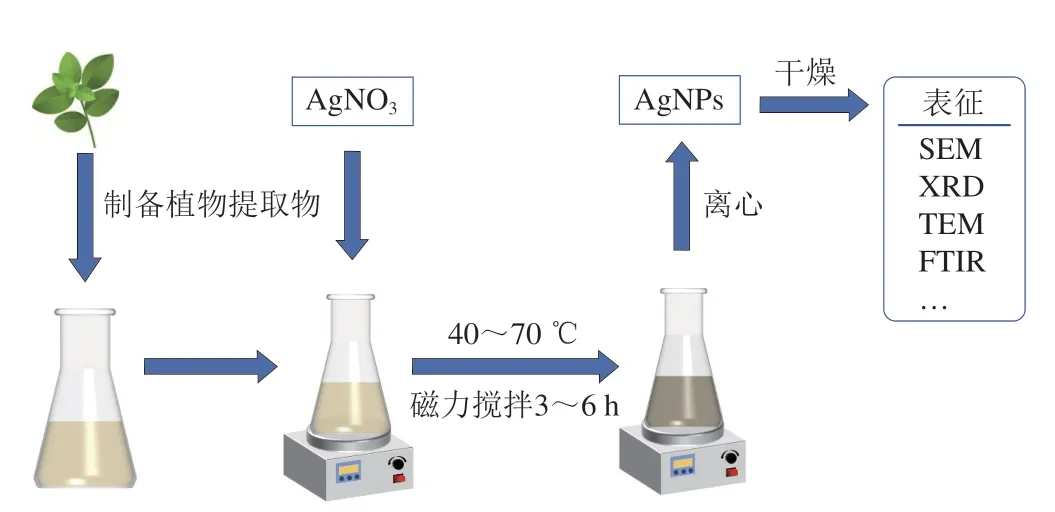
图4 利用植物提取物合成AgNPs的流程图Fig.4 Schematic diagram of plant extract-mediated silver nanoparticles synthesis
纳米颗粒作为QSIs的效果受到颗粒大小的影响。研究发现虽然球形纳米银颗粒(粒径<20 nm)和银纳米棒(直径在100~200 nm之间,长度为5~10 μm)都可下调编码LasA蛋白酶、LasB弹性蛋白酶、铁载体等QS相关毒力基因表达,但是相对于纳米棒,纳米颗粒可以在较低的浓度下起到QS抑制作用,这可能是由于其比表面积大,更容易穿透细胞膜引起氧化和DNA损伤[71]。不同类型的纳米颗粒对QS的抑制机制也不尽相同。对于AHL型QS系统来说,ZnO纳米颗粒、TiO2纳米颗粒、AgNPs都具有抑制紫色杆菌QS的能力,但是TiO2纳米颗粒与AgNPs主要影响信号分子的合成,而ZnO纳米颗粒则通过破坏对信号分子的识别和响应来干扰QS系统[75]。
在实际应用过程中纳米颗粒胶体具有不稳定和容易聚集的缺点,会对其QS抑制能力造成影响。为了解决这个问题,常将纳米颗粒负载到一个可起到支撑作用的基质上,基质一般选择带有羟基、羰基、羧基和环氧基等官能团的物质(壳聚糖就是一种经常采用的纳米颗粒负载基质),所形成的纳米复合材料和复合纳米颗粒可增强QSIs对QS的抑制功能[76]。纳米颗粒本身也可以作为载体负载某些水溶性和生物利用度不好的生物活性物质来提高其QS抑制能力,以增强其在水产品保鲜和包装中的应用潜力。Ilk等[77]研究发现壳聚糖-山柰酚复合纳米颗粒可以显著提高山柰酚QS抑制作用并且其抑制作用可在较长的一段时间(30 d)得到保持;Subhaswaraj等[78]合成了壳聚糖-肉桂醛纳米颗粒,并发现其在1 mg/mL质量浓度下可通过干扰P.aeruginosa的LasI/R和RhlI/R系统来抑制生物被膜的形成以及群集和泳动能力;Ibrahim等[79]合成了膳食壳聚糖槲皮素纳米颗粒,其可以显著下调气单胞菌QS相关ahyI和ahyR基因的表达,以达到抑制罗非鱼体内的气单胞菌QS系统的目的,并且这种纳米颗粒可作为补充剂添加到罗非鱼饲料当中,扩大了QSIs的应用范围。
6 结语
QSIs在针对水产品常见致病和腐败菌的控制方面具有一定优势,但仍有很多可作为QSIs不同来源的天然抑菌剂有待开发。另外,虽然一些抗菌物质(包括一些植物和微生物的提取物)被证实具有QS抑制作用,可以作为潜在QSIs,但其对QS抑制的主要功能成分以及结构还有待挖掘,QS抑制机制也需要深入研究。组学技术的发展为研究QSIs的抑制机制提供了辅助支持,未来研究可结合转录组学、蛋白质组学和代谢组学等组学技术,多维度解析QSIs的抑制机制。此外,除了现有QSIs筛选报告系统,可以考虑开发灵敏度和准确性更高的QS报告和检测系统,同时辅助基于计算的筛选技术,提高QSIs筛选效率。由于QS系统的复杂性,QSIs的抑制作用有一定的特异性(针对特定菌属或者某一类QS系统),未来可以考虑基于天然产物筛选或通过人工设计开发具有更广泛抑制功能的QSIs,同时QSIs安全性也需要采用合理的方法进行评估,以实现其在水产品鲜度和微生物安全控制方面的应用。

