宰后成熟过程中脂多糖诱导剂对滩羊肌细胞线粒体凋亡信号通路的影响
李 荣,罗瑞明,杜 瑞,罗玉龙,*,王金霞,张 倩,陈雪妍
(1.宁夏大学食品科学与工程学院,宁夏 银川 750021;2.银川市农产品质量检测中心,宁夏 银川 750000)
线粒体作为细胞凋亡的中枢调控者,参与调控细胞氧化还原状态变化过程和能量供应,同时对肌细胞凋亡进程起着极其重要的调控作用[1-2]。宰后肌肉组织与外界切断联系,缺氧缺血等变化导致细胞发生一系列生理生化反应[3],ATP耗竭使细胞从有氧呼吸转变为无氧糖酵解,活性氧(reactive oxygen species,ROS)介导的氧化应激等使线粒体膜通透性转换孔(mitochondrial permeability transition pore,MPTP)构象发生改变,导致线粒体内促凋亡因子线粒体细胞色素c(cytochrome c,Cyt-c)、凋亡诱导因子(apoptosis-inducing factor,AIF)等大量释放,最终引发细胞凋亡级联反应[4]。可通过线粒体能量变化、氧化应激水平、标志酶以及凋亡因子释放情况等指标来表征凋亡对线粒体的影响。
脂多糖(lipopolysaccharide,LPS)是革兰氏阴性菌外膜的主要成分,可以和TLR4基因编码的跨膜蛋白Toll样受体4(Toll-like receptor 4,TLR4)结合。LPS诱导细胞凋亡通过TLR4激活核因子κB(nuclear factor kappa-B,NF-κB),激活后的NF-κB诱导产生促炎症细胞因子从而介导炎症基因和BCL-2家族的蛋白通过激活半胱氨酸蛋白酶(cysteinyl aspartate specific proteinase,Caspase)活性来参与细胞凋亡过程[5]。张钊等[6]发现LPS刺激可以改变线粒体的形态,导致细胞线粒体膜电位下降,促进ROS的产生,诱导细胞凋亡。Gogvadze等[7]的研究表明从线粒体内膜释放的各种促凋亡蛋白在胞浆中介导细胞凋亡发生,即线粒体对调控细胞凋亡的发生有着至关重要的作用。McIlwain等[8]发现给予一定剂量的LPS会引起Caspase-3的激活,LPS被认为能够参与细胞凋亡的主要执行者——Caspase3的活化;张永波[9]的研究表明LPS可以通过氧化应激损伤的途径使细胞发生凋亡,具有诱导细胞凋亡的能力。Ji Yinglei等[10]使用LPS处理大鼠细胞,发现其显著上调了Caspases-12和Caspases-3蛋白的表达,表明LPS可能以剂量和时间依赖性的方式导致细胞活力降低和细胞凋亡率增加。以上研究结果均表明,LPS可诱导细胞凋亡的发生,但对于LPS诱导细胞凋亡对线粒体凋亡通路的影响鲜有研究。
本实验以滩羊背最长肌为研究对象,通过LPS诱导凋亡,测定其在4 ℃成熟0、6、12、24、72 h过程中滩羊肉细胞凋亡率、凋亡酶活力、线粒体ATP含量、琥珀酸脱氢酶(succinatedehydrogenase,SDH)和柠檬酸合酶(citrate synthase,CS)活力,采用酶联免疫吸附测试(enzyme-linked immunosorbent assay,ELISA)试剂盒测定Bcl-2家族蛋白含量,采用Western blot法测定细胞凋亡因子Cyt-c和Caspase-3的表达量,以此阐释滩羊肉成熟过程中LPS诱导凋亡与线粒体凋亡途径的关系,以期为后续揭示LPS诱导凋亡的机制提供思路,并为冷却滩羊肉贮藏期间肉品质量控制技术研发提供一定的理论参考。
1 材料与方法
1.1 材料与试剂
9 只胴体质量相近的6 月龄公滩羊购自宁夏盐池县宁鑫肉业有限公司。
LPS、甘露醇、4-丙磺酸基吗琳、牛血清白蛋白、乙二胺四乙酸、4-羟乙基哌嗪乙磺酸 北京索莱宝生物科技有限公司;Arsenazo III 美国MCE公司;TUNEL凋亡检测试剂盒 江苏凯基生物科技发展有限公司;总蛋白定量测定试剂盒、ATP含量测定试剂盒、SDH活力检测试剂盒、CS活力检测试剂盒、Caspase-3活力检测试剂盒、Caspase-9活力检测试剂盒 南京建成生物工程研究所;双花扁豆凝集素(dolichos bifows agglutinin,DBA)试剂盒 上海康郎生物科技有限公司;绵羊Bax ELISA试剂盒、绵羊Bcl-2 ELISA试剂盒 武汉新启迪生物科技有限公司;Anti-Cytochrome c抗体、Anti-Caspase-3抗体 美国Abcam公司。
1.2 仪器与设备
752N紫外分光光度计 上海仪电科学仪器股份有限公司;HZB-12/A家用制冰机 宁波惠康国际工业有限公司;TGL-16D冷冻高速离心机 常州中捷实验仪器制造有限公司;JX-CL冷冻研磨仪 上海净信实验设备有限公司;HHS-21-6电热恒温水浴锅 上海四蓝仪器设备有限公司;EL×800酶标仪 美国BioTek公司;WIXEP300垂直电泳仪 韦克斯科技(北京)有限公司;SH-100凝胶图像分析仪 上海四星生物技术公司。
1.3 方法
1.3.1 样品采集
宰前遵循动物管理规定,屠宰后立即用灭菌刀取下右侧背最长肌,剔除可见脂肪与结缔组织后,分割成100 g左右肉样,快速存入液氮作0 h样品。剩下的肉样切成100 g左右大小一致的肉块,随机分为2 组,第1组不作处理,为空白对照组,第二组注射30 mg/L LPS溶液(肉样和处理液的质量体积比为1∶1),装入密闭自封袋,在4 ℃条件下分别成熟0、6、12、24、72 h,并在对应时间节点测定pH值等指标,对凋亡酶活性和凋亡因子表达量等不便立即测定的指标,在相应的时间节点上取样,用液氮快速冻结,放入-80 ℃冷冻待测。
1.3.2 pH值测定
剔除样品可见脂肪与结缔组织,使用便携式pH计测定成熟期间肌肉pH值。
1.3.3 细胞凋亡率的测定
细胞凋亡率采用TUNEL凋亡试剂盒进行测定。将样品处理为1 cm×0.5 cm×0.5 cm的肉块,在质量分数4%多聚甲醛溶液中进行固定,石蜡包埋、切片(厚度约为5 μm)、脱蜡,用体积分数3%过氧化氢溶液封闭。随后将切片浸入1×磷酸盐缓冲液(phosphate buffered saline,PBS)漂洗3 次,每次5 min。每个样本上滴加100 μL蛋白酶K工作液,37 ℃反应30 min;切片再次浸入1×PBS漂洗3 次,每次5 min;切片周围用吸水纸吸干,每个切片上滴加50 μL末端脱氧核苷酸转移酶反应液,37 ℃避光反应1 h,反应后的切片浸入1×PBS漂洗3 次,每次5 min,注意避光;将切片放入Streptavidin-FITC标记工作液中,37 ℃避光反应30 min;然后将切片放入过氧化物酶-conjugated Anti-FITC工作液中,37 ℃避光反应30 min,与二氨基联苯中避光显色10 min。显色后的样本切片浸入1×PBS漂洗3 次,每次5 min,注意避光,用荧光显微镜进行观察和计数。
1.3.4 细胞凋亡酶活力的测定
按照Caspase-3和Caspase-9活力检测试剂盒说明书操作测定Caspase-3和Caspase-9活力。Caspase-3和Caspase-9活力以荧光强度来表示。
1.3.5 线粒体的提取
线粒体的提取参照赵亚亚[11]的方法并稍作修改。取滩羊背最长肌2 g肉样,剪碎后置于20 mL线粒体分离介质中,用低温研磨仪匀浆(10 000×g、2 min),匀浆液离心(4 ℃、1 000×g、10 min)而后取上清液进一步离心(4 ℃、1 000×g、10 min),后取上清液再离心(4 ℃、8 000×g、20 min),弃上清液所得沉淀即为线粒体,用BCA法测定蛋白质量浓度。
1.3.6 Cyt-c氧化还原状态的测定
Cyt-c氧化还原状态的测定参照Borutaite等[12]的方法并稍作修改。取2 g滩羊肌肉加入8 mL预冷的提取缓冲液(300 mmol/L蔗糖、10 mmol/L Tris-HCl、1 mmol/L乙二胺四乙酸、0.5%牛血清白蛋白,pH 7.4)进行匀浆。匀浆液于低温研磨仪10 000×g匀浆2 min,取上清液于10 000×g离心2 min,上清液再次于8 000×g离心15 min。最终得到的上清液采用双缩脲法测定胞浆Cyt-c质量浓度。上清液分别于550 nm和535 nm波长处测定吸光度。Cyt-c还原状态水平以550 nm波长处吸光度与535 nm吸光度之差与Cyt-c质量的比值表示。
1.3.7 ATP含量的测定
按照ATP含量检测试剂盒的要求测定ATP含量。
1.3.8 线粒体标志酶活力的测定
按照SDH、CS检测试剂盒的要求测定SDH、CS活力。
1.3.9 Bcl-2家族蛋白表达量的测定
凋亡关键因子Bax、Bcl-2表达量按照ELISA试剂盒说明书测定。
1.3.10 Western blot样品的提取
参照Philchenkov[13]的方法提取Western blot样品。取宰后肉样各1 g,加入2 mL分离缓冲液(0.225 mol/L甘露醇、0.075 mol/L蔗糖、0.2%牛血清白蛋白、1 mmol/L乙二胺四乙酸,pH 7.5),用玻璃匀装器匀浆,1 000×g离心10 min取上清液,然后14 000×g离心10 min取上清液,最后10 000×g离心15 min,上清液即为全蛋白提取物,用于测定蛋白表达。
1.3.11 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳和Western blot分析
参考孙志昶[14]的方法进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,分离胶和浓缩胶的质量分数分别为12%和5%。将目标蛋白转印到聚偏二氟乙烯膜上,随后用5%的脱脂奶粉TTBS溶液于25 ℃封闭1 h,用TTBS溶液漂洗,再与用含5%脱脂奶的TTBS溶液以500 倍稀释的Cyt-c、Caspase-3和GAPDH抗体4 ℃反应过夜。TTBS溶液洗去多余抗体后与相对应的二抗在25 ℃条件下孵育1 h,TTBS浸洗后采用DBA试剂盒显色。
使用扫描仪获取图像,然后用ImageJ分析软件进行定量分析,计算出目的条带的光密度值。
1.4 数据处理与分析
每个指标重复测定3 次,结果以平均值±标准差表示,采用Excel软件统计数据,采用SPSS Statistics 26软件对数据进行方差分析,采用Origin 2021软件作图。
2 结果与分析
2.1 宰后成熟过程中pH值变化
宰后肌肉pH值的下降会造成内环境的酸化,从而影响肌肉保水性,是衡量宰后初期肉品质的重要指标之一[15]。从图1可以得出,宰后0~72 h内,对照组的pH值显著下降了5%(P<0.05);12~24 h内对照组pH值显著高于LPS处理组(P<0.05)。LPS处理组在0~24 h内呈现显著下降趋势(P<0.05),并在24 h达到极限pH值,随后开始上升。Tao Yingmei[16]及姬琛[17]等的研究表明宰后成熟期间滩羊pH值变化范围为5.4~6.3,本实验研究结果符合这一规律。

图1 滩羊宰后成熟过程中pH值的变化Fig.1 Changes of pH during postmortem aging of Tan sheep meat
2.2 宰后成熟过程中细胞凋亡率的变化
由图2可知,绿色荧光的细胞核为TUNEL阳性细胞核。随着宰后成熟时间的延长,TUNEL阳性细胞核数量呈现增多的趋势,且同一成熟时间LPS处理组的TUNEL阳性细胞核数量多于对照组。可见LPS会诱导细胞凋亡。如图3所示,宰后成熟过程中,细胞凋亡率整体呈显著上升的趋势(P<0.05);0~72 h,对照组和LPS处理组细胞凋亡率分别上升至31.70%和42.47%;成熟期间对照组细胞凋亡率均显著低于LPS处理组(P<0.05),表明LPS处理滩羊促进了细胞凋亡进程,对细胞凋亡具有诱导作用。
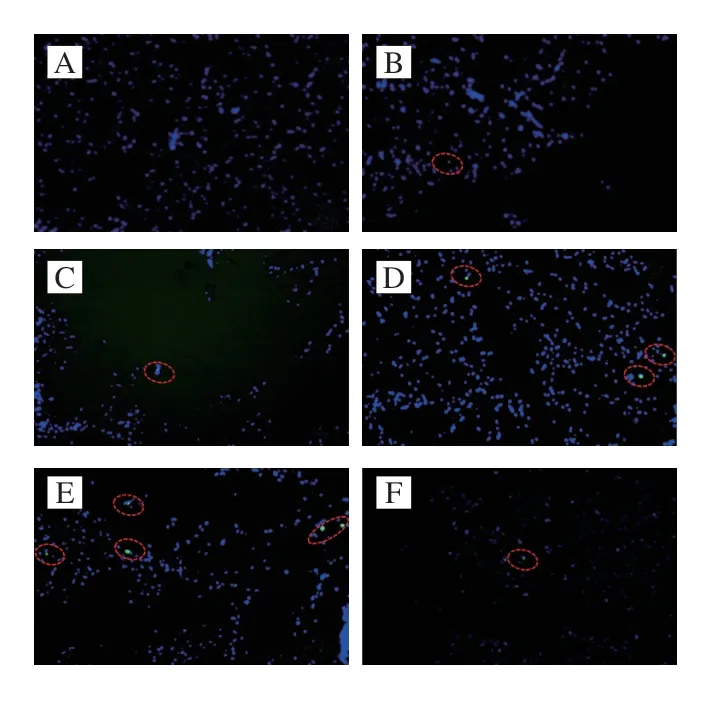

图2 LPS处理对宰后滩羊肉成熟过程中TUNEL阳性细胞核染色免疫荧光图Fig.2 Effect of LPS on immunofluorescence image of TUNEL-positive cell nuclei in Tan sheep meat during postmortem aging

图3 宰后滩羊肉成熟过程中细胞凋亡率的变化Fig.3 Changes in cell apoptosis rate during postmortem aging of Tan sheep meat
2.3 宰后成熟过程中细胞凋亡酶活力的变化
线粒体凋亡通路中,Caspae-9和Caspae-3作为重要的效应酶,与凋亡的发生密切相关。由图4A可知,LPS处理组Caspase-9活力在0~12 h显著上升并达到最大值1.413,随后显著下降(P<0.05);6~12 h内对照组Caspase-9活力显著上升并在12 h达到最大值1.306;0~72 h,LPS处理组Caspase-9活力均显著高于对照组(P<0.05)。如图4B所示,对照组Caspase-3活力在宰后成熟过程中显著上升(P<0.05),并于24 h达到最大值,随后呈现显著下降趋势(P<0.05);0~72 h内,LPS处理组Caspase-3活力呈先升后降趋势,并于24 h达到最大值;0~72 h内,LPS处理组Caspase-3活力均显著高于对照组(P<0.05)。

图4 宰后滩羊肉成熟过程中Caspase-9(A)和Caspase-3(B)活力变化Fig.4 Changes in Caspase-9 (A) and Caspase-3 (B) activities during postmortem aging of Tan sheep meat
2.4 宰后成熟过程中Cyt-c的氧化还原状态的变化
研究表明Cyt-c的氧化还原状态对于细胞凋亡的启动具有重要影响。只有氧化型Cyt-c能够激活Caspase,还原型Cyt-c没有启动细胞凋亡的作用[18]。图5反映了宰后滩羊肉成熟过程中Cyt-c氧化还原状态变化,宰后0~72 h,对照组和LPS处理组中Cyt-c还原水平显著降低(P<0.05)。LPS处理组的下降速度较对照组更快。Cyt-c还原水平的下降表明Cyt-c氧化水平升高,由此介导细胞凋亡发生。

图5 宰后滩羊肉成熟过程中Cyt-c还原水平的变化Fig.5 Changes in cytochrome c reduction level during postmortem aging of Tan sheep meat
2.5 宰后成熟过程中线粒体ATP含量的变化
滩羊宰后细胞内环境改变,阻断了氧气进入,缺氧使线粒体的氧化还原电位降低,造成呼吸链功能紊乱,ATP不能正常合成,磷酸原体系中的肌酸磷酸也会在很短的时间内被耗尽,无氧酵解途径开启,最终产生大量的乳酸[19]。由图6可知,线粒体ATP含量在宰后成熟过程中整体呈现显著下降的趋势(P<0.05);0~72 h内,对照组ATP含量显著降低了47.34%,LPS处理组的ATP含量显著下降了56.02%,LPS处理组ATP含量显著低于对照组(P<0.05),这可能是LPS加快了细胞从有氧呼吸向无氧糖酵解的进程。

图6 宰后滩羊肉成熟过程中ATP含量的变化Fig.6 Changes in mitochondrial ATP content during postmortem aging of Tan sheep meat
2.6 宰后成熟过程中线粒体标志酶活力的变化
SDH和CS作为线粒体的标志酶,均与能量代谢相关。SDH作为连接氧化磷酸化与电子传递的枢纽之一,可为呼吸链提供电子,是参与三羧酸循环的关键酶,SDH活力可以有效反映线粒体的功能[20]。CS作为三羧酸循环的关键调控酶,其活性及变构效应受到ATP的抑制[21]。由图7A可知,成熟早期(0~6 h),LPS处理组SDH活力均显著低于对照组(P<0.05),呈显著上升趋势(P<0.05);随后6~72 h呈显著下降趋势,可能是因为LPS处理加剧了线粒体能量的消耗,从而引起SDH活力短暂升高。如图7B所示,LPS处理组CS活力在0~6、12~72 h内呈现显著下降趋势(P<0.05),6~12 h内呈显著上升趋势(P<0.05);对照组CS活力在0~12、24~72 h内呈显著下降趋势(P<0.05),12~24 h显著上升趋势(P<0.05)。

图7 宰后滩羊肉成熟过程中SDH活力(A)和CS活力(B)的变化Fig.7 Changes in SDH activity (A) and CS activity (B) during postmortem aging of Tan sheep meat
2.7 宰后成熟过程中Bcl-2家族蛋白水平的变化
Bax和Bcl-2都属于Bcl-2蛋白家族,通过调节线粒体膜通透性参与线粒体凋亡途径并发挥关键作用[22]。成熟期间Bax水平的变化如图8A所示,在宰后成熟过程中,Bax水平整体呈现先上升后下降趋势,6 h为最高值。这与Ma Jibing等[23]在牛肉宰后成熟期间观察到Bax的水平呈现先上升后下降的趋势结果一致。成熟期间Bcl-2水平的变化如图8B所示,在宰后成熟期间Bcl-2水平整体呈现显著下降的趋势(P<0.05);其中LPS处理组水平显著低于对照组(P<0.05),刘畅[24]的研究也表明蒙古羊宰后成熟过程中Bcl-2水平呈现下降趋势。

图8 宰后滩羊肉成熟过程中Bax(A)和Bcl-2(B)水平的变化Fig.8 Changes in Bax (A) and Bcl-2 (B) levels during postmortem aging of Tan sheep meat
Bcl-2家族蛋白是线粒体凋亡途径的主要调控者,Bax和Bcl-2含量的比值(Bax/Bcl-2)可用来评估LPS其对诱导凋亡发生的作用。目前普遍认为,高Bax/Bcl-2表明促凋亡能力更强,低Bax/Bcl-2表明抗凋亡能力更强[23,25]。如图9所示,在宰后成熟过程中,LPS处理组的Bax/Bcl-2显著高于对照组(P<0.05)。综上说明,LPS可以调控Bcl-2家族蛋白含量,诱导凋亡的发生。

图9 宰后滩羊肉成熟过程中Bax/Bcl-2的变化Fig.9 Changes in Bax/Bcl-2 ratio during postmortem aging of Tan sheep meat
2.8 宰后成熟过程中线粒体信号通路关键因子释放的情况
由图10、11可知,在宰后成熟过程中,LPS处理组的胞浆Cyt-c表达量在宰后12 h显著升高,24~72 h内LPS处理组胞浆Cyt-c表达量呈下降趋势。这是由于宰后前期Cyt-c大量释放,而随着线粒体损伤的加重,Cyt-c的合成量不断减少,且一部分Cyt-c与Apaf-1结合,最终导致Cyt-c含量在宰后24 h后逐渐减少[26]。

图10 宰后滩羊肉成熟过程中Cyt-c的免疫印迹表达Fig.10 Changes in protein expression of Cyt-c during postmortem aging of Tan sheep meat

图11 宰后滩羊肉成熟过程中Cyt-c的表达Fig.11 Changes in Cyt-c expression during postmortem aging of Tan sheep meat
Caspase-3可以切割细胞骨架蛋白,它的激活标志着细胞凋亡的发生[27]。孙志昶[14]研究发现牦牛宰后成熟过程中确实存在细胞凋亡现象,Caspase-3、Caspase-8、Caspase-9均发生活化。本实验测定了Caspase-3活化蛋白的相对表达量,以分析LPS处理对宰后细胞凋亡的影响。Caspase-3酶原本身并没有诱导凋亡的活性,只有裂解为17~20 kDa的活化片段才能参与诱导细胞凋亡。
图12为不同处理组分别成熟0、6、12、24、72 h后Caspase-3的免疫印迹图谱,可以看出,经过LPS处理后,滩羊肉骨骼肌中Caspase-3活化片段的灰度均高于对照组。这说明在凋亡诱导剂LPS处理加快了Caspase-3酶原被激活并降解成活性片段的速度,故LPS是通过加速Caspase-3酶原的激活促进细胞凋亡。对活化片段进行光密度值的定量分析,结果如图13所示。LPS处理组的Caspase-3活化片段蛋白相对含量始终高于对照组,表明LPS处理组滩羊肉中Caspase-3裂解成活性片段的程度强于对照组,因此,LPS处理有利于加速宰后Caspase-3的激活。
3 讨论
细胞凋亡过程中DNA会发生降解形成碎片化,从而产生大量的黏性3’-OH末端,可通过TUNEL荧光标记,观察绿色荧光变化,以此了解细胞凋亡情况[28]。本研究中,通过观察TUNEL阳性细胞核数量以及计算细胞凋亡率得出,随着成熟时间的延长,细胞凋亡率呈现上升趋势,在同一成熟时间内LPS处理会加快细胞凋亡的进程。Cyt-c介导细胞凋亡通常伴随着线粒体损伤[29]。研究发现Cyt-c氧化还原状态与细胞凋亡的发生密切相关。本研究结果表明,宰后0~72 h,随着宰后时间的延长,Cyt-c还原水平逐渐降低,氧化水平逐渐升高,表明Cyt-c释放介导细胞凋亡发生在宰后早期。Cyt-c在线粒体介导的细胞凋亡途径中发挥核心作用[30]。Caspase-9活力整体呈现先上升后下降的趋势,这可能是由于宰后前期LPS处理影响Cyt-c氧化还原的活性,氧化型Cyt-c含量增多,从而介导Caspase级联反应信号不断放大,致使Caspase-9的活力上升。以上研究说明,LPS通过促进氧化型Cyt-c形成凋亡小体的作用,间接促进Caspase-9和Caspase-3的激活。Caspase-9的活化早于Caspase-3发生。即Caspase-9作为线粒体凋亡通路中凋亡启动酶,能启动下游的效应酶Caspase-3,进而引起线粒体通路细胞凋亡的发生。
本研究中LPS处理组肌肉pH值随成熟时间延长先下降后上升,并在24 h达到极限pH值,这可能是宰后内环境改变切断了与外界的联系,有氧呼吸转变为糖酵解生成乳酸所致。宰后ATP含量整体显著下降,这是因为宰后氧气的阻断导致线粒体中氧化还原电位下降,呼吸电子传递链发生功能障碍,不能正常地通过三羧酸循环合成ATP,细胞由有氧呼吸途径进入无氧酵解途径,导致细胞内ATP的生成量迅速降低[31-32]。这一能量变化的过程会影响线粒体标志酶——SDH和CS的活性,本研究发现宰后成熟早期处理组SDH活力高于对照组,CS活力在0~12 h随着成熟时间的延长呈现先下降后上升的趋势。宰后成熟过程中Bax含量整体呈现先上升后下降趋势,Bcl-2含量整体呈现下降趋势。Bax和Bcl-2分别是促凋亡和抗凋亡蛋白,研究发现在凋亡条件下,Bax激活后在线粒体外膜积累,并发生寡聚化,从而导致促凋亡因子如Cyt-c的释放[33]。Bax/Bcl-2可用来评估凋亡发生的程度,本研究结果表明,Bax/Bcl-2呈现上升趋势,且LPS处理组显著高于对照组。通过对Cyt-c和Caspase-3活化蛋白表达量的测定,发现LPS处理加快了Cyt-c的释放和Caspase-3活化,对凋亡进程起到促进作用。
综上,宰后成熟过程中LPS 诱导剂是通过激活Caspase-9和Caspase-3活性、降低细胞能量代谢水平进而影响SDH和CS的活性,促使Cyt-c释放,提高Bax/Bcl-2比值,从而诱导细胞通过线粒体信号通路发生凋亡。

