马来酰亚胺基烯二炔化合物对生物大分子的损伤作用
孙 可, 鲁浩天, 张梦思, 胡爱国
(华东理工大学材料科学与工程学院, 上海市先进聚合物材料重点实验室, 上海 200237)
烯二炔是一个烯单元(ene)共轭连接两个炔单元(yne)所形成的具有“炔-烯-炔”主体化学结构的一类化合物。1965 年从链霉菌的发酵液中分离出的新制癌菌素是第1 个被发现的烯二炔类化合物并于1985 年被证实[1]。1972 年Bergman 等[2]首次提出了烯二炔的环芳香化反应,并阐明了烯二炔抗生素的独特作用机制[3]。在随后的二十几年里,人们陆续发现了包括calicheamicins[4]、esperamicins[5]、dynemicins[6]、C-1027[7]等在内的更多类型的烯二炔。由于烯二炔具有独特的分子结构和强烈的DNA 剪切活性,因此吸引了无数化学家和生物学家的目光[8]。这类天然烯二炔是目前世界上已知的最具细胞毒性的分子,它们的抗肿瘤活性比临床上常用药物阿霉素高出上千倍。因此,烯二炔作为相关临床药物的潜力得到了广泛探索,例如通过用聚合物和抗体-药物偶联物(Antibody-Drug Conjugate, ADC)作为药物递送体系可将烯二炔类药物开发成为抗癌药物[9]。
除了DNA 外,烯二炔类化合物还可作用于蛋白质[10],使蛋白质主链发生分子内交联或降解,从而失去结构完整性乃至生物活性。Zein 等[11]在1993 年首次报道了人工合成的烯二炔对蛋白质的损伤作用。他们发现0.46 mmol/L 的烯二炔即可对细胞膜蛋白质HCT116 产生完全降解作用。当使用其他蛋白质如3',5'-环腺苷酸依赖性蛋白激酶、前列腺酸性磷酸酶或小牛脑微管蛋白时也能观察到类似的现象。Jones 课题组[12]确定了3 类结构独立的烯二炔具有明确的蛋白质靶点(白蛋白、组蛋白和雌激素受体),显示了亲合力与蛋白质降解活性之间的相关性。Zaleski 课题组[13]通过金属配位作用活化烯二炔化合物,发现烯二炔可以降解淀粉样蛋白,为缓解阿尔兹海默症提供一条新策略。
烯二炔类化合物的环化反应机理主要包括Bergman环化和Myers-Saito 环化两类。Bergman 环化反应是共轭的烯二炔通过热致或光致诱导的分子内环化生成1,4-苯双自由基或其类似物的一类环化反应[2]。烯炔-联烯结构(可由烯二炔结构重排而生成)的Myers-Saito 环化与Bergman 环化具有类似的反应机理,它们均是由闭壳层化合物产生开壳层的高活性双自由基。相对而言,Myers-Saito 环化反应通常可以在较低的温度下发生,原因可能是平面内π 轨道在横向方向上的排斥力减小所致[14]。天然烯二炔是从放线菌中分离得到的,来源非常稀少,提取量一般在微克级别,由于其具有复杂的分子结构,通过化学方法进行合成困难,极大地限制了它们的应用。因此,为了寻找能够替代天然烯二炔的优异抗癌药物,人们付出了大量努力设计合成具有高反应活性的烯二炔分子[15]。
本课题组经过系列研究,发现在非环烯二炔的烯端引入马来酰亚胺基团对于降低化合物的热触发反应温度有重要作用[16],并提出了马来酰亚胺促进的重排和环芳香化反应(Maleimide Assisted Rearrangement and Cycloaromatization, MARACA)机制[17]。研究表明马来酰亚胺基团的存在可以促进分子内的级联1,3-质子转移过程,使得原本具有热稳定性的开环烯二炔化合物在生理环境下原位转化为烯炔-联烯结构,并快速通过Myers-Saito 环化形成高活性的双自由基中间体。基于这种新机制设计合成的马来酰亚胺基烯二炔化合物均可在生理温度下形成活性双自由基并导致DNA 断裂,从而对所有测试的肿瘤细胞系均产生细胞毒性[17-18]。
在病毒肆虐的今天,探索新型抗病毒药物具有重要的意义[19]。病毒是一种结构简单的非生命体,其主要成分是核酸和发挥保护、传染、复制等功能的蛋白质[20],任何对这些生物大分子结构具有破坏作用的化合物均可能成为潜在的抗病毒药物。本文利用Sonogashira 偶联反应设计合成了3 种炔末端具有不同羟基数量的马来酰亚胺基烯二炔,探索了其在生理温度下通过MARACA 反应机制产生自由基的能力;通过琼脂糖凝胶电泳实验和十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶电泳实验探究了其对DNA、蛋白质等生物大分子的损伤作用,为开发基于烯二炔的抗病毒药物奠定基础。
1 实验部分
1.1 主要试剂和仪器
1.1.1 主要试剂 2,3-二氯马来酸酐,分析纯,上海霖陵化工科技有限公司;新戊胺,分析纯,上海泰坦科技股份有限公司;碘化钠,分析纯,萨恩化学技术(上海)有限公司;3-丁炔-1-醇,分析纯,安徽泽升科技有限公司;乙基炔丙酯,分析纯,上海麦克林生化科技有限公司;季戊四醇,分析纯,上海泰坦科技股份有限公司;4-戊炔酸,分析纯,萨恩化学技术(上海)有限公司;N,N-二异丙基乙胺,分析纯,萨恩化学技术(上海)有限公司;碘化亚铜,分析纯,阿拉丁试剂(上海)有限公司;4-二甲氨基吡啶,分析纯,上海泰坦科技股份有限公司;1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐,分析纯,上海毕得医药科技有限公司;乙酸乙酯、正己烷、二氯甲烷(DCM)、甲苯、四氢呋喃(THF)、二甲基亚砜(DMSO),分析纯,上海泰坦科技股份有限公司;乙腈、冰乙酸,分析纯,阿拉丁试剂(上海)有限公司;N,N-二甲基甲酰胺(DMF),分析纯,安徽泽升科技有限公司;Tris-EDTA 缓冲液,分析纯,碧云天生物技术公司;pUC 19 DNA 缓冲液,上海晶岱生物科技有限公司;DNA 上样缓冲液(6×),上海源叶生物科技有限公司;琼脂糖,分析纯,百灵威科技有限公司;YeaRed Nucleic Acid Gel Stain,分析纯,翌圣生物科技(上海)股份有限公司;Lysozyme/溶菌酶(>20 kU/mg),分析纯,碧云天生物技术有限公司;PAGE 预制胶(Hepes, 4%~20%),碧云天生物技术有限公司;SDS-PAGE Hepes 电泳液(20×),分析纯,碧云天生物技术有限公司;SDS-PAGE 蛋白染色及上样缓冲液(5×),碧云天生物技术有限公司;蛋白质标准品(5 mg/mL BSA),分析纯,碧云天生物技术有限公司。甲苯、THF 均经过钠砂干燥重蒸后使用。化合物1,2 参考我们前期工作合成[17]。
1.1.2 主要仪器 核磁共振氢谱仪(1H-NMR,400、600 MHz)和碳谱仪(13C-NMR,600 MHz):美国Bruker公司BRUKER BIOSPIN AG 型;高分辨质谱仪(HRMS):采用英国Micromass LCTTM 型液相色谱/飞行时间质谱联用仪, 配以Waters 600 液相色谱仪进样系统,注射泵离子化方式为电喷雾电离(ESI);电子顺磁共振波谱仪(EPR):美国Bruker 公司EMX-8/2.7C 型,采用X 波带频率测试记录;蛋白质/DNA 电泳仪:北京六一生物科技有限公司DYY-6D 型;蛋白质/DNA成像系统:上海越众设备有限公司暗箱紫外分析仪ZF-20A 型。
1.2 烯二炔化合物的制备
烯二炔的合成策略参考本课题组前期工作[17],合成步骤如图1 所示。
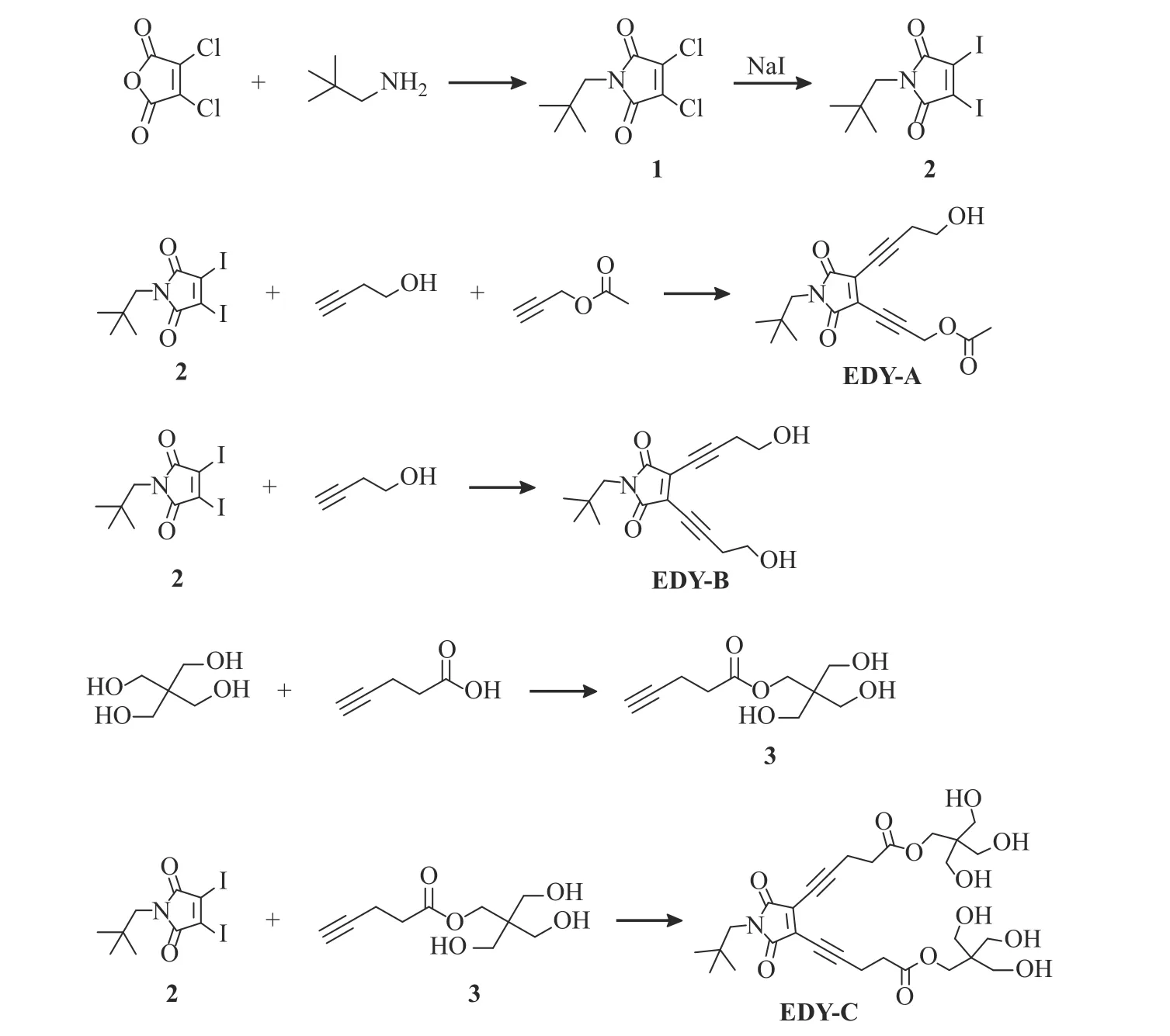
图1 烯二炔化合物的合成路线Fig.1 Synthetic route of the enediyne compounds
化合物3[21]:室温下称取4-戊炔酸(2.16 g,22 mmol),季戊四醇(6 g,44 mmol),4-二甲氨基吡啶(537 mg,4.4 mmol)加入250 mL 圆底烧瓶中,在0 ℃冰水浴中缓慢逐滴加入1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(4.2 g,22 mmol)的DMF(40 mL)溶液,有轻微混浊出现,随后转移至80 ℃油浴锅中搅拌24 h。通过薄层色谱(TLC)点板对反应进行跟踪,待4-戊炔酸反应完全后减压蒸馏除去DMF。加入适量甲醇制备干粉,通过硅胶柱层析法(淋洗剂为DCM 和甲醇的混合物,体积比10∶1)对产物进行分离,得到无色油状物2.1 g,产率为44%。1H-NMR (400 MHz, CDCl3,δ): 4.22 (s, 2H), 3.65 (s, 6H), 2.61 (t,J=6.7 Hz, 2H),2.52 (td,J= 6.4, 2.3 Hz, 2H), 2.01 (t,J= 2.5 Hz, 1H);13C-NMR (101 MHz, CDCl3,δ):172.79, 82.24, 69.43,63.51, 63.25, 45.30, 33.40, 14.48。
马来酰亚胺基烯二炔化合物的一般合成方法:室温下分别称取化合物2(252 mg,0.6 mmol)、NHC(氮杂环卡宾)-PdCl2-3-chloropyridine[22](41 mg,0.06 mmol)、碘化亚铜(46 mg,0.24 mmol)加入25 mL Schlenk 瓶中。抽换气3 次后,通氮气条件下依次加入干燥的甲苯(4 mL)、N,N-二异丙基乙胺(297 μL,1.8 mmol),分别加入反应所需要的炔各0.9 mmol、干燥的THF 2 mL,每一次加入后均需要抽换气3 次。反应在室温通氮气保护条件下进行,通过TLC点板对反应进行跟踪。待化合物2 反应完全,抽真空将体系中的溶剂浓缩至1.5 mL 左右,通过硅胶柱层析法对产物进行分离纯化,最终得到纯净的烯二炔化合物。
化合物EDY-A:根据一般合成方法制备(室温反应16 h),通过硅胶柱层析法(淋洗剂为正己烷与乙酸乙酯的混合物,体积比1∶1)对产物进行分离纯化,得到深红色油状物54.2 mg,产率为27%。1H-NMR(600 MHz, CDCl3,δ) :4.97 (s, 2H), 3.87 (t,J= 6.0 Hz,2H), 3.34 (s, 2H), 2.85 (t,J= 6.0 Hz, 2H), 2.14 (s, 3H),0.91 (s, 9H);13C-NMR (151 MHz, CDCl3,δ): 170.3,167.6, 130.4, 127.0, 110.5, 102.2, 76.2, 73.0, 60.4, 52.6,50.3, 33.7, 28.0, 25.1, 20.8; HRMS (ESI),m/zcalcd.for C18H21NO5Na [M + Na]+: 354.131 7; found 354.131 6。
化合物EDY-B:根据一般合成方法制备(室温反应15 h),通过硅胶柱层析法(淋洗剂为正己烷和乙酸乙酯的混合物,体积比1∶3)对产物进行分离纯化,得到黄色油状物124 mg,产率为68%。1H-NMR(600 MHz, CDCl3,δ): 3.85 (t,J= 6.0 Hz, 4H), 3.33 (s,2H), 2.83 (t,J= 6.0 Hz, 4H), 0.90 (s, 9H); HRMS (ESI),m/zcalcd.for C17H21NO4Na [M + Na]+: 326.136 8; found 326.136 6。
化合物EDY-C:根据一般合成方法制备(室温反应17 h),通过硅胶柱层析法(淋洗剂为DCM 和甲醇的混合物,体积比8∶1)对产物进行分离纯化,得到红色油状物230 mg,产率为64%。1H-NMR (600 MHz,CD4O,δ) :4.15 (s, 4H), 3.59 (s, 12H), 3.30 (s, 2H), 2.91(t,J= 7.1 Hz, 4H), 2.73 (t,J= 7.1 Hz, 4H), 0.90 (s, 9H);13C-NMR (151 MHz, CD4O,δ) :171.80, 167.94, 128.15,109.40, 71.27, 63.30, 60.97, 47.61, 44.93, 32.90, 32.40,26.94, 15.47; HRMS (ESI),m/zcalcd.for C29H41NO12Na[M + Na]+: 618.252 6; found 618.252 7。
1.3 电子顺磁共振实验
配制浓度为100 mmol/L 的N-叔丁基-α-苯基硝酮(PBN)的DMSO 溶液,随后依据化合物的质量向烯二炔中加入一定量PBN(浓度为20 mmol/L)的DMSO 溶液配制烯二炔母液;另外设置一组不加烯二炔且PBN 浓度为20 mmol/L 的DMSO 溶液作为对照组。将所有样品置于37 ℃水浴锅中反应12 h 后进行电子顺磁共振测试。
1.4 DNA 凝胶电泳实验
琼脂糖凝胶的配制:室温下称取5 g 琼脂糖加入500 mL 玻璃瓶中,加入500 mL 三羟甲基氨基甲烷-乙酸-乙二胺四乙酸(TAE)(1×)缓冲液,将玻璃瓶转移至微波炉中,加热至溶液澄清透明后取出,置于70 ℃烘箱中备用;核酸染料的配制:取1.755 g NaCl、90 μL DuRed、300 mL 超纯水混匀。将烯二炔溶于DMSO 中配制成浓度为40 mmol/L 的母液。将pUC19 DNA 缓冲液(20 ng/μL)与Tris-EDTA 缓冲液按照体积比1∶8 在适当的离心管中充分混匀后分装到若干个200 μL 离心管中,每个离心管加入8 μL 该混合溶液。在实验组中,每个离心管中分别加入一定量的烯二炔母液与DMSO,使溶液最终的体积均为16 μL,配制成一系列具有不同浓度梯度的烯二炔与DNA 的混合溶液;在对照组中,则仅加DMSO 使溶液的终体积达到16 μL。将对照组与实验组转移至37 ℃水浴锅中作用48 h。取适量配制好的琼脂糖凝胶倒入带有梳子的制样槽中,冷却后得到带有若干孔道的琼脂糖凝胶板。将胶板转移至含有一定量TAE(1×)缓冲液的电泳槽中,使缓冲液没过琼脂糖凝胶板3~4 mm。将2 μL DNA 上样缓冲液与反应后的样品混匀,然后吸取9 μL 缓慢加入琼脂糖凝胶板孔道中。设置电泳仪电压为100 V,电流为90 mA,开始跑胶,时间约为1.5 h。将结束跑胶的琼脂糖凝胶板置于配制好的核酸染料中至少染色30 min。最后将结束染色的胶板置于暗箱中,在302 nm紫外灯下使用蛋白质/DNA 成像系统对DNA 成像并拍摄记录。
1.5 SDS-PAGE 凝胶电泳实验
InstantView™ SDS-PAGE 蛋白染色及上样缓冲液(5×)的配制:取出装有染料的离心管,将染料集中至管底。从低温冰箱中取出上样缓冲液(5×),室温融化并使用移液枪吹打混匀。在装有染料的离心管中加入1 mL上样缓冲液(5×),充分溶解并使用移液枪吹打混匀后备用。将烯二炔溶于DMSO 中配制成浓度为40 mmol/L 的母液。分别取8 μL 蛋白样品分装到若干个200 μL 离心管中,即每个离心管中有40 μg蛋白样品。在实验组中,每个离心管中分别加入一定量的烯二炔母液与DMSO,使溶液最终的体积均为16 μL,配制成一系列具有不同浓度梯度的烯二炔与蛋白质的混合溶液;在对照组中,仅加入DMSO 使溶液终体积达到16 μL。将对照组与实验组转移至37 ℃水浴锅中作用48 h。以上样缓冲液体积与蛋白质样品总体积之比为1∶4 向每个离心管中加入4 μL 上样缓冲液并充分混匀。将离心管转移至95~100 ℃水浴中加热5~10 min,使蛋白质充分变性并与染料结合紧密。
SDS-PAGE 电泳液(1×)的配制:室温下量取25 mL SDS-PAGE 电泳液(20×)加入500 mL 烧杯中,再向烧杯中加入400 mL 超纯水,转移至500 mL 容量瓶中,定容至500 mL 即得到SDS-PAGE 电泳液(1×)。
SDS-PAGE 凝胶电泳实验:将预制胶从包装中取出后固定在电泳槽中,缓慢拔出梳子。内槽加入少量配制好的电泳液,再使用100 mL 移液枪轻轻吹打加样孔以去除气泡和残留的储存缓冲液。随后将内槽加满电泳液,外槽加入适量电泳液没过电泳槽底部阳极。待加热后的离心管冷却至室温后使用10 μL 移液枪垂直插入上样孔中上样,在胶板的每个孔道中加入8 μL样品。设置电泳仪电压为120 V,电流100 mA,时间70 min,开始跑胶。跑胶结束,置于暗箱紫外分析仪中,在254 nm 波长下观察荧光结果。
2 结果与讨论
2.1 化合物的合成
基于本课题组对马来酰亚胺基烯二炔化合物的研究,本文延续以往的合成路线,通过Sonogashira偶联反应[23]将反应所需要的一种或两种端基炔连接到二碘马来酰亚胺化合物2 上,从而实现对称或者非对称烯二炔核心单元的构建。化合物EDY-A 为以往工作中报道过的烯二炔[17],化合物EDY-B 和EDYC 的结构得到了核磁共振氢谱(如图2)与高分辨质谱结果的证实。

图2 EDY-B 和EDY-C 的核磁共振氢谱Fig.2 1H-NMR spectra of EDY-B and EDY-C
2.2 自由基的产生
通过电子顺磁共振实验证明烯二炔具有在生理温度下产生自由基的能力[24]。对此,选用自由基捕捉剂PBN 将体系生成的自由基转化为稳定的氮氧自由基从而间接证明自由基的生成,如图3 所示。与对照组PBN 相比,烯二炔EDY-A 在0.352 0 T 附近处出现对应于氮氧自由基信号的典型三重峰,由此证实了体系中自由基的产生。这一结果为后续进一步开展生物测试奠定了理论基础。

图3 化合物EDY-A(红色)与对照组(黑色)的EPR 谱图Fig.3 EPR spectra of compound EDY-A (red) and control group(black)
2.3 DNA 裂解活性
Basak 等[25]将DNA 的裂解分为两种形式:单链剪切和双链剪切。通过使用环状超螺旋质粒DNA(Form Ⅰ)来探索DNA 的切割活性,当两条链中仅有一条断裂或产生切口而引起DNA 松弛时为单链剪切(Form Ⅱ);当在两条链的互补位点(或接近互补位点)产生切割从而形成线性形态时为双链剪切(FormⅢ)。本文使用pUC19 DNA 质粒,探究了烯二炔EDY-A 和EDY-C 对DNA 的损伤作用。研究结果表明,两种烯二炔在生理温度下均可以对DNA 产生裂解效果,并且表现出明显的浓度依赖性(图4)。其中,随着药物浓度增大,EDY-A 在5 mmol/L 时可使DNA 由Form Ⅱ转化为Form Ⅲ,意味着此浓度下烯二炔对DNA 双螺旋结构产生了更强的裂解作用。然而与EDY-A 相比,EDY-C 在相同浓度下并未对DNA 表现出明显的剪切效果。当EDY-C 浓度增大到15 mmol/L 以上时,才出现除Form Ⅰ以外的荧光拖尾条带。这表明EDY-C 对DNA 的损伤作用弱于EDY-A,我们认为这是由于化合物EDY-C 的烯二炔结构产生自由基的能力弱于EDY-A 导致的。根据MARACA 机理,烯二炔的炔丙位上如果存在杂原子,则会加速分子内氢转移过程,促进烯二炔转化为炔烯-联烯结构和高活性自由基的生成[17,26]。在EDY-C(或者EDY-B)中,炔丙位直接相连的是无推拉电子作用的亚甲基,而在EDY-A 中,其中一个炔臂上存在炔丙酯结构,有利于分子内氢转移过程和后续的环芳香化反应。

图4 在37 ℃下,化合物EDY-A(a)和EDY-C(b)与pUC19 DNA 作用48 h 后的凝胶电泳图Fig.4 Gel electrophoresis of compound EDY-A (a) and EDY-C (b) reacting with pUC19 DNA at 37 ℃ for 48 h
2.4 蛋白质降解活性
选择生化实验中常用的牛血清白蛋白(BSA)和溶菌酶(Lysozyme)为模型蛋白质,借助SDS-PAGE凝胶电泳技术探究了此类马来酰亚胺基烯二炔化合物对不同蛋白质的损伤作用。结果表明烯二炔化合物对蛋白质同样具有浓度依赖性的裂解效果(图5)。化合物EDY-A 在5 mmol/L 浓度下对BSA表现出裂解活性,蛋白质荧光条带变暗;当EDY-A 浓度提高至10 mmol/L时则无法观察到蛋白质荧光条带,我们认为这是由于烯二炔产生的高活性自由基将蛋白质裂解成碎片导致的。类似的,EDY-A 在相同浓度梯度下对溶菌酶蛋白质表现出显著的裂解效果。然而当烯二炔浓度增大至10 mmol/L 时,依然可以观察到拖尾的蛋白质荧光条带,说明EDY-A 对溶菌酶蛋白质的损伤效果弱于BSA。此外,EDY-B、EDY-C 对溶菌酶蛋白质在设置的最大浓度(分别为20,40 mmol/L)下才表现出一定的裂解效果,且效果并不明显。以上结果与前文烯二炔对DNA 的裂解实验结果一致。

图5 不同种类烯二炔化合物对牛血清白蛋白和溶菌酶的SDS-PAGE 凝胶电泳图Fig.5 SDS-PAGE gel electrophoresis of the different enediyne compounds on BSA and lysozyme
3 结论与展望
本文基于MARACA 反应机制,利用Sonogashira偶联反应合成了3 种具有不同羟基数量封端的马来酰亚胺基烯二炔。通过凝胶电泳实验证实了此类烯二炔具有在生理温度下产生自由基的能力,并可导致生物大分子如DNA 或蛋白质出现裂解等损伤作用,其损伤效果与烯二炔化合物的反应活性一致,其中炔丙位上具有杂原子的EDY-A 表现出最优异的生物损伤作用。以上研究结果为后续通过分子设计合成具有更高生物活性的烯二炔化合物提供指导,为此类烯二炔在未来破坏病毒蛋白结构的研究方向铺平道路。

