美藤果叶醇提物对延缓秀丽隐杆线虫衰老的影响
赖玉萍,陈颖仪,魏婉娉,安苗青,邹泽斌,杜 冰,黎 攀
(华南农业大学食品学院,广东广州 510642)
衰老是一个保守的、复杂且不可逆转的退行性生理过程,其特征是身体生理功能的下降和综合表现的退化,甚至可能危及生命[1]。已发表的与衰老有关的理论大多可分为程序化衰老和损伤衰老两种,其中最普遍的观点是氧化应激损伤,其强调的是生物体在代谢过程中由一些相互关联的反应产生的过量ROS 对核酸、脂质和蛋白质等细胞生物大分子造成渐进和累积性损伤,进而加速衰老[2-3]。随着衰老模型和衰老表型指标的建立,具有功能多样性的天然植物提取物已被证明能预防和/或缓解生理功能的自然下降,有望成为健康寿命和长寿的促进剂[4-6]。
美藤果(Sacha inchi,又名Plukenetia volubilisLinneo),亦称南美油藤、印奇花生、星油藤等,属大戟科多年生常绿木质含油攀援植物,原产于南美洲亚马逊地区的热带雨林,包括秘鲁和巴西西北部的部分地区,其叶子和种子被一些土著部落群体以煮熟和烘烤形式作为传统食物食用[7]。研究表明[8],美藤果叶乙醇提取物在7000 mg/kg 的质量浓度范围内对瑞士白化小鼠没有产生任何不利影响,即没有毒副作用,可以安全食用。Lin 等[9]发现,美藤果叶水提取物可改善小鼠的高血糖症状和肠道微生物群的结构紊乱,有成为功能性饮料的潜力。Nascimento 等[10]对从水、甲醇、乙醇、氯仿和己烷这5 种不同溶剂中提取的新鲜美藤果叶提取物进行相关分析,发现它们含有酚类化合物、蛋白质、糖以及萜类化合物和/或类固醇,活性试验结果表明这些提取物具有抗氧化活性,可刺激成纤维细胞3T3 的增殖,还能通过诱导细胞凋亡,不同程度地抑制肿瘤细胞HeLa 和A549 的增殖活性。Kittibunchakul 等[11]对经烘箱干燥和冷冻干燥后美藤果嫩叶和成熟叶中的酚类成分含量和抗氧化潜力进行研究,发现冻干叶的总酚含量高于烘干叶,烘干后幼叶的抗氧化活性高于成熟叶,而冷冻干燥的结果则与之相反。综上所述,美藤果叶提取物有成为功能食品或药物补充剂的潜力。
从目前来看,大多数具有抗衰老作用的生物活性成分都是首先以秀丽隐杆线虫为模式生物的活性试验发现的。这可归因于线虫所具有的优势:微小透明、解剖结构简单,这为在体式显微镜下观察线虫的行动轨迹提供了便利;基因组特征明确,有与人类同源的肠道、神经元和肌肉细胞,这对神经系统和代谢功能至关重要[12-14];生命周期较短、繁衍能力强与人类高度保守的衰老信号网络等[15],这些优势满足了实验的灵活性、稳定性和可靠性等要求,使其成为衰老生物学研究的理想模型生物。另外,以哺乳动物为模型进行实验虽然很有说服力,但它耗时长且有伦理问题的限制。
因此,本文以秀丽隐杆线虫为模型生物,探究了美藤果叶醇提物(SILAE)的抗衰老活性,丰富了对美藤果叶功效作用的认识,为综合开发美藤果叶提供借鉴和参考。
1 材料与方法
1.1 材料与仪器
N2 野生型线虫(Caenorhabditis elegans) 美国秀丽隐杆线虫遗传中心;美藤果叶(干燥) 普洱联众生物资源开发有限公司;大肠杆菌OP50(以下简称OP50) 上海南方模式生物科技股份有限公司;超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、MDA 试剂盒、过氧化氢酶(catalase,CAT)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSHPx)、谷胱甘肽(glutathione,GSH)试剂盒 南京建成生物工程研究所;其他试剂 广州齐湘生物科技有限公司。
SN-HWS250B 型恒温生化培养箱 甘易仪器设备(上海)有限公司;FA2204 型万分之一天平 上海舍岩仪器有限公司;LD-SY96S 型多功能酶标仪美谷分子仪器(上海)有限公司;MF53-N 型荧光显微镜 上海蔡康光学仪器有限公司;LC-LX-HR185C型冷冻离心机 日本久保田公司。
1.2 实验方法
1.2.1 样品溶液的制备 干燥的美藤果叶经粉碎机粉碎后,过80 目筛后,参考文献[16]进行超声辅助乙醇提取。提取液4000 r/min 离心10 min,合并上清液并旋转蒸发浓缩,冷冻干燥。用体积分数为70%的乙醇溶液复溶,过0.22 μm 滤膜,采用D101大孔树脂进行柱层析[17],先后分别用去离子水、体积分数10%和70%的乙醇梯度洗脱,收集70%乙醇的洗脱液,旋转蒸发浓缩,冷冻干燥得SILAE,用于基本活性成分的含量测定和线虫的抗衰老实验。
1.2.2 培养基及相关溶液配制
1.2.2.1 线虫生长培养基(nematode growth medium,NGM) 0.08 g 链霉素硫酸盐,1.0 g 胰蛋白胨,1.2 g NaCl,8.0 g 琼脂粉,加入一级水390 mL,121 ℃灭菌30 min。然后转入无菌超净台中,降至适宜温度后,加入1 mol/L CaCl2、1 mol/L MgSO4和5 mg/mL溶解于乙醇中的胆固醇(已过滤除菌)各400 μL,以及10 mL 1 mol/L pH 为6.0 的磷酸盐缓冲液(除胆固醇外,其余三种溶液高温灭菌后再加入),混匀后在无菌超净台中趁热将其倒进培养皿中,待平板水汽干燥后方可用于实验。
1.2.2.2 M9 缓冲液 取3 g Na2HPO4或7.56 g Na2HPO4·12H2O,1.5 g KH2PO4,2.5 g NaCl,0.125 g MgSO4·7H2O,加水至500 mL,121 ℃灭菌15 min。
1.2.2.3 OP50 的制备 在超净台内,挑取OP50 单菌落接入晾凉至约60 ℃的20 mg/mL 的LB 培养基中,而后置于恒温摇床内,在37 ℃,150 r/min 条件下,培养20 h,至OD595=1.0 左右即可。
1.2.3 线虫的培养和同期化 线虫的培养:用NGM于20 ℃的恒温培养箱中进行培养,NGM 中涂有0.2 mL OP50 作为线虫的食物。
线虫的同期化:将处于产卵期的线虫用1 mL M9 缓冲溶液从NGM 洗至无菌离心管中,3000 r/min离心1 min,弃去上清液,重复上述步骤2~3 次后。再向其中加入1 mL 裂解液(5 mol/L NaOH:质量分数0.5%的NaClO:超纯水=1:1:1),上下轻缓颠倒,裂解约4 min 后3000 r/min 离心1 min,吸除上清液,再向管中加1 mL M9 缓冲液冲洗线虫,3000 r/min离心1 min,重复两次,弃去上清液后用移液枪吸取离心管中的线虫悬液50~100 μL 滴在NGM 的无菌区,在20 ℃培养箱中恒温培养约48 h(不超过60 h)后,此时的线虫即为同一生长发育水平L4 期的幼虫,可用于相关实验。
1.2.4 实验分组与给药途径 实验分组:以H2O2氧化应激实验结果为依据,设置含有质量浓度为5、10、15 mg/mL SILAE 的低、中、高剂量样品组,以及用超纯水和维生素C(10 mg/mL)代替样品的空白组和阳性对照组。
给药途径:样品、VC、超纯水分别与OP50 按3:2 的比例配制成给药样液,向新鲜NGM 中央滴入0.1 mL 样液,放置24 h 后用于线虫实验。
1.2.5 SILAE 中基本活性成分的测定 将1.2.1 中获得的SILAE 配制成0.1 mg/mL 的样品溶液,进行含量测定。
1.2.5.1 总酚含量的测定 参考杨云等[18]方法并调整。用没食子酸标准品配制0.1 mg/mL 的没食子酸标准溶液。以没食子酸浓度(mg/mL)为X 轴,吸光值为Y 轴,绘制标准曲线。
取12.5 μL 0.1 mg/mL 的SILAE,定容至250 μL作为样品待测液。向待测样品和蒸馏水中加入福林酚试剂0.25 mL,混匀,避光反应2 min,依次加入1 mL 的7.5% Na2CO3和0.5 mL 水,混匀。40 ℃避光水浴30 min。在760 nm 处测定吸光值。
1.2.5.2 多糖含量的测定 参考海力茜·陶尔大洪等[19]的方法,略有改动。准确称取葡萄糖标准品10.0 mg,用一级水配制成0.1 mg/mL 的葡萄糖标准溶液,绘制标准曲线。
取1 mL 0.1 mg/mL 的SILAE 于试管中,而后依次加入1 mL 5%苯酚和5 mL 浓硫酸,混匀,30 ℃水浴20 min,490 nm 处检测吸光值,计算总糖含量。
1.2.5.3 蛋白质含量的测定 参考黄婉玉等[20]方法。以2 mg/mL 牛血清蛋白溶液为母液,配制浓度分别为0、5、25、50、125 和500 μg/mL 的标准溶液。分别取不同浓度的标准品20 μL 于96 孔板中,再加入200 μL 考马斯亮蓝G250,混合均匀,在595 nm 出检测吸光值。以牛血清蛋白浓度为横坐标,吸光值为纵坐标,制作标准曲线。用待测SILAE 替换牛血清蛋白溶液,重复上述步骤,测定其蛋白质含量。
1.2.5.4 总黄酮含量的测定 参考王冰芳[16]的方法,略有修改。用60%乙醇配制0.20 mg/mL 的芦丁标准品溶液,准确移取0.0、1.0、2.0、3.0、4.0、5.0 mL的芦丁标准品溶液于6 个10 mL 的刻度比色管中。先加入0.3 mL 5%的NaNO2溶液于各管中,充分摇匀后静置6 min;再向各管中加入0.3 mL 10%的Al(NO3)3溶液,摇匀,静置6 min;最后加入4.0 mL 4%的NaOH 溶液于各管中,并用60%的乙醇定容至刻度,摇匀后静置15 min。以60%乙醇作为空白对照,分别在510 nm 处测定吸光值值,绘制标准曲线。
用待测SILAE 替换芦丁溶液,重复上述步骤,测定其总黄酮含量。
1.2.6 线虫寿命的测定 挑取同步化的L4 期幼虫到新的各组平板上(每个平板30 条,每组3 个平板),于20 ℃恒温箱中继续培养,定为第0 d。为保证处理化合物的浓度,随后每天将线虫转移到相应的新鲜NGM 板中,直到生殖后期(第6 d),此后每2 d将线虫转到新的各组平板中,记录线虫存活、死亡以及剔除条数,直至所有组线虫死亡,实验结束[21]。
线虫死亡判断标准:无吞咽或移动动作,铂丝轻触虫体仍无任何反应。剔除标准:钻入琼脂中;逃离至平皿壁或盖上而干死;虫卵在体内孵化而成袋样虫。剔除意外死亡、逃逸和袋样虫。
1.2.7 线虫运动能力的测定 在同步的寿命实验中进行评估,每4 d 观察并记录线虫的运动情况[22]。记录标准:虫体20 s 内有自发连续协调的正弦运动,不需要触碰刺激,记为“A”;虫体必须受到触碰刺激才运动,记为“B”;线虫受到触碰刺激后只摆头或尾,记为“C”。
1.2.8 线虫产卵量的测定 挑取同期化的L4 期幼虫到各组NGM 中,每组5 个板,每个平板1 条线虫。每隔24 h 将线虫转移至相应的新NGM 中(大约转移4~5 次),直到线虫不再产卵。将有虫卵的NGM 再放回恒温培养箱中20 ℃孵育24 h,待虫卵孵化长大后(在其进入产卵期之前)进行计数,即为每条线虫的产卵量。
1.2.9 线虫应激能力实验 氧化应激NGM 的配制:将0.1% H2O2和用无水乙醇配制好的240 μmol/L胡桃醌溶液,在无菌超净台中倒入冷却至60 ℃左右的NGM 中(按400 mL 计),混匀后倒入培养皿中,避光放置。
H2O2急性氧化应激[23]:挑取同期化的L4 期幼虫到各组NGM 中(每个平板20 条,每组3 个板),干预5 d 后,将各组线虫转移至含有0.1% H2O2的NGM 中,每隔1 h 统计一次线虫的生存情况,直到线虫全部死亡。
胡桃醌氧化应激[24]:挑取同期化后处于L4 期的幼虫到各组NGM 中(每个平板30 条,每组3 个平板)继续干预5 d,随后将各组线虫转移至含有240 μmol/L胡桃醌的NGM 中,每隔1 h 统计一次线虫的生存情况,直到线虫全部死亡。
1.2.10 线虫体内ROS 及脂褐质水平测定 ROS 水平的测定:将同期化的L4 期幼虫挑到新的各组NGM上(每个平板30 条,每组3 个平板)继续干预5 d 后,用M9 缓冲溶液冲洗培养基3 次并转移至无菌离心管中,离心取上清液。从上清液中吸取50 μL 和50 μL H2DCF-DA 避光混匀加入黑色96 孔板中,在荧光显微镜下每20 min 进行1 次荧光强度测定(激发波长:485 nm,发射波长:530 nm),连续测定2 h,并以上清液蛋白质浓度进行相对荧光强度标准化。
脂褐质水平的测定[25]:将同期化的L4 期幼虫挑到相应的NGM 上(每个平板30 条,每组3 个平板)继续干预7 d 后,以1%叠氮化钠溶液作麻醉剂麻醉各组线虫,随即转移到2%琼脂糖凝胶垫片上,并在激发波长365 nm、发射波长420 nm 下用荧光倒置显微镜、单色数码相机以及Image J 获取荧光图像。
1.2.11 线虫体内抗氧化酶活性和MDA 水平的测定将同期化后生长到L4 期的线虫转移到各组NGM上,分别继续干预5 d 后,用M9 缓冲溶液冲洗2 次培养皿并将各板上的成虫收集到无菌离心管中。冷冻研磨后离心,收集上清液后制成5%的线虫匀浆,分别按照试剂盒测定CAT、SOD、GSH-Px 活力及MDA 与GSH 含量,并以上清液蛋白质浓度进行标准化[26]。
1.3 数据处理
2 结果与分析
2.1 SILAE 基本活性成分的含量
表1 是SILAE 中总糖、总酚、蛋白质和总黄酮含量的比重。由表1 可知,在所测定的四个指标中,总糖的含量最高,占34.70%±2.30%,依次分别是总酚、蛋白质和总黄酮。

表1 SILAE 中活性成分含量Table 1 Content of active ingredients in SILAE
2.2 SILAE 对线虫寿命的影响
衰老是一种与时间依赖性损伤、细胞稳态衰退和功能能力下降的生理过程,其特征主要是线粒体功能障碍、细胞衰老、蛋白质平衡丧失和营养传感失调等,最终会导致死亡易感性的增加[27]。因此,抗衰老研究中的寿命长度可作为老化的评价指标。
本研究以VC为阳性对照,探究了低、中、高(5、10、15 mg/mL)剂量的SILAE 对线虫寿命的影响,结果如图1 和表2 所示。由图1 可知,与空白组相比,不同剂量的SILAE 使线虫的生存曲线明显右移,延长了寿命,尤其是低、中剂量组。由表2 可知,空白组线虫的平均寿命为9.86±0.93 d,阳性对照组线虫的平均寿命为10.60±0.23 d,低剂量组线虫的平均寿命较二者分别延长了59.3%和48.2%,中剂量组则分别提高了30.2%和21.1%,高剂量组也提高了21.4%和12.9%。由此可见,SILAE 延长线虫健康寿命的效果优于阳性对照VC。

图1 SILAE 对线虫寿命的影响Fig.1 Effect of SILAE on life span of C.elegans

表2 SILAE 对线虫平均寿命和最长寿命的影响Table 2 Effects of SILAE on average and maximum life span of C.elegans
综上,不同浓度的SILAE 虽然不同程度地延长了线虫的寿命,但却呈现剂量依赖地缩短了寿命的延长。这种剂量反应效应与甾体皂甙Shatavarin IV[28]、柚皮苷[29]和番茄碱[30]一致,即延长寿命的作用在较高浓度下被降低了。这可能是因为高浓度的SILAE 作为一种压力刺激引发了一种类似于毒物兴奋效应的现象,进而降低SILAE 的正向保护作用[31]。另外,较高浓度的SILAE 可能还抑制了线虫体内的线粒体分裂融合蛋白导致线粒体功能障碍,使线粒体中的超氧阴离子自由基等ROS 累积增多,进而引发氧化应激并损伤细胞,细胞增殖受到抑制而降低了寿命的延长[32-33]。
2.3 SILAE 对线虫运动能力的影响
机体衰老通常伴随着各项生理机能的衰退,包括引起机体肌肉的退化而导致其运动能力随着寿命的延长而降低[34]。图2 表明了SILAE 对第4、8、12、16、20、24 d 线虫运动能力的影响:在线虫寿命的早期阶段(第4 d 和第8 d),各组均有70.0%以上的线虫处于A 状态,较为活跃,其中保持在A 状态的SILAE 各组线虫高于空白组和阳性对照组;与早期线虫相比,第12 d 时,除了低剂量组(5 mg/mL)仍有接近50.0%的线虫保持在A 状态,其余各组线虫大都处于B 状态,其中中、高剂量组和阳性对照组分别有66.7%、56.2%、61.5%的线虫处于B 状态,与空白组比分别提高了33.3%、50%、33.3%。黄少杰等[35]的研究发现,铁皮石斛多糖对处于生命早期的线虫的运动能力影响并不显著,这与本实验结果类似。而在第16、20 d 时,处于A 状态的线虫比例出现上升(与第12 d 比),推测出现这种情况的原因可能是从第12 d 存活下来的线虫生存能力较强。直到寿命的末期(第24 d),仅有SILAE 组线虫存活。可见,SILAE 在延长线虫寿命的同时,还能有效延缓肌肉的退化,提高其运动能力。

图2 SILAE 对线虫运动能力的影响Fig.2 Effect of SILAE on athletic ability of C.elegans
2.4 SILAE 对线虫产卵量的影响
衰老研究发现,寿命延长的代价通常是生殖能力的降低或丧失[36-37],但也有研究报道表明寿命的延长并不影响线虫的生殖能力[38-39]。因此,本研究通过测定产卵量来评价SILAE 在延长线虫寿命的同时是否会损害其生殖能力,结果如图3 所示。由2.2 可知,低剂量(5 mg/mL)的SILAE 能显著延长线虫寿命,但由图3 可知该组线虫的产卵量与空白组无显著性差异(P>0.05),即寿命的延长,没有影响低剂量组线虫的生殖能力。而中、高剂量组线虫的总产卵量均高于空白组产卵量,存在高度显著的差异性(P<0.001)。另外,高剂量组线虫的生殖能力亦极显著高于阳性对照组(P<0.01)。由此可见,SILAE 在延长线虫寿命的同时,不会损伤线虫的生殖能力,且在一定浓度范围内能提高线虫的生殖能力,符合对抗衰老物质的需求。

图3 SILAE 对线虫产卵量的影响Fig.3 Effect of SILAE on oviposition of C.elegans
2.5 SILAE 对线虫应激能力的影响
H2O2是胞内最常见的一种活性氧,会触发细胞脂质过氧化反应而产生自由基,进而引起急性氧化损伤[40]。图4 表明,在H2O2急性应激实验中,空白组线虫的最长存活时间为2 h,低、中、高剂量和阳性对照组线虫的存活时间分别被延长至4、7、6 和7 h,且生存曲线较空白组均有明显右移。有报道发现[41],中、高剂量的玫瑰类黄酮能显著提高线虫在H2O2应激环境中的存活率。因此,本实验结果表明,SILAE不同程度地缓解了H2O2引起的氧化应激对线虫造成的损伤,延长其存活率,且与阳性对照无显著性差异。
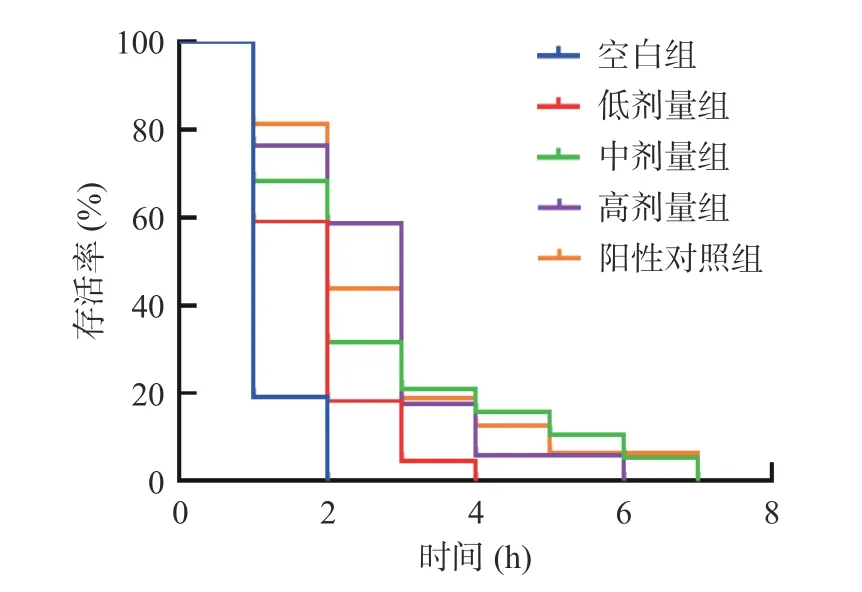
图4 H2O2 急性氧化应激损伤线虫的寿命曲线Fig.4 Lifespan curves of C.elegans with H2O2-induced acute oxidative stress
本研究还用细胞内活性氧发生器—胡桃醌[42],评估了SILAE 对线虫氧化应激耐受性的影响,结果如图5 所示。由表3 可知,低、中、高剂量组线虫的寿命较空白组分别延长了41.7%、58.3%、16.7%,但与阳性对照组无显著性差异。其中,低、中剂量组线虫的生存能力显著高于空白组线虫(P<0.05)。

图5 胡桃醌氧化应激损伤线虫的寿命曲线Fig.5 Lifespan curves of C.elegans with jutaquinone oxidative stress
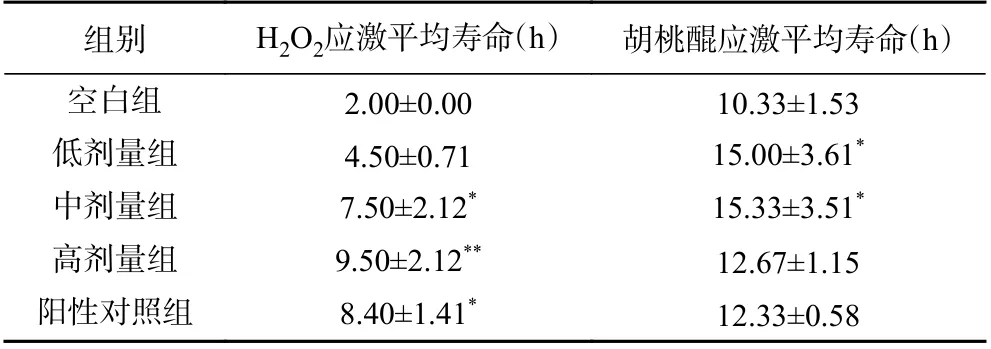
表3 SILAE 对线虫应激能力的影响Table 3 Effect of SILAE on stress ability of C. elegans
以上结果说明,一定浓度范围内的SILAE 在过氧化氢应激、胡桃醌等急性氧化应激环境下对线虫有一定的保护作用,能延长线虫寿命。
2.6 SILAE 对线虫体内ROS 及脂褐质水平的影响
过量的ROS 会诱导氧化应激并损害脂质、蛋白质和核酸等生物大分子,导致许多疾病的发生,如炎症、衰老和癌症等[43-44]。由图6 和图7 可知,线虫体内ROS 水平随时间的延长而增加,在120 min 时,SILAE 各剂量组线虫体内的ROS 相对水平较空白组有极显著降低(P<0.001),但与阳性对照无显著性差异。这表明,SILAE 能有效清除线虫体内的ROS,降低ROS 对线虫的氧化损伤,提高其生存能力。

图6 SILAE 对线虫体内ROS 相对水平的影响Fig.6 Effect of SILAE on ROS levels in C.elegans

图7 SILAE 对线虫体内ROS 相对水平的影响(120 min)Fig.7 Effect of SILAE on ROS levels in C.elegans (120 min)
脂褐质是一种能自发荧光的黄褐色物质,其沉积量与荧光强度成正比,细胞成分的氧化降解和自噬会促进脂褐质的形成[45]。而随着寿命的延长,脂褐质会在线虫体内沉淀并损伤组织细胞,加速衰老[45-46]。因此,脂褐质可作为衰老的生物标志物。如图8 所示,与空白组相比,SILAE 各剂量组以剂量依赖的方式极显著地降低了线虫体内的脂褐质水平(P<0.001),其中高剂量组(15 mg/mL)线虫体内的脂褐质水平较空白组降低了56.1%。此外,经中、高剂量SILAE 喂养的线虫,其体内的脂褐质水平与阳性对照组VC无显著性差异。由此可见,SILAE 能有效减少脂褐质在线虫体内的积累,降低脂褐质堆积造成的细胞成分的氧化降解,延缓氧化损伤并延长线虫寿命。
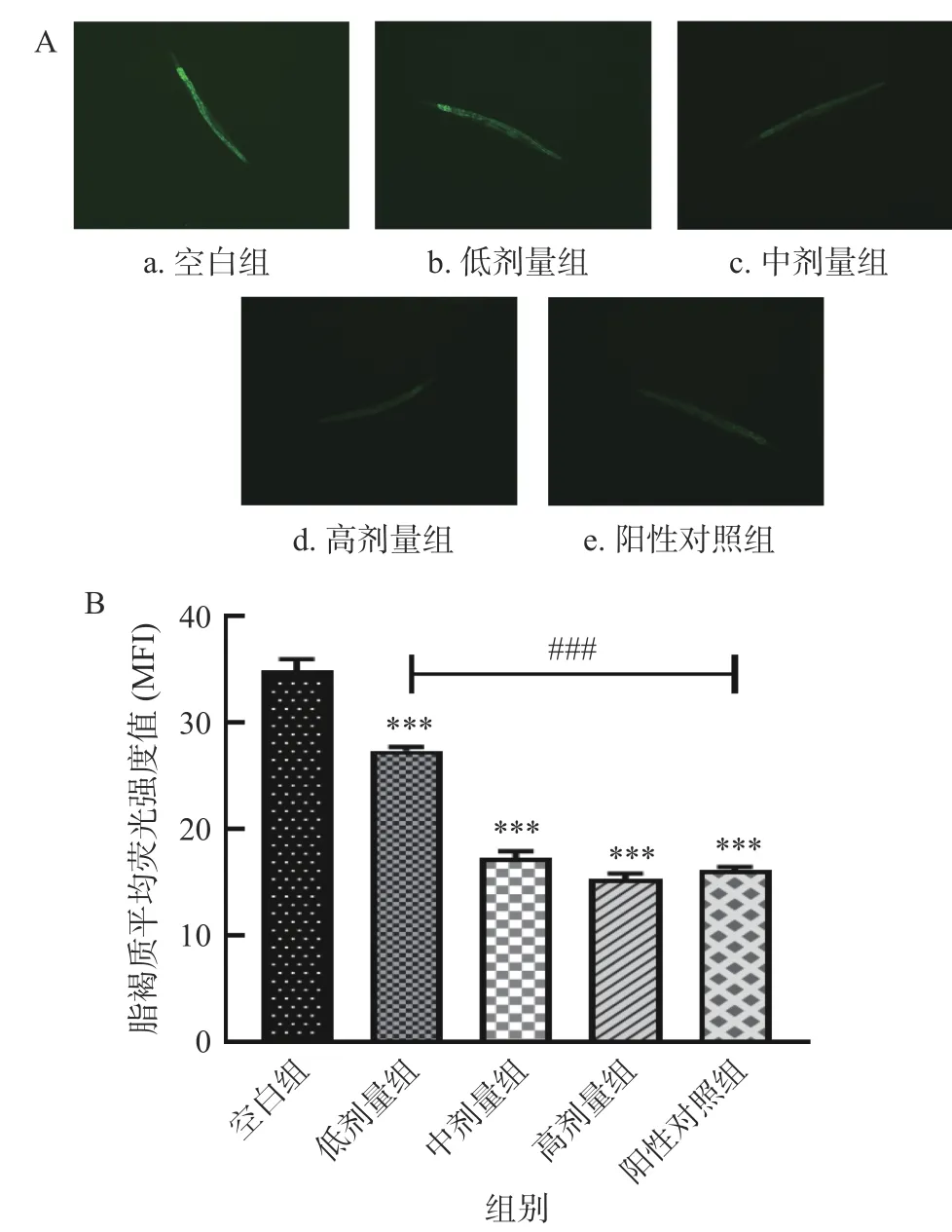
图8 SILAE 对线虫脂褐质水平的影响Fig.8 Effect of SILAE on lipofuscin levels in C.elegans
2.7 SILAE 对线虫体内抗氧化系统和MDA 含量的影响
抗氧化防御系统作为机体具有抗氧化能力的重要组成部分,其复杂的酶和非酶抗氧化剂可通过抵消总ROS 水平来维持生理稳态[47]。该系统涉及了包括SOD、CAT 和GSH-Px 在内的多种酶系统,以及由谷胱甘肽、维生素E 等组成的非酶抗氧化剂,它们通过直接淬灭自由基、清除过氧化物质或螯合金属离子参与抗氧化[48]。MDA 是氧化应激的重要生物标志物,也是ROS 引发的主要脂质过氧化物[49]。因此,为了评价SILAE 对线虫内源性抗氧化防御系统的影响,本研究测定了抗氧化酶(SOD、CAT 和GSH-Px)的活性以及非酶抗氧化剂(GSH)的含量,并对线虫体内的MDA 含量进行了测定。
提高SOD 活力有助于将超氧阴离子转化为H2O2,而H2O2又是CAT 和GSH-Px 的底物,CAT 能将H2O2代谢分解成水和氧气,GSH-Px 则是在与非酶抗氧化剂GSH 反应时减少H2O2和有机氢过氧化物[50]。由图9 可知,经SILAE 干预的线虫,其体内的SOD 活力较空白组有高度显著差异(P<0.001),都提高了约2 倍,但与阳性对照无显著性差异;CAT 活力较空白组分别提高了66.8%、60.3%、125.6%,其中高剂量组线虫体内的CAT 活力与VC组具有显著性差异(P<0.05);中剂量组(10 mg/mL)线虫中的GSH-Px 活力极显著提高了95.5%,且与VC组也存在极显著差异(P<0.01)。而非酶抗氧化剂GSH 在中剂量组线虫体内的含量也极显著高于空白组(P<0.01),且显著高于VC组。此外,如图10 所示,SILAE 各剂量组线虫中的MDA 含量较空白组均有显著下降(P<0.05),但与阳性对照无显著性差异。
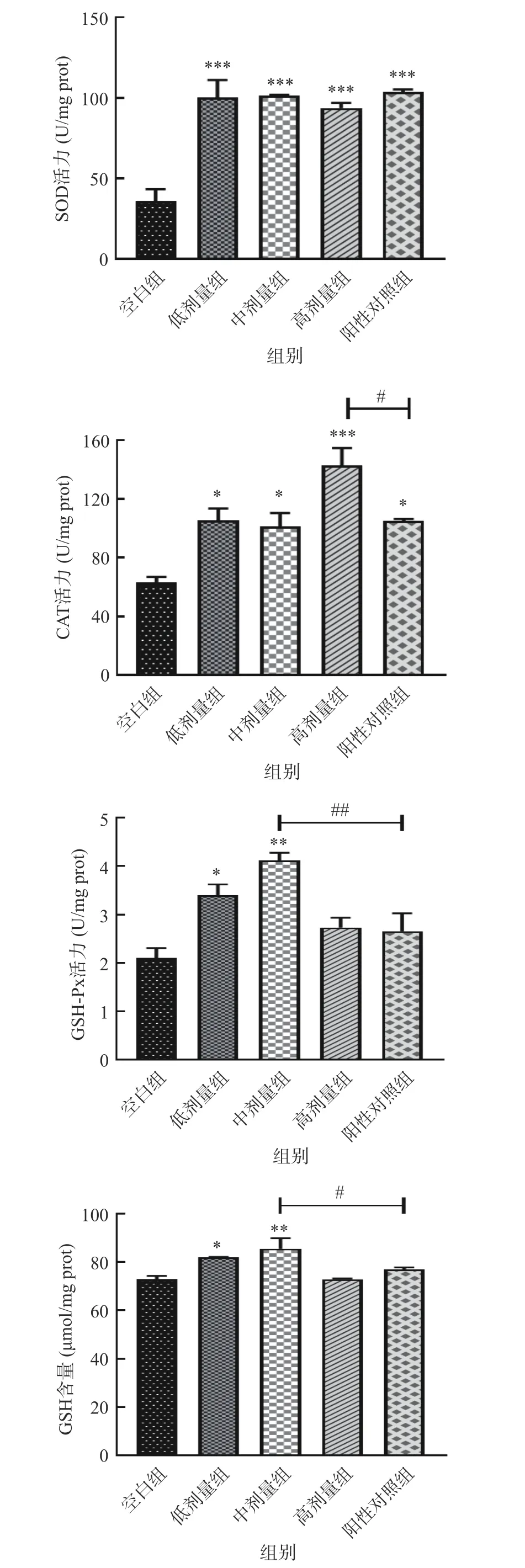
图9 SILAE 对线虫体内抗氧化防御系统的影响Fig.9 Effect of SILAE on antioxidant defense system in C.elegans

图10 SILAE 对线虫体内MDA 含量的影响Fig.10 Effect of SILAE on MDA content in C.elegans
这些数据表明,SILAE 能有效提高线虫体内酶和非酶物质的抗氧化活性,增强其对氧化应激的响应和防御能力,降低体内MDA 等氧化产物的含量,进而减缓衰老过程中过氧化反应对线虫造成氧化损伤,提高其生存能力,延长线虫寿命。
3 结论
基于衰老的自由基理论,本文以秀丽隐杆线虫为模型生物,相对完整地评价了SILAE 对线虫寿命及与年龄相关的生理机能、抗氧化应激能力、抗氧化防御系统的影响。结果表明,SILAE 以不损伤线虫生殖能力的方式延长了其寿命,并在一定剂量范围内还能有效提高其生殖能力和运动能力。SILAE 也提高了线虫体内的抗氧化酶SOD、CAT 和GSH-Px 的活力和非酶抗氧化剂GSH 的含量。此外,SILAE 还能有效降低线虫体内的ROS 水平及其引发的氧化应激产物—脂褐质和MDA 的水平,提高线虫的氧化应激抵抗力,降低由此引发的氧化损伤。
综上,SILAE 可能通过捕获并猝灭线虫体内的活性氧和降低不利于健康长寿的物质含量,增强线虫的氧化应激抵抗能力和抗氧化能力并提高生活质量,延长了健康寿命。因而,SILAE 有可能成为一种潜在的膳食补充剂和具有抗氧化衰老特性的替代药物。本实验也为天然植物抗氧化剂在功能食品中的进一步研究和应用提供了新的来源和理论参考。

