养生代餐粉的熟化工艺筛选与抗抑郁功能评价
蒲莲莲,杨 颖,刘 漫,嵇 晶,程建明,刘陶世
(南京中医药大学药学院,江苏省经典名方工程研究中心,江苏南京 210023)
代餐粉是一种常见冲调粉剂的食品形式,通常由一种及以上的原辅料粉调配而成,一般要求营养均衡,方便食用,饱腹感强,口感、风味俱佳。近年来,随着社会发展以及中医药文化的传播普及,养生、保健需求增加,功能性食品市场及相关研究也越来越火爆。在中医药理论指导下,加入药食两用中药,利用食物特性来调节机体功能,获得健康或是预防治疗疾病的代餐食品应运而生,代餐粉便是其中较受欢迎的一种。市场常见的养生性代餐粉主要有降血糖、降血压、降血脂、抗氧化、调节免疫力及慢性脾胃病的治疗等[1]。
在制备工艺方面,代餐粉原料的加工处理较为简单,一般只需熟化、粉碎即可。代餐粉的原料多为谷物类,富含淀粉,其熟化是一种淀粉充分糊化的过程,谷物经熟化处理后,可改善其冲调性和风味品质。主要熟化工艺有蒸煮、微波、烘烤、炒制、挤压膨化等,不同种类的食物经过不同工艺熟化,其品质也有所不同。在产品的研发生产中,应根据不同需求选择最佳熟化工艺,最大程度发挥药食两用中药的价值[2]。
抑郁症是21 世纪人类所面临的一种常见疾病,患者一般可见兴趣索然、情绪低落、思维迟缓,常伴随失眠、饮食不振等症状,严重者产生自伤、自杀念头及行为[3-4]。研究表明一些药食两用中药可通过调节机体单胺递质或炎性因子水平,或调理脾胃来改善抑郁症状[5-6]。临床常用甘麦大枣汤、百合鸡子汤等加减[7-8],其组成多为药食两用中药,开发为食疗产品多为传统药物剂型,功能、形式单一,如甘麦大枣汤颗粒剂。本研究以甘麦大枣汤与健脾类中药组成的代餐粉为研究对象,实验筛选代餐粉制备的熟化工艺,并对代餐粉的抗抑郁功能进行评价,为药食两用中药的熟化制备及相关抗抑郁产品的的研发提供理论依据和技术指导。
1 材料与方法
1.1 材料与仪器
Babl/c 雄性小鼠 32 只,体质量18~20 g,上海斯莱克实验动物有限责任公司,生产许可证号SCXK(沪)2022-0004,适应性喂养7 d,自由饮食和饮水,南京中医药大学实验动物伦理委员会审查并批准(202207A062);莲子、薏苡仁、山药等 安徽亳州中药材市场;NaOH、NaNO2、KCl、KH2PO4、NaCl、MgCl2.6H2O、(NH4)2CO3、CaCl2·2H2O、苯酚、3,5-二硝基水杨酸等 国药集团化学试剂有限公司;甲醇
广东光华科技股份有限公司;乙醇 无锡市亚盛化工有限公司;硫酸(95%~98%) 西陇科学股份有限公司;胃蛋白酶(1:3000)、糖化酶(100000 U/g)、三号胆盐 北京Solarbio 公司;胰酶(1:4000) 上海瑞永生物科技有限公司;葡萄糖标准品(99%)、芦丁标准品(99%) 上海源叶生物科技有限公司;盐酸氟西汀 上海上药中西制药有限公司;生理盐水四川科伦药业股份有限公司;脂多糖(LPS) LPS Biosharp 公司;ELISA 试剂盒 南京翼飞雪生物科技有限公司。
MC-HW2210 型电陶炉 广东美的生活电器制造有限公司;WP700(MS-2030T)微波炉 韩国LG公司;TGF-9140A 型鼓风干燥箱 上海喆图科学仪器有限公司;YL100L-4 型家用小型挤压膨化机 曲阜鸿旭机械有限公司;TGL-16R 型高速离心机 山东百欧医疗科技有限公司;DK-98-Ⅱ型恒温水浴锅
江苏金怡仪器科技有限公司;FW100 型高速粉碎机 天津市泰斯特仪器有限公司;85-2A 型磁力搅拌器 金坛区西城新瑞仪器厂;KH-300E 型超声波清洗器 昆山禾创超声仪器有限公司;SY-2230 型恒温水浴摇床 美国Crystal 公司;T6 型新世纪紫外分光光度计 北京普析通用仪器有限责任公司。
1.2 实验方法
1.2.1 熟化处理
1.2.1.1 蒸煮熟化 称取(50±0.5)g 混合中药饮片(莲子14%,薏苡仁18%,山药10%,赤小豆14%,淮小麦30%,绿豆14%,下同),根据前期预实验对浸泡和蒸煮时间的筛选结果,以感官评分为标准,按照最佳蒸煮熟化工艺熟化:将中药饮片浸泡30 min,蒸煮15 min,70 ℃烘干,取出放冷,粉碎,过筛(100 目),备用。
1.2.1.2 炒制熟化 称取(50±0.5)g 混合中药饮片,根据前期预实验对炒制火力、炒制时间的筛选结果,以感官评分为标准,按照最佳炒制熟化工艺熟化:粉碎,过筛(40 目),火力600 W,翻炒5 min,倒出放冷,粉碎,过筛(100 目),备用。
1.2.1.3 微波熟化 称取(50±0.5)g 混合中药饮片,根据前期预实验对含水量和微波时间的筛选结果,以感官评分为标准,按照最佳微波熟化工艺熟化:粉碎,过筛(40 目),将水均匀喷洒于中药粉末,搅拌均匀,密封静置4 h,待充分吸收后测定其水分,高火微波5 min,取出放冷,粉碎,过筛(100 目),备用。
1.2.1.4 烘烤熟化 称取50(±0.5)g 混合中药饮片,根据前期预实验对含水量和烘烤时间的筛选结果,以感官评分为标准,按照最佳烘烤熟化工艺熟化:粉碎,过筛(40 目),将水均匀喷洒于中药粉末,搅拌均匀,密封静置4 h,待充分吸收后测定其水分,150 ℃烘烤20 min,取出放冷,粉碎,过筛(100 目),备用。
1.2.1.5 挤压膨化熟化 称取(50±0.5)g 混合中药饮片,根据前期预实验对含水量、机筒温度、喂料速度的筛选,按照最佳挤压膨化工艺熟化:粉碎,过筛(10 目),将水均匀喷洒于中药粉末,搅拌均匀,密封静置4 h,待充分吸收后测定其水分,170 ℃、240 r/min(转速)、60 g/min(喂料速度)挤压膨化,放冷,粉碎,过筛(100 目),备用。
1.2.2 体外消化
1.2.2.1 模拟胃液 配比:0.51 g/L KCl,0.12 g/L KH2PO4,2.10 g/L NaHCO3,2.76 g/L NaCl,0.02 g/L MgCl2(H2O)6,0.05 g/L (NH4)2CO3,0.02 g/L CaCl2(H2O)2和4000 U/mL 胃蛋白酶,以纯水配制[9-10]。
1.2.2.2 模拟小肠液 配比:0.51 g/L KCl,0.11 g/L KH2PO4,7.14 g/L NaHCO3,2.24 g/L NaCl,0.07 g/L MgCl2(H2O)6,1.11g/L CaCl2(H2O)2,2 mg/mL 胰酶,5 mg/mL 胆盐和5 mg/mL 糖化酶,以纯水配制[9-10]。
1.2.2.3 模拟体外胃肠道消化 将1 g 样品与10 mL模拟胃液混合均匀,并用1 mol/L 盐酸迅速调节pH至3.0±0.2,放入39 ℃水浴振荡锅中进行胃消化1 h。胃消化结束后,向反应体系中加入20 mL 模拟小肠液,混合均匀,并用1 mol/L 的NaOH 迅速调整pH 至7.0±0.2,继续在39 ℃水浴振荡锅中进行肠消化2 h。分别在消化0、20、60、90、120、180 min 时取样,灭酶,DNS 法测定不同时间下葡萄糖的含量[11]。
1.2.2.4 消化指标测定 a.消化前样品葡萄糖的提取:分别称取1.5 g 消化前各样品,少量水调成均匀糊状,再加入25 mL 水,混匀,50 ℃水浴20 min,使葡萄糖浸出。8500 r/min 离心15 min,用10 mL 水洗涤残渣,离心,合并两次上清液,定容至50 mL,混匀,作为葡萄糖提取液待测[11-12]。
b.葡萄糖标准曲线的建立:分别精密量取0、0.2、0.4、0.6、0.8、1.0 mL 1 mg/mL 的葡萄糖标准品溶液于25 mL 具塞玻璃试管中,加水至2 mL,加入1.5 mL DNS 试剂(配制一周后使用),摇匀,沸水浴10 min,取出冷却至室温,水定容至25 mL,摇匀,于540 nm 处测定吸光度,标准曲线方程为y=14.643x+0.002,R2=0.999。
c.样品中淀粉的测定:将葡萄糖标准液换为消化前各样品提取液及不同消化阶段消化液,依照“1.2.2.4 b”项下方法测定样品中淀粉含量。计算样品水解率和快消化淀粉(RDS)、慢消化淀粉(SDS)、抗性淀粉(RS)的含量。
式中,Gt 为样品体外消化t min 后产生的葡萄糖含量;G20 为样品消化20 min 后产生的葡萄糖含量;G120 为样品消化120 min 后产生的葡萄糖含量;FG 为消化前样品中葡萄糖含量;TG 为总葡萄糖释放量;TS 为总淀粉含量;m 为样品质量。
1.2.3 理化指标测定
1.2.3.1 水溶性指数(WSI)及吸水性指数(WAI) 称取2 g 样品(m1),加入25 mL 水,振荡、搅拌使样品完全分散于水中,30 ℃水浴中保持30 min,每隔5 min 振摇30 s,取出,5000 r/min 离心15 min,合并上清液倒人已恒重的蒸发皿中(m2),105 ℃干燥箱烘干至恒重(m3),并称量沉淀的重量(m4)[13]。
1.2.3.2 离心沉淀率(SR) 将样品以5 倍量的75 ℃热水进行冲调,称量样品糊重量m1,8000 r/min 离心20 min,弃去上清液,称量沉淀的重量m2[14]。
1.2.3.3 分散性 在200 mL 烧杯中加入100 mL水,置磁力搅拌器上,温度70 ℃,转速500 r/min。称取1.5 g 样品,均匀快速地加入上述烧杯中,并从样品加入开始计时,至样品分散均匀时终止计时,该段时间即为分散时间[15]。
1.2.3.4 润湿性 在250 mL 烧杯中加入50 ℃的200 mL 水,称取0.5 g 样品,均匀散布于水面,记录样品从加入至全部沉降所需时间[16]。
1.2.3.5 总多糖 a.葡萄糖标准曲线的建立:分别精密量取0、0.2、0.4、0.6、0.8、1.0 mL 的葡萄糖标准品溶液(1 mg/mL),置25 mL 具塞玻璃试管中,加入1 mL 5%苯酚溶液,摇匀,加入5 mL 浓硫酸,摇匀,加水稀释至25 mL,迅速沸水浴15 min,取出冷却至室温,于490 nm 处测定吸光度,标准曲线方程为y=13.955x-0.0138,R2=0.996[17]。
b.样品中总多糖测定:称取各样品粉末1 g,加入30 mL 水,水浴2 h,离心,精密量取1 mL 上清液,加入4 倍量乙醇,摇匀,4 ℃静置过夜,离心,弃去上清液,沉淀用5 mL 水溶解,摇匀,照“1.2.3.5 a”项下方法测定。
1.2.3.6 总黄酮 a.芦丁标准曲线的建立:分别精密量取0、1、2、3、4、5、6 mL 浓度为0.2968 mg/mL的芦丁甲醇溶液,置25 mL 具塞玻璃试管中,加入1 mL 5%(g/mL)NaNO2溶液,摇匀,静置6 min,加入1 mL 10%(g/mL)Al(NO3)3,摇匀,静置6 min,加入10 mL 2%(g/mL)NaOH,加水定容至25 mL,摇匀,40 ℃水浴30 min,于510 nm 处测定吸光度,标准曲线方程为y=11.841x-0.0124,R2=0.999[18]。
b.样品中总黄酮测定:称取各样品1 g,加入25 mL 甲醇,超声(250 W,40 kHz)提取30 min,离心(5000 r/min,10 min),取上清液,照“1.2.3.6 a”项下的方法测定。
c.消化液中总黄酮测定:精密量取各阶段消化液1 mL,乙醇灭酶,离心,取上清液,照“1.2.3.6 a”项下的方法测定。
1.2.4 动物实验
1.2.4.1 供试品制备 根据前期预试验,该代餐粉配方为中药提取物20%(甘草16%,大枣42%,山楂18%,枸杞24%,四味药加水煎煮两次,第一次10 倍水50 min,第二次8 倍水40 min,滤过,合并滤液,浓缩,干燥即得)与混合中药熟化粉80%(莲子14%,薏苡仁18%,山药10%,赤小豆14%,淮小麦30%,绿豆14%,按“1.2.1.4”方法熟化即得)组成。以水为溶剂,制备为1 g/mL 的混悬液。
1.2.4.2 分组及给药 小鼠于22 ℃、相对湿度50%、昼夜比12/12 的环境下适应性喂养7 d 后,随机分为空白组、模型组、盐酸氟西汀组、养生代餐粉组,每组8 只小鼠。阳性药盐酸氟西汀以生理盐水配制为2 mg/mL 的药物溶液。各组小鼠均灌胃给药,1 d 2 次(隔12 h)连续给药7 d。空白组、模型组灌胃纯水,其他组灌胃各组对应药物,灌胃体积均为10 mL/kg。
1.2.4.3 急性抑郁造模方法 在实验第8 d,以LPS腹腔注射方式造模[19-20]:除空白组外,各组小鼠腹腔注射LPS 溶液(0.83 mg/kg),给药体积10 mL/kg,空白组注射等体积生理盐水。4.5 h 后开始行为学检测,评价小鼠抑郁症状。造模6 h 后,眼眶取血,静置1 h 后离心取血清,-20 ℃保存;取血后颈椎脱臼法处死小鼠,断头取脑,-80 ℃保存。
1.2.4.4 行为学检测方法
1.2.4.4.1 悬尾实验 在小鼠尾尖约2 cm 处固定,将小鼠头朝下悬挂于一四周封闭纸箱内6 min,距离底部约10 cm,记录小鼠2~6 min 内的累计不动时间。1.2.4.4.2 强迫游泳实验 将小鼠置于一直径10 cm,水深20 cm 容器内,水温24 ℃左右,观察6 min 内小鼠游泳情况,记录小鼠2~6 min 内的累计不动时间。
1.2.4.5 小鼠外周血清IL-1β、TNF-α、5-HT、NE 含量检测 采用ELISA 法检测TNF-α、IL-1β、5-HT、NE 的含量,实验步骤按试剂盒方法操作。
1.2.4.6 小鼠脑组织BDNF 含量检测 采用ELISA法检测BDNF 的含量,实验步骤按试剂盒方法操作。
1.3 数据处理
所有实验均重复3 次,实验结果以平均值±标准差表示。采用WPS Ofice 2019 和SPSS 26 软件进行实验数据处理及统计学分析;采用OriginPro 2022软件作图。
2 结果与分析
2.1 不同熟化工艺对中药混合粉水溶性指数(WSI)及吸水性指数(WAI)的影响
WSI 可反映样品中淀粉颗粒的降解度,降解度大则说明淀粉释放易被人体消化吸收的可溶性小分子物质(糊精、葡萄糖等)含量高,WAI 则与样品中淀粉的糊化程度密切相关,体现的是样品中大分子物质的吸水能力[21]。综合参考,这两个指标可用于样品粉末冲调特性的评价。
由图1 可知,与未处理组相比,除蒸煮组外,其他各组WSI 值均在10%以上,且具有显著性差异(P<0.05),其中挤压膨化组(34.35%)是其他各组的3 倍及以上;蒸煮组WSI 值较其他组低,可能是蒸煮过程中,可溶性成分溶于水中。与未处理组比较,各组WAI 值均有明显提升,其中挤压膨化组达3.18 g/g;膨化时螺杆挤压使样品中的淀粉、蛋白质等在高温、高压、高剪切作用下与水瞬时反应,产生更多的亲水基团[22],从而使样品吸水性增加;同时样品中淀粉、纤维素等大分子发生降解,可溶性小分子物质含量增加,使物料水溶性提高[23-24]。因此,从营养物质的吸收及冲调性能来看,挤压膨化工艺较适合代餐粉的熟化。
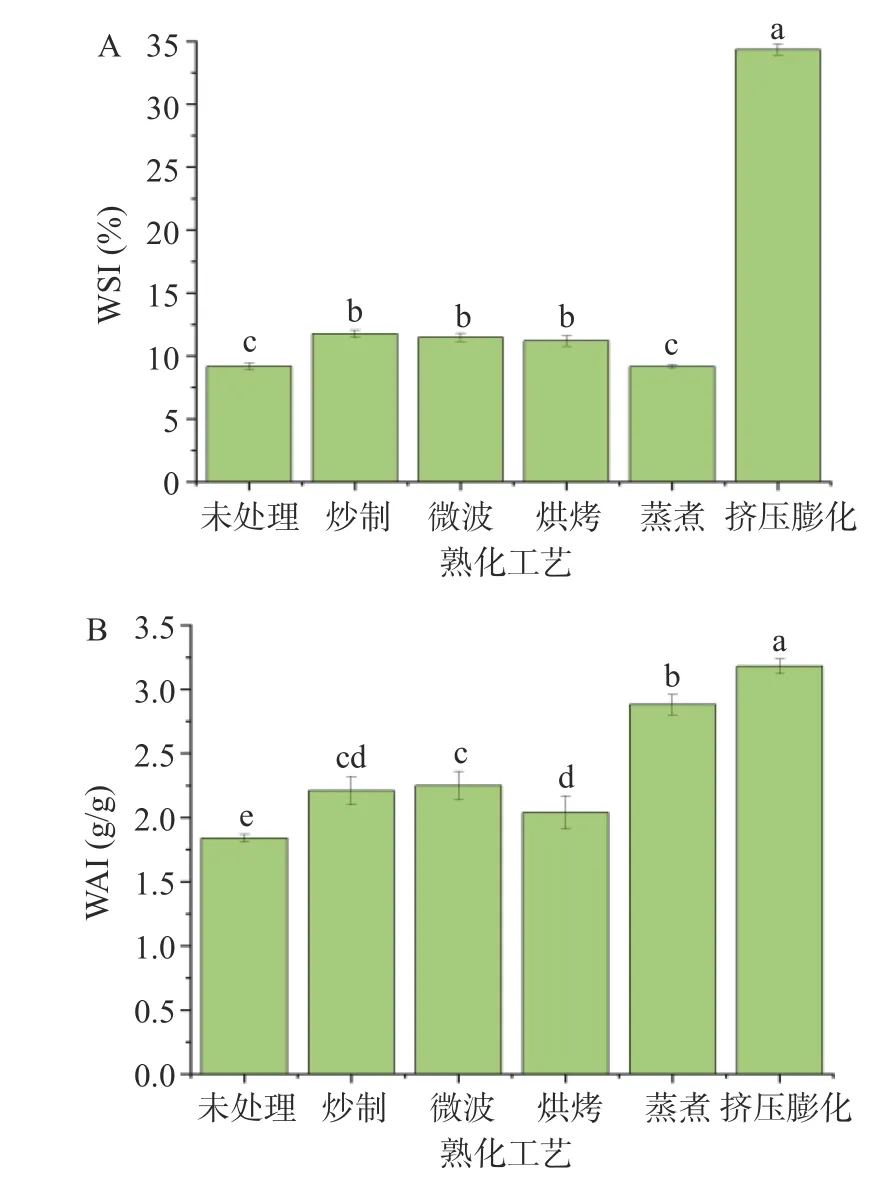
图1 不同熟化工艺中药混合粉WSI、WAI 值Fig.1 WSI、WAI of TCM powder with different curing processes
2.2 不同熟化工艺对中药混合粉离心沉淀率(SR)的影响
SR 表示样品在水中难以溶解的部分,能够反映样品的冲调稳定性,一般来讲,离心沉淀率越小则代表样品在水中的稳定性越好。由图2 可知,与未处理组(31.9%)比较,烘烤组SR 值(27.72%)显著减小(P<0.05),其他各组SR 值则明显增加,其中挤压膨化组达52.16%。这可能与样品吸水性相关,挤压膨化工艺使样品吸水性大大增加,导致样品SR 增大。从样品冲调稳定性来看,则烘烤工艺更适合代餐粉熟化。
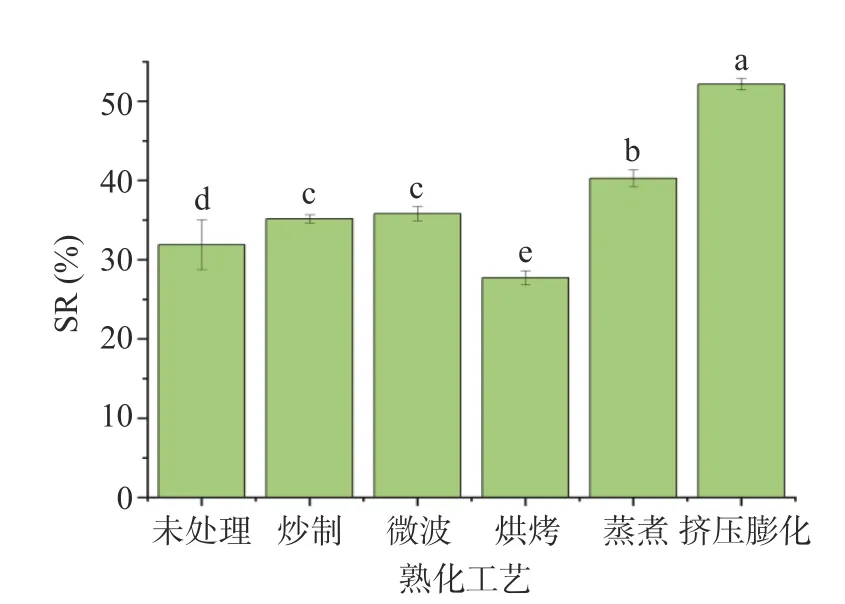
图2 不同熟化工艺中药混合粉离心沉淀率Fig.2 SR of TCM powder with different curing processes
2.3 不同熟化工艺对中药混合粉分散性、润湿性的影响
不同熟化工艺处理的样品分散性、润湿性见图3。总体而言,与未处理组相比,除挤压膨化组外,各组变化差异不大;挤压膨化组分散及润湿时间为184.12 s、195.02 s,是其他各组的几十倍。猜测原因可能是挤压时将样品中的油脂类物质挤出,包裹于粉体表面,导致疏水性增加,从而使分散及润湿时间变长,分散性和润湿性下降。分散性、润湿性影响代餐粉的冲调,综上,炒制、微波、烘烤等较挤压膨化适合代餐粉的熟化。

图3 不同熟化工艺中药混合粉分散性、润湿性Fig.3 Dispersibility and wettability of TCM powder with different curing processes
2.4 不同熟化工艺对样品总多糖、总黄酮含量的影响
由图4 可知,各组总多糖含量均显著高于未处理组(4.23 mg/g,P<0.05),特别是烘烤和挤压膨化组分别为25.37、32.2 mg/g。未处理前,淀粉与不溶性蛋白质、纤维等紧密结合,熟化加工则破坏这种结合,使其淀粉充分释放,从而使总多糖含量增加[25]。此外,挤压膨化组总多糖含量显著高于其他组,可能是因为挤压膨化使样品结构疏松,高温、高压使糖类及其衍生物从植物细胞壁上释放、酸性多糖含量增加,加大了淀粉降解和糊化程度[11]。而蒸煮组总多糖显著低于其他工艺,但仍高于未处理组,可能是由于蒸煮过程中部分多糖溶于水。

图4 不同熟化工艺中药混合粉总多糖、总黄酮含量Fig.4 Content of total polysaccharides and total flavonoids in TCM powder with different curing processes
由图4 可知,挤压膨化组总黄酮含量(0.62 mg/g)略低于未处理组(0.64 mg/g),其他组均显著高于未处理组(P<0.05),特别是烘烤组达1.09 mg/g。黄酮类成分多存在于细胞液中,一定范围内对热稳定,加热处理可破坏细胞膜使其更易溶出[26]。而挤压膨化可能在挤压过程中温度过高,导致热敏性游离黄酮损失,同时结合态黄酮部分水解使游离黄酮增加,但对游离黄酮的降解仍占主导作用,因此,总黄酮含量降低[27]。
总多糖、总黄酮既属于功效活性物质也是营养成分,熟化处理后从两者含量考虑,烘烤及挤压膨化工艺较适合代餐粉的熟化。
2.5 不同熟化工艺对样品消化特性的影响
由图5 可知,消化60~120 min 内淀粉水解率增长较快,特别是蒸煮和挤压膨化组此段增长率超过45%,说明胰酶、糖化酶等有助于淀粉消化。除烘烤工艺外,各工艺样品在消化60 min 后的阶段淀粉水解率均显著高于未处理组(P<0.05),可能是烘烤组的熟化程度较其他组低,结构紧密,再加上样品中多酚、黄酮等生物活性物质可抑制消化酶活性,延缓淀粉消化[12,28-29]。
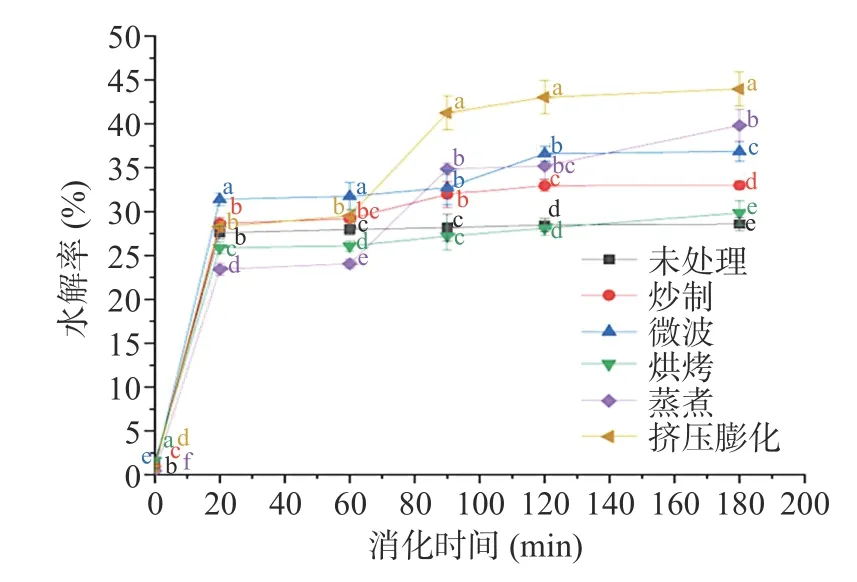
图5 不同熟化工艺对中药混合粉淀粉体外消化水解率的影响Fig.5 Effects of different curing processes on external digestion hydrolysis rate of TCM powder starch
未处理组水解率在消化20 min 后接近平衡,而各熟化处理组水解率在20 min 后仍有较大上升趋势,可能是未经处理样品结构较紧密,抗消化能力强,而经熟化后,淀粉颗粒受到损伤,酶作用机会增加[30-31],从而使熟化的样品水解率显著增高。消化90 min 后,挤压膨化组水解率(41.24%)显著高于其他各组(P<0.05),可能是高温、高压将包裹淀粉的细胞壁破坏,减弱淀粉与蛋白质、纤维等物质的作用,增加了其与消化酶的接触面积[32]。
由表1 可知,与未处理组相比,各组RDS 显著降低(P<0.05),SDS 和RS 则显著增加(P<0.05)。可能是因为熟化处理后蛋白变性,堆积于淀粉周围,降低其RDS[15];熟化处理使淀粉分子原有结构改变,分子链于无定型区交联互作,导致淀粉颗粒和分子固定化,提高了淀粉的抗消化性;并使淀粉颗粒出现团聚现象和蛋白变性,且蛋白粘附于淀粉颗粒团块的表面,抵挡了淀粉酶作用从而降低淀粉可消化性,导致SDS 增加[33-34];熟化处理可使支链淀粉侧链降解,降解后的淀粉侧链可于高温下运动、结合产生新结构,从而使RS 增加[1]。

表1 不同熟化工艺对体外淀粉消化特性的影响Table 1 Effects of different curing processes on characteristics in vitro digestion of starch
代餐粉类型不同,需求不同,养生性代餐粉通常要求具有较低的升糖指数(GI),即较低的RDS,较高的SDS 与RS。因此代餐粉的熟化应选择者蒸煮或挤压膨化。
2.6 不同熟化工艺对中药混合粉模拟体外胃肠消化总黄酮释放量的影响
由表2 可知,模拟胃消化阶段总黄酮释放量呈增加趋势;在模拟肠消化的前30 min,总黄酮迅速释放,如未处理组90 min(1.93 mg/g)总黄酮释放量是60 min(0.97 mg/g)的2 倍,这说明胰酶、胆盐等可促进黄酮的释放;随着时间延长,总黄酮释放量逐渐趋于稳定,总体呈现先升后降的趋势。原因可能是消化酶促进了类黄酮的释放,而黄酮类成分在碱性条件下易被降解或被胰酶水解,致使其含量降低[35-36]。

表2 不同熟化工艺对体外消化总黄酮释放量的影响Table 2 Effects of different curing processes on total flavone release in vitro digestion
未处理组总黄酮最大释放量为2.16 mg/g,微波组为2.47 mg/g 显著增加(P<0.05),蒸煮和挤压膨化组(1.72 和1.81 mg/g)则显著降低(P<0.05),炒制及烘烤组无明显变化。原因可能是黄酮类成分不稳定,而蒸煮样品质地松软、挤压膨化样品结构松散,在消化时更易与消化液接触,降解为其他物质。因此,炒制、微波、烘烤工艺较适合代餐粉的熟化。
根据“2.1~2.6”各实验结果,综合分析,挤压膨化与烘烤工艺在冲调性、总多糖及总黄酮含量方面各有优势,挤压膨化物质溶解性、吸水性更好,烘烤则冲调稳定性更佳。体外消化实验显示烘烤水解率较低、总黄酮最大释放量较高,抗消化性较好;但挤压膨化RDS 较低、SDS 较高,即GI 较低,更富含养生性要求。综上,挤压膨化是养生代餐粉的最优熟化工艺。
2.7 动物实验结果
2.7.1 小鼠行为学检测结果 悬尾及强迫游泳实验是两种较为经典的检测小鼠是否出现抑郁样行为的方法,主要以其“不动”为评价指标[37-38]。如图6 所示,与空白组比较,模型组悬尾及强迫游泳累计不动时间均明显延长,表明小鼠出现抑郁样行为;与模型组相比,养生代餐粉组悬尾及强迫游泳累计不动时间均显著降低(P<0.01),表明代餐粉对小鼠抑郁样行为有较好的改善效果。

图6 各组对LPS 致急性抑郁小鼠抑郁样行为的影响Fig.6 Effect of each group on depression-like behavior in LPSinduced acute depression mice
2.7.2 小鼠外周血清IL-1β、TNF-α含量结果 抑郁症的发生、发展与促炎细胞因子的中枢和外周浓度升高密切相关,机体应激后情绪、行为的改变也与炎性因子密切相关[39-40]。由图7 可知,与空白组比较,模型组小鼠外周血清中的炎性因子IL-1β、TNF-α含量均显著升高(P<0.01);与模型组相比,养生代餐粉组IL-1β、TNF-α水平明显降低(P<0.01),提示代餐粉可抑制模型小鼠的外周炎症反应。
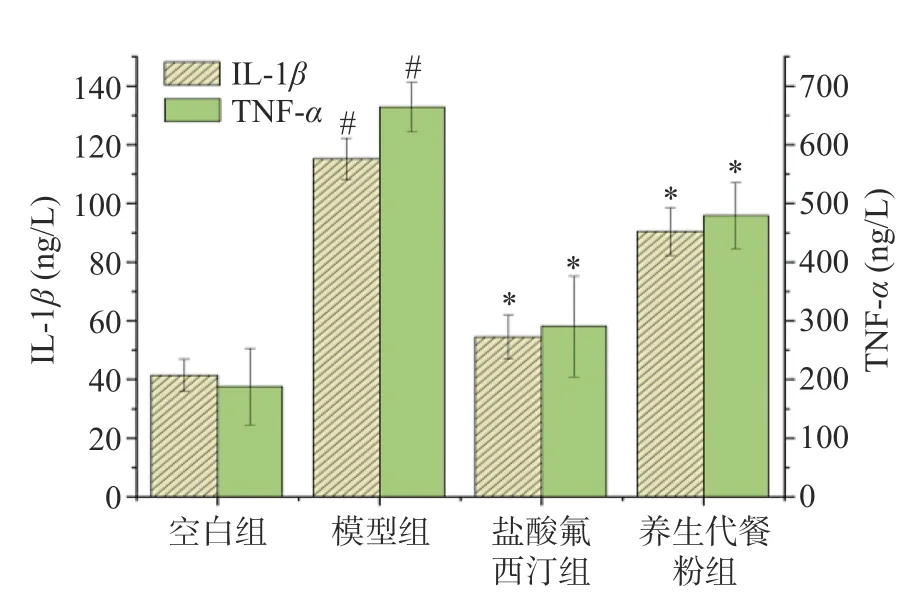
图7 各组对LPS 致急性抑郁小鼠IL-1β、TNF-α 的影响Fig.7 Effect of each group on IL-1β、TNF-α in LPS-induced acute depression mice
2.7.3 小鼠外周血清5-HT、NE 含量结果 5-HT、NE 等单胺类神经递质水平降低主流认为是抑郁发生的主要因素,提高其含量可改善抑郁状态[41-42]。由图8 可知,造模后,小鼠血清中5-HT、NE 水平明显降低(P<0.01);与模型组相比,养生代餐粉组5-HT、NE 含量不同程度升高,均具有显著性(P<0.01)。表明代餐粉可通过提升5-HT、NE 含量来发挥抗抑郁效果。
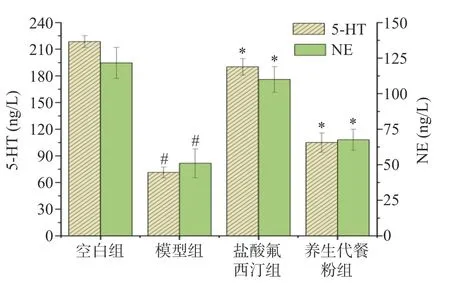
图8 各组对LPS 致急性抑郁小鼠5-HT、NE 的影响Fig.8 Effect of each group on 5-HT、NE in LPS-induced acute depression mice
2.7.4 小鼠脑组织BDNF 含量结果 BDNF 是一种神经营养因子,与海马神经元功能、神经元再生和凋亡有密切关系[43],而抑郁症的发生通常伴随着海马神经元的损伤。结果如图9 所示,小鼠注射LPS 后,其脑组织中的BDNF 含量明显下降(P<0.01);与模型组比较,给药组小鼠脑组织BDNF 含量不同程度升高,差异具有显著性(P<0.01)。
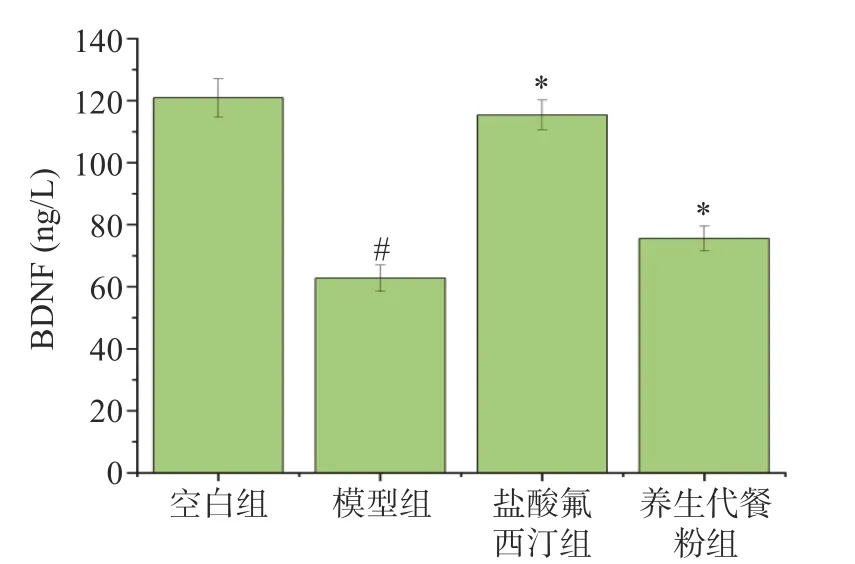
图9 各组对LPS 致急性抑郁小鼠BDNF 的影响Fig.9 Effect of each group on BDNF in LPS-induced acute depression mice
3 结论
通过对理化指标、总多糖和总黄酮含量、体外消化特性的比较研究,筛选了养生代餐粉的熟化工艺,并采用LPS 致小鼠抑郁模型评价代餐粉的抗抑郁作用。结果显示,挤压膨化组WSI 值为34.35%、WAI值为3.18 g/g、SR 值为52.16%、分散时间为184.12 s、润湿时间为195.02 s、总多糖含量为32.2 mg/g、总黄酮含量为0.62 mg/g,即挤压膨化对冲调性改善虽然不如烘烤等熟化工艺,但可大幅提高中药粉末可溶性小分子物质的含量,并增加活性物质含量;体外消化实验中,挤压膨化组RDS 为63.52%、SDS 为34.14%,表明其升糖指数低于其他工艺。综上所述,挤压膨化熟化工艺符合养生代餐粉营养、功效、养生及代餐需求,故选择挤压膨化工艺进行养生代餐粉的熟化处理。动物实验结果表明,养生代餐粉可明显改善小鼠抑郁样行为,显著降低抑郁小鼠IL-1β、TNF-α含量,明显提高其5-HT、NE、BDNF 含量,及养生代餐粉可能是通过抗炎、调节单胺递质、保护神经元等多靶点来发挥抗抑郁作用。目前,代餐产品多集中在减肥瘦身方面,对功能性食品尤其是抗抑郁功能性食用产品研究较少。本研究以甘麦大枣汤为基础,充分挖掘利用药食两用中药的价值,为食品领域中相关产品的开发提供理论依据及技术参考。当然,养生代餐粉发挥抗抑郁作用的具体物质及作用机制还有待进一步研究。

