木葡糖醋杆菌发酵产细菌纤维素的培养基优化及外源物质对其代谢的影响
王 凯,赵 萍,冯佩瑶,晋 丹,高 杰,汪 瑞,李佳颖,刘 冰
(兰州理工大学生命科学与工程学院,甘肃兰州 730050)
细菌纤维素(BC)主要是由醋酸杆菌属(Acetobacter)、假单胞菌属(Pseudomonas)、根瘤菌属(Rhizobium)、八叠球菌属(Sarcina)[1]等生产菌合成的不溶性直链多糖,它的直链之间彼此呈平行状,没有分支结构[2]。目前研究较多且能够大量合成BC的生产菌为木葡糖醋杆菌(Gluconacetobacter xylinum),原名木醋杆菌(Acetobacter xylinum)[3]。BC与植物纤维素不同之处在于BC 不含果胶、半纤维素等物质,且具有高度多孔三维网络结构,因此BC具有高聚合度、高结晶度、可降解性[4]、较好的生物相容性等特点[5]。目前BC 已成功应用于食品工业、生物医学、保鲜材料、复合材料[6-9]等领域。但由于其产量低、成本高、无法实现产业化生产,故极大地制约了BC 的工业化推广应用[7]。目前,国内外对提高BC 产量的研究开展了大量的工作,如菌种选育、改变生物反应器和发酵参数[8]、代谢机理研究等,以期降低BC 生产成本、改良BC 合成途径、拓宽BC应用范围。
微生物在发酵培养过程中需要利用大量的营养元素,如碳源、氮源、生长因子等,因此发酵培养过程中所用到的培养基成分能够直接影响到BC 的合成[9]。此外,在木葡糖醋杆菌发酵过程中,多种添加物已被证实对菌体生长或合成纤维素具有一定的促进作用,如水溶性多糖[10]、木质素磺酸盐[11]、金属离子[12]等。
本研究采用实验室分离菌株为生产菌株,利用Plackett-Burman 试验设计法和Box-Behnken 试验设计法[13]得到合成BC 的最优培养基配方,有效提高BC 产量;在此基础上,通过添加SA、CMC-Na、CMC 等水溶性多糖大分子作为合成体系的外源物质,对发酵过程中总糖含量、乙酸含量、丙酮酸含量等指标变化进行研究,以指标量化的方式,探究不同物质对细菌纤维素合成的影响机理,以期为进一步研究外源物质对BC 合成的影响机理提供理论依据,为拓展BC 的工业化应用提供一定的理论与实践基础。
1 材料与方法
1.1 材料与仪器
木葡糖醋杆菌(Gluconacetobacter xylinus)K8-5由兰州理工大学生命科学与工程学院赵萍老师课题组筛选并保藏;葡萄糖 天津市致远化学试剂有限公司;蛋白胨、酵母浸粉 上海迈瑞尔;K2HPO4、Na2HPO4、MgSO4天津市北辰方正试剂厂;琼脂天津大茂化学试剂厂;乙酸、乙醇 天津市富宇精细化工有限公司;斜面培养基:葡萄糖3%,酵母膏0.5%,MgSO41.5%,K2HPO40.15%,琼脂2%,pH 自然;基础培养基:葡萄糖3%,酵母膏0.5%,MgSO41.5%,K2HPO40.15%,乙醇2%,pH 自然。
DHP-9082 电热恒温培养箱 上海恒一科学仪器有限公司;YX280B 压力蒸汽灭菌锅 上海三申医疗器械有限公司;Cary50 紫外分光光度计 美国瓦里安公司;SHA-82 恒温振荡器 上海贺帆仪器有限公司。
1.2 实验方法
1.2.1 菌种的培养 菌种活化:挑取适量保存在4 ℃条件下的木葡糖醋杆菌接种于斜面培养基中,29 ℃静置培养7 d。种子培养:于种子培养基中接种2~3 环斜面种子,29 ℃,150 r/min 恒温振荡24 h。发酵培养:10%(v/v)种子液接入基础培养基,29 ℃静置培养7 d[14]。
1.2.2 木葡糖醋杆菌发酵培养基优化
1.2.2.1 单因素实验 实验前期参照1.1 中基础培养基配方,通过控制变量法,已筛选出最优碳源为葡萄糖,最优氮源为酵母浸粉、蛋白胨,最优无机盐为Na2HPO4、MgSO4,最优有机酸为乙酸。以BC 产量为指标,确定各因素的最佳添加范围。研究葡萄糖添加量(2%、3%、4%、5%、6%、7%、8%)、酵母浸粉或蛋白胨(0.2%、0.4%、0.6%、0.8%、1.0%、1.2%、1.4%)代替基础培养基中酵母膏、MgSO4添加量
(0.5%、1.0%、1.5%、2.0%、2.5%、3.0%、3.5%)、Na2HPO4(0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%)代替K2HPO4、乙酸添加量(0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%)、乙醇添加量(1%、1.2%、1.4%、1.6%、1.8%、2.0%、2.2%)对BC 产量的影响。考察某一因素时,其他固定条件为葡萄糖添加量3%、酵母膏添加量0.5%,MgSO4添加量1.5%,K2HPO4添加量0.15%,乙醇添加量2%。
1.2.2.2 Plackett-Burman 试验 根据单因素实验结果,利用Plackett-Burman 试验对影响BC 产量的7 个因素为自变量,BC 产量作为响应值,设计7 个因素2 个水平试验,水平设置如表1[15-16]。

表1 Plackett-Burman 试验设计因素与水平Table 1 Factors and levels of Plackett-Burman experiments design
1.2.2.3 Box-Behnken 响应面设计试验 根据Box-Behnken 试验设计原理,结合单因素及Plackett-Burman 试验的结果,确定MgSO4、酵母浸粉、葡萄糖3 个显著因素为Box-Behnken 试验考察自变量,BC 产量作为响应值,设计三因素三水平的响应面试验,因素水平及编码见表2。
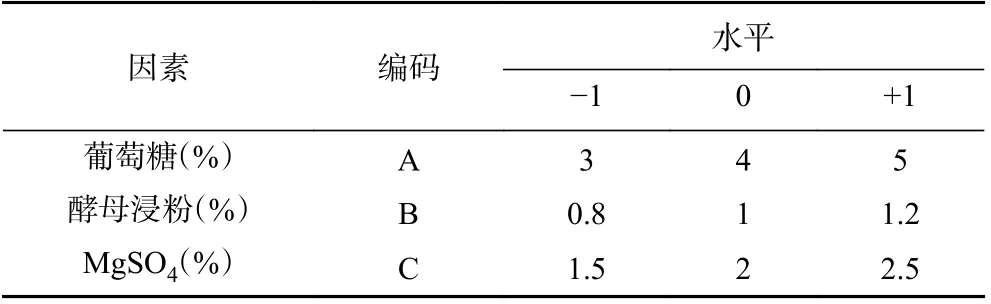
表2 Box-Behnken 试验因素水平及编码Table 2 Factors and levels of Box-Behnken experiments
1.2.2.4 BC 产量的测定 将发酵液中气液交界处生成的BC 膜取出,用蒸馏水多次冲洗,后浸泡于0.1 mol/L 的NaOH 溶液中,煮沸30 min,冷却后再用0.5%的乙酸浸泡5 min,经蒸馏水多次冲洗至膜呈乳白色半透明,将处理后的纤维素膜75 ℃烘干至恒重,称量BC 重量[17]。
1.2.3 添加外源物质对总糖含量、OD600、pH、乙酸含量、丙酮酸含量的影响
1.2.3.1 外源物质添加量的确定 在基础培养基中分别添加因素水平为0.1、0.2、0.3、0.4、0.5、0.6、0.7%(w/v)的SA、CMC-Na 和CMC,经120 ℃、121 kPa灭菌30 min 后按比例接种10%(v/v)的种子液,29 ℃条件下静置培养7 d,收取BC,确定BC 产量,根据BC 最大产量选择最优添加量。
1.2.3.2 发酵样液的制备 在优化培养基中分别添加外源物质(SA、CMC-Na 和CMC),以空白添加为对照组,将种子液按10%(v/v)的接种量接种于培养基中,29 ℃静置培养7 d,每天对四组发酵液进行随机3 次平行取样,共取7 d,测定其发酵指标(BC 产量、OD600、总糖含量、pH、乙酸含量、丙酮酸含量)。
1.2.3.3 菌体生长情况的测定 将1%纤维素酶(10000 U/g)溶液置于柠檬酸缓冲溶液(pH5)中,将发酵液与纤维素酶溶液以1:1 混合,50 ℃水浴2 h,室温静置后取两份上清液,将其中一份上清液用0.22 μm 的微孔滤膜过滤除菌作为对照组[18],使用紫外分光光度计测定菌液在600 nm 处的吸光度,以OD600值反映菌体生长发育情况[19]。
1.2.3.4 总糖的测定 将发酵样液4000 r/min 离心10 min 后取上清液5 mL,加入5 mL 6 mol/L HCl 溶液和30 mL 蒸馏水,70 ℃水浴15 min,冷却后调pH 至7~8,定容至100 mL,作为混合液备用。吸取混合液1 mL,DNS 试剂2 mL,沸水浴2 min 显色,流水迅速冷却后定容至25 mL,在540 nm 处测定样品的吸光值,根据标准曲线计算总糖含量[20-21]。
1.2.3.5 乙酸及pH 测定 样品处理:取一定量的发酵样液,经8000 r/mn 离心后取上清液,稀释10 倍,用0.22 μm 的滤膜过滤后进样分析。色谱条件:SBAQ 色谱柱,流动相:pH2.5 的磷酸二氢钾溶液,流速:0.5 mL/min,检测器波长:210 nm,柱温30 ℃,进样量:10 μL。pH 的测定参考GB 5009. 237-2016 食品安全国家标准 食品pH 值的测定[22]。
1.2.3.6 丙酮酸的测定 参考张继冉[23]的方法在320 nm 处测定紫外吸收丙酮酸标准曲线。以丙酮酸含量为X 轴,吸光值为Y 轴,绘制丙酮酸标准曲线,标准曲线为y=0.2583x+0.0248(R2=0.9975)。发酵液经8000 r/min 离心10 min,取上清液用NaOH 溶液调pH 为11.0,在320 nm 处测其吸光值,根据标准曲线计算丙酮酸含量。
1.3 数据处理
使用 Design Expert 8.0.6、SPSS Statistics 21 软件对试验数据进行处理以及显著性分析(P<0.05),使用Origin 2021 软件作图,BC 产量有效数据均取5 次平行实验的平均值,其余有效数据均取3 次平行实验的平均值。
2 结果与分析
2.1 木葡糖醋杆菌培养基优化结果
2.1.1 单因素实验结果 不同物质的添加量对BC产量的影响存在一定差异。葡萄糖作为唯一的碳源,为菌体生长和BC 合成提供能量,如图1 所示,当葡萄糖添加量为4%和5%时BC 产量并不具有显著性差异(P>0.05),但当葡萄糖添加量增加时,BC 产量呈下降趋势,因此选择葡萄糖的最佳添加量为4%;氮源是细胞代谢所必需蛋白质的主要成分,占细菌干细胞质量的8%~14%,当蛋白胨和酵母浸粉分别代替基础培养基中氮源时,对BC 产量进行测定,结果表明当蛋白胨和酵母浸粉的添加量分别为0.8%和1%时,BC 产量最高;无机盐可以作为酶的重要组成成分参与微生物的代谢,当MgSO4添加量为2%时,BC 产量最高为2.89 g/L,且Na2HPO4添加量为0.2%时,BC 产量最高;Liu 等[24]研究表明,在BC 合成过程中,乙醇或乙酸盐作为补充碳源,通过三羧酸循环产生ATP,可以有效提高BC 产量,当乙醇添加量为1.6%时,BC 合成量最大,当乙酸浓度大于0.4%时,BC 合成被抑制,表明过量的乙酸浓度会对细胞生长造成抑制作用,故乙醇和乙酸的最佳添加量分别为1.6%和0.4%。选择上述各物质最佳添加量进行下一步实验。

图1 不同添加物浓度对BC 产量的影响Fig.1 Effects of different additive concentrations on yield of bacterial cellulose
2.1.2 Plackett-Burman 试验 根据单因素实验进行Plackett-Burman 试验,如表3。由表4 可知Plackett-Burman 试验模型的P值为0.013<0.05,对BC 产量影响最显著的三个因子为MgSO4、酵母浸粉、葡萄糖,固定其他因素,蛋白胨(0.8%)、乙酸(0.4%)、乙醇(1.6%)、Na2HPO4(0.2%)的添加量不变,进行下一步Box-Behnken 试验。

表3 Plackett-Burman 试验设计与结果Table 3 Design and results of Plackett-Burman experiments
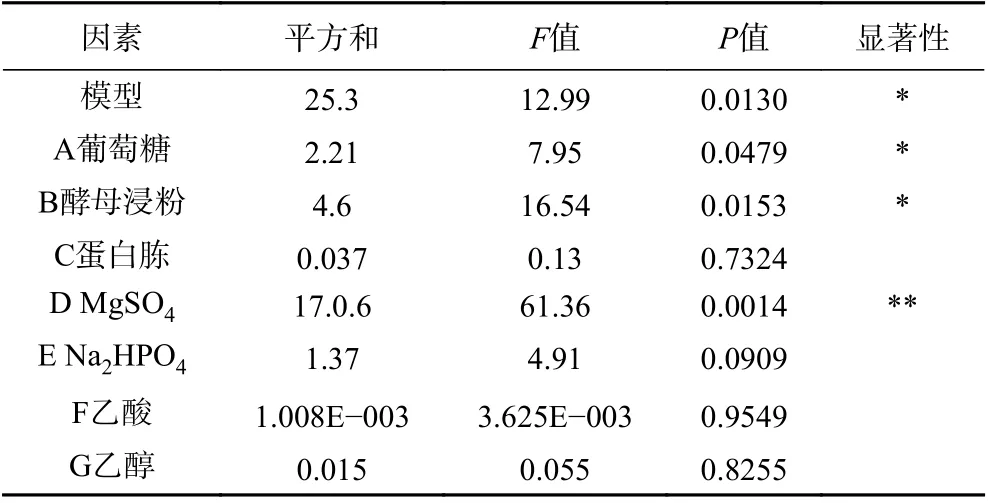
表4 Plackett-Burman 试验的方差分析Table 4 Analysis of variance of Plackett-Burman experiments
2.1.3 Box-Behnken 响应面优化试验结果与分析在Plackett-Burman 试验基础上以MgSO4、酵母浸粉和葡萄糖的添加量为响应值,进行Box-Behnken试验,如表5。利用Design-Expert 8.0.6 软件对实验数据进行多元回归拟合,最终得到BC 产量高低响应面回归模拟方程为:
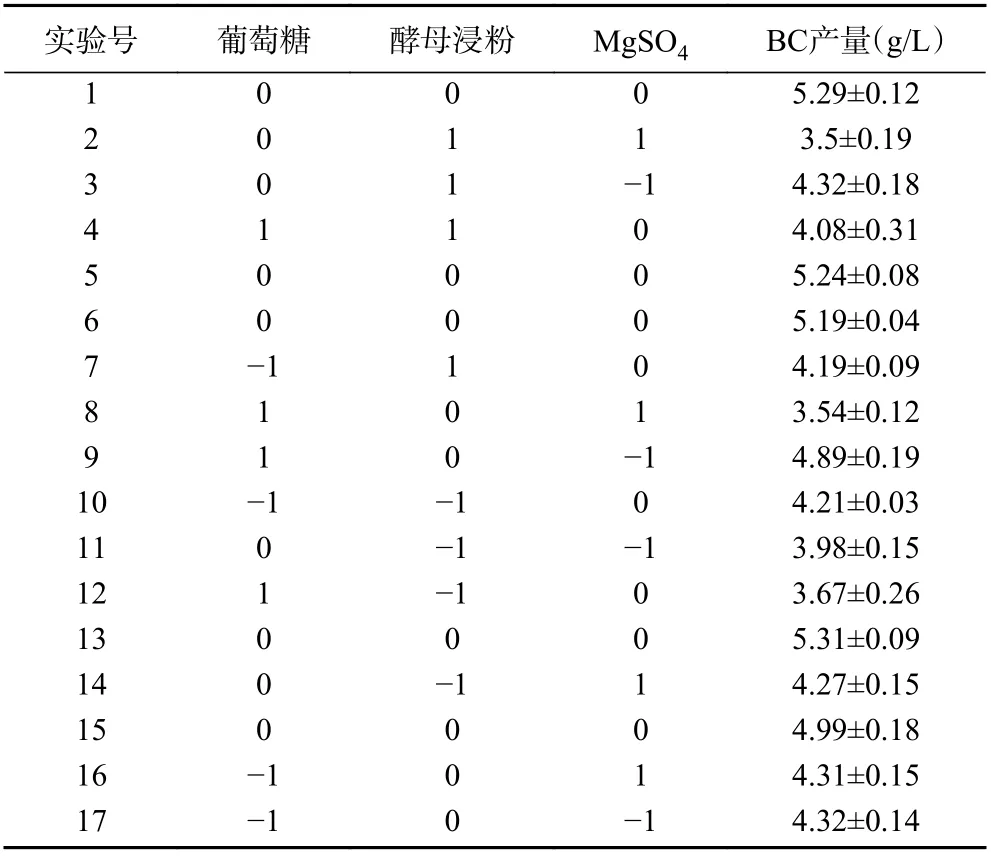
表5 Box-Behnken 响应面试验设计与结果Table 5 Design and results of Box-Behnken response surface experiment
由表6 可知,A2、B2、C2对BC 产量有极显著影响(P<0.01),C、AC、BC 对BC 产量有显著影响(P<0.05),A、B、AB 影响不显著(P>0.05)。该模型P值为0.0006,表明回归模型影响极显著(P<0.01),失拟项为0.1087(P>0.05)不显著,决定系数R2=0.9565,校正系数R2adj=0.9005,说明该回归模型具有良好的拟合度和预测能力。

表6 Box-Behnken 响应面试验结果方差分析Table 6 Analysis of variance of Box-Behnken response surface experiment results
2.1.4 响应面不同因素间交互作用分析 由图2 可知,葡萄糖和酵母浸粉(AB)的等高线中心区域呈圆形,表明葡萄糖和酵母浸粉之间交互作用不明显,葡萄糖和MgSO4(AC)、酵母浸粉和MgSO4(BC)的交互作用的等高线中心区域显示为椭圆形,响应曲面坡度趋势陡峭,表明AC、BC 的交互作用明显,对BC 产量影响较大,响应面分析结果与方差分析结果一致。
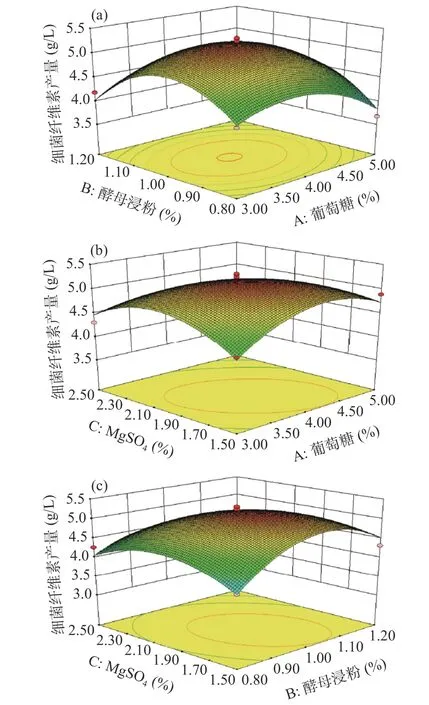
图2 葡萄糖、酵母浸粉、MgSO4 添加量交互作用对BC产量影响的响应面图Fig.2 Response surface plots of the effects of interaction between glucose, yeast powder and magnesium sulfate addition on the yields of BC
2.1.5 验证实验 根据试验可得出BC 产量的最大预测值为5.23 g/L,最终得到的预测培养基配方为:葡萄糖3.98%、酵母浸粉1.01%、蛋白胨0.8%、MgSO41.87%、Na2HPO40.2%、乙酸0.4%、乙醇1.6%,为了实际操纵可控,设置优化后培养基配方为葡萄糖4%、酵母浸粉1%、蛋白胨0.8%、MgSO41.9%、Na2HPO40.2%、乙酸0.4%、乙醇1.6%。按此培养基配方进行发酵,实际得到BC 产量为5.19 g/L,与预测结果接近,因此,可以证明这个模型准确性较高,可预测实际发酵情况。
文献报道赵浩杰等[15]通过响应面法优化培养基后,最终BC 产量为5.02±0.14 g/L;文章等[25]利用稀释后的白酒酿造副产物黄水为培养基,BC 产量提高了53.2%,终产量为2.42 g/L;张丽平等[21]在基础培养基中添加乙醇及有机酸后,有效提高了BC 产量,BC 产量为3.012 g/L。本文响应面优化后实际BC产量为5.19±0.16 g/L,BC 产量较高,具有较大优势。
2.2 外源物质对BC 的影响
2.2.1 外源物质添加量的确定 通过单因素实验,确定外源物质CMC-Na、SA、CMC 的最佳添加量。由图3 可知,当CMC-Na 添加量为0.4%、0.5%、0.6%时,BC 含量并不具有显著性差异(P>0.05),发酵环境中不同因素会对发酵结果产生不同影响,且三次平行实验结果显示CMC-Na 添加量为0.5%时,BC 合成量最大,故CMC-Na 的最佳添加量为0.5%;随着SA 添加量的增加,合成BC 的促进作用较明显,SA的最佳添加量为0.4%;添加CMC 后培养基体系粘度增大,BC 产量误差较大,但当CMC 添加量为0.5%时,BC 产量最高。

图3 海藻酸钠、羧甲基纤维素钠、羧甲基纤维素添加浓度对BC 产量的影响Fig.3 Effects of SA, CMC-Na, CMC concentrations on yield of bacterial cellulose
2.2.2 外源物质对BC 产量、OD600、总糖含量的影响 木葡糖醋杆菌发酵过程中,培养基中的一些外源物质可以直接与纤维素结合,干扰其结晶或与纤维素共结晶,部分外源物质也可以直接干扰细菌细胞,间接改变纤维素的生产[26]。
由图4a 可知,添加外源物质后葡萄糖利用率明显提高,与对照组相比,添加SA 和CMC-Na 的细菌纤维素产量由5.19 g/L 上升到6.74 g/L 和6.01 g/L,增幅达到29.87%和15.8%;添加CMC 后的BC 产量为5.1 g/L,低于对照组,表明添加一定量的SA 和CMC-Na 可以有效提高BC 产量,添加CMC 后不但没有促进作用,反而抑制了BC 的合成,这与钱子俊等[3]的研究结果类似。所有实验组中菌体浓度整体呈持续增长趋势(图4b)。添加外源物质后,发酵前期菌体浓度的增长速率均高于对照组,尤其是SA 处理组菌体浓度上升趋势最为明显,表明加入适量外源物质可以缩短木葡糖醋杆菌发酵过程的适应期,使其迅速进入对数期,菌体迅速生长、繁殖,从而提高BC 产量。在发酵过程中,葡萄糖主要用于BC 合成途径以及糖酵解(EMP)途径和三羧酸循环(TCA),产生能量和菌体所需的蛋白质,同时产生各种有机酸与其他代谢副产物[27]。由图4c 可看出,对照组以及添加SA、CMC-Na、CMC 后的总糖消耗量分别为11.57、15.03、14.21、13.39 g/L,与对照组相比,添加外源物质后总糖消耗量和总糖消耗速率均大于对照组,表明添加外源物质后促进了碳源的消耗。发酵前3 d 总糖快速消耗,后趋于平稳,主要是由于发酵前期菌体迅速繁殖,合成BC,碳源物质消耗速率加快。张丽平等[21]的研究表明,部分外源物质的添加可以减少无效碳循环,提高糖转化率,促进总糖消耗,提高BC 合成途径的碳流量,与本文中添加SA 和CMC-Na 组研究结果类似。
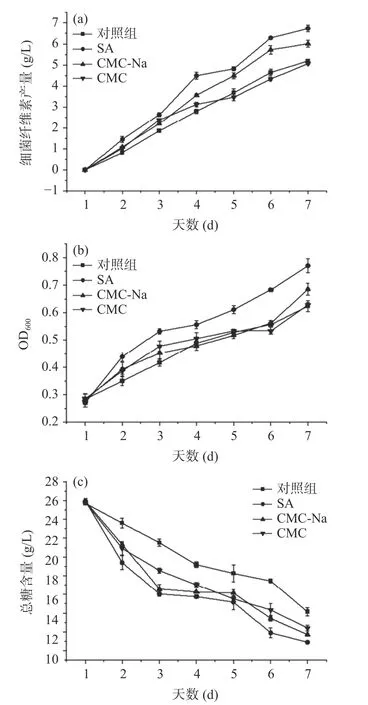
图4 外源物质对BC 产量(a)、OD600(b)、总糖含量(c)的影响Fig.4 Effects of exogenous substances on bacterial cellulose yield (a), OD600 (b) and total sugar content (c)
2.2.3 外源物质对发酵液pH、乙酸含量、丙酮酸含量的影响 由图5a 可看出,添加不同外源物质对发酵液pH 的变化影响有一定差异,发酵前期pH 迅速下降,发酵中后期缓慢下降,这种现象与BC 合成过程中乙酸、葡萄糖酸等物质的生成和后期消耗有关[28]。对照组pH 下降趋势最明显,且发酵过程中pH 均低于其他三组,可能是由于对照组中其他有机酸的积累量高于外源添加物组。李萧[29]的研究中发现,与添加外源物质组相比未添加外源物质的菌株利用碳源合成BC 时,会生成大量的葡萄糖酸,使pH降低。吴敏等[30]研究发现添加外源物质可以减缓pH 的下降,为菌体合成BC 提供适宜的培养环境,从而促进BC 合成,与本研究中SA 与CMC-Na 组结果类似。
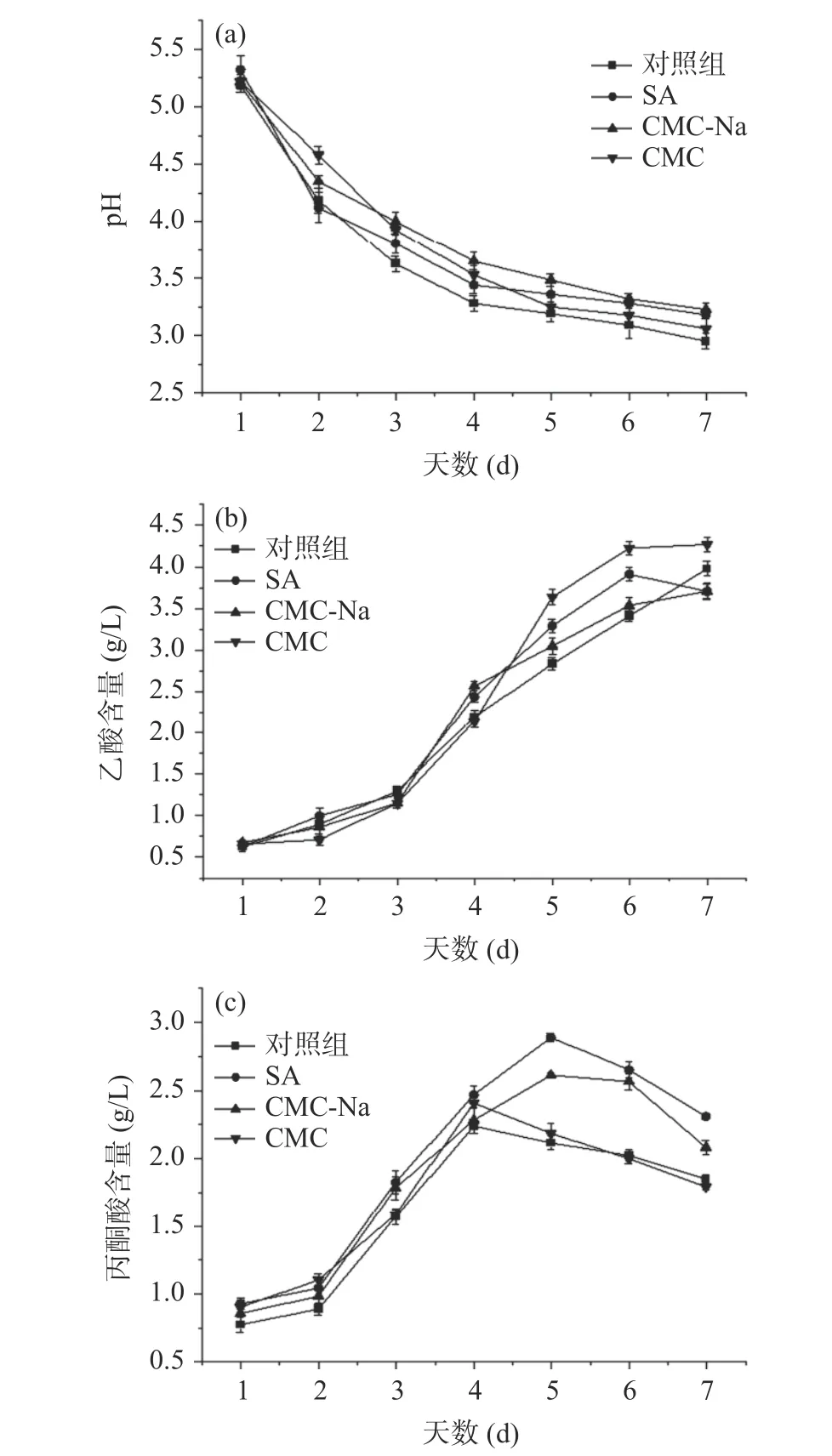
图5 外源物质对发酵液pH(a)、乙酸(b)、丙酮酸(c)的影响Fig.5 Effects of exogenous substances on fermentation liquid pH (a), acetic acid (b) and pyruvic acid (c)
由图5b 乙酸含量变化图可看出,添加CMC 后乙酸积累量最高为4.27 g/L,其次是对照组,而SA 与CMC-Na 组在发酵中后期乙酸积累量分别为3.85 g/L和3.87 g/L,高于对照组,但在终期低于对照组,表明SA 与CMC-Na 的添加促进了乙酸的部分积累,且一定量的乙酸可以作为底物,在发酵后期被利用,流向BC 合成路径,促进BC 合成。而CMC 组乙酸积累量显著高于其他三组,BC 合成被抑制,表明CMC的添加会促使菌株积累过量的乙酸,从而使细菌细胞的生长和纤维素的合成受到抑制。马霞等[31]研究有机酸对BC 合成的影响规律时发现,当乙酸浓度高于临界值,会导致BC 产量下降;李珏等[32]研究表明,汉逊氏葡糖醋杆菌(Gluconacetobacter hasenii)发酵生产BC 时的最适乙酸浓度为3 g/L。
由图5c 可知,4 个组的丙酮酸含量整体呈先上升后下降的趋势,添加外源物质后丙酮酸积累量明显高于对照组,添加SA 和CMC-Na 后丙酮酸在第5 d达到最高积累量2.89 g/L 和2.61 g/L,而CMC 与对照组在第4 d 最高达到2.41 g/L 与2.24 g/L,当丙酮酸大量积累,EMP 途径和TCA 循环受到抑制,随后丙酮酸作为底物被消耗,经过糖异生后合成6-磷酸葡萄糖,使代谢流向BC 合成途径,丙酮酸含量下降[21],SA 与CMC-Na 的添加促进了丙酮酸的积累与再利用,进而提升了BC 的产量。
3 结论
本文利用响应面优化试验,确定木葡糖醋杆菌合成BC 的最佳培养基配方为葡萄糖4%、酵母浸粉1%、蛋白胨0.8%、MgSO41.9%、Na2HPO40.2%、乙酸0.4%、乙醇1.6%,此时,BC 产量可达5.19 g/L。并在优化培养基中添加SA、CMC-Na 和CMC 三种物质,测定BC 产量、总糖、乙酸、pH 等指标。结果表明,与对照组相比,添加SA 和CMC-Na 后,消耗的碳源分别增加了3.46 g/L 和2.64 g/L,同时也促进了丙酮酸的积累,使糖异生途径被加强,更多能量流向BC 合成途径,最终BC 产量分别为6.74 g/L 和6.01 g/L,与对照组相比分别提高了29.87%和15.8%;添加CMC 后乙酸含量最大为4.27 g/L,过量的乙酸积累量对细菌细胞的生长和纤维素的合成造成负面影响,BC 产量为5.1 g/L,较对照组BC 产量下降。后续将继续针对发酵液中各种有机酸对pH 及BC产量的影响开展深入研究,以期为外源物质对木葡糖醋杆菌合成BC 的影响提供理论基础,为细菌纤维素的规模化生产提供一定的参考。

