酶菌协同处理对微拟球藻营养功能成分及生物活性的影响
辛易燃,尤升波,武俊瑞,卢龙飞,仝 蕾,刘凤彩,韩福文,于金慧,*,乌日娜,*
(1.山东省农业科学院农作物种质资源研究所,山东济南 250100;2.沈阳农业大学食品学院,辽宁沈阳 110866;3.济南康多宝生物技术有限公司,山东济南 250100;4.辽宁省食品发酵技术工程研究中心,辽宁沈阳 110866;5.沈阳市微生物发酵技术创新重点实验室,辽宁沈阳 110866;6.威海长青海洋科技股份有限公司,山东威海 264300)
微拟球藻是真眼点藻纲微拟球藻属的一种海产经济微藻,其生长快、光合效率高、含油量高,是开发前景良好的未来食品[1-2]。微拟球藻高产二十碳五烯酸(Ethernet for Plant Automation,EPA)且不含二十二碳六烯酸(Docosahexaenoic Acid,DHA),EPA 含量可达脂肪酸总量的30%,具备低硫、高氧、低十六烷值等特点[3-4],还富含藻多糖、蛋白质等营养功能成分,已于2021 年被国家卫健委列为新资源食品。目前,微藻在食品领域的应用越来越广,市面上已有代餐粉、能量棒和饮品[5]等含微拟球藻的相关食品,但是还未见其发酵类型的产品。
酶菌协同发酵是指基质经酶解工艺后,再经益生菌菌株发酵的过程[6]。益生菌本身具有调节肠道菌群、抗氧化、改善机体免疫力等功能[7],通过发酵可明显改变基质组分、降解生物大分子物质,提高其功能活性和生物利用率,还可改善基质风味。杨洁芳等[8]利用酶菌协同制备大豆肽与实验室制备的酶解肽相比,其DPPH 自由基清除率提高106.92%。邹俊哲等[9]研究表明酶菌协同处理得到的ACE 抑制肽活性强于菌和酶单独作用时的效果。可见,作为前处理方法之一的酶菌协同工艺应用前景广泛,而微拟球藻丰富的营养成分可作为酶菌协同处理的理想基质。
基于以上现状,本研究以微拟球藻为原料,利用木瓜蛋白酶进行酶解,以多肽含量为指标,利用单因素和响应面法确定微拟球藻最佳酶解工艺条件。筛选适合菌种对酶解过后的微拟球藻进行发酵,明确不同菌/组合发酵的营养活性成分变化及其对体外抗氧化、降血脂活性的影响,同时对发酵过后的微拟球藻进行感官评定,为微拟球藻高值利用及功能型产品的开发提供参考与技术支持。
1 材料与方法
1.1 材料与仪器
微拟球藻(Nannochloropsis oceanica)藻泥 由威海青逸未来生物技术有限公司提供;KB1 植物乳杆菌(Lactiplantibacillus plantarumDY-1 CCTCCM-2016137)、KB2 干酪乳杆菌(Lacticaseibacillus caseiKDB-LC CCTCCM2016431)、KB3 嗜酸乳杆菌(Lactobacillus acidophilusKDB-03 CCTCCM2016429)、KB4 发酵乳杆菌(Limosilactobacillus fermentumKDB-08 CCTCCM2016430) 为本实验室分离保存;木瓜蛋白酶(酶活力:80 万 U/g) 北京索莱宝科技有限公司;1,2-二苦基-2-三硝基苯亚肼(DPPH)、2,4,6-三吡啶基-S-三嗪(TPTZ)、胰脂肪酶(酶活力:125 U/mg) SIGAMA(上海)贸易有限公司;牛磺胆酸钠 上海源叶生物科技有限公司;2,4-二硝基苯酚丁酸酯 上海麦克林生化科技有限公司;其他试剂为国产分析纯。
3K15 台式冷冻离心机 德国SIGMA 公司;756PC 紫外分光光度计 上海舜宇恒平科学仪器有限公司;AR124CN 电子分析天平 奥豪斯仪器(上海)有限公司;FE20 实验室pH 计 梅特勒-托利多仪器(上海)有限公司;LDZF 立式高压蒸汽灭菌器 上海申安医疗器械厂;INNOVA 43R 恒温培养摇床 美国NBS 公司;SHA-B 恒温水浴锅 金坛市精达仪器制造厂。
1.2 实验方法
1.2.1 微拟球藻的酶解
1.2.1.1 工艺流程及操作要点 取2.8 g 微拟球藻藻泥均质于100 mL 蒸馏水中(1%干重),利用0.01 mol/L NaOH 溶液或0.01 mol/L HCl 溶液调整pH 后加入木瓜蛋白酶充分混匀,置于相应温度的恒温水浴锅中酶解,沸水浴灭酶15 min 即得微拟球藻酶解液。
1.2.1.2 单因素实验 依次对酶量(1%、2%、3%、4%、5%)、酶解时间(1、2、3、4、5 h)、酶解温度(40、50、60、70、80 ℃)和pH(5、6、7、8、9)。当对酶量进行单因素实验时,酶解时间为3 h,酶解温度为60 ℃,pH 为7;对酶解时间进行单因素实验时,酶量为3%,酶解温度为60 ℃,pH 为7;对酶解温度进行单因素实验时,酶量为3%,酶解时间为3 h,pH 为7;对pH 进行单因素实验时,酶量为3%,酶解时间为3 h,酶解温度为60 ℃,均以多肽含量为指标。
1.2.1.3 响应面试验 基质中微拟球藻添加量为1%(w/v),木瓜蛋白酶酶量1%(w/v)。在单组实验设计的基础上,以酶量(A)、pH(B)、酶解时间(C)、酶解温度(D)为自变量,以多肽含量为响应值,利用响应面法确定微拟球藻的酶解最佳工艺。响应面优化因素水平表如表1 所示。

表1 响应面优化因素水平Table 1 Factors and level of response surface optimization
1.2.1.4 多肽含量的测定 多肽:采用OPA 法[10]。取50 μL 上清液,加入2 mL 0.8 mg/mL OPA 反应液后静置5 min,于340 nm 处测定吸光度值,以胰蛋白胨为标品做标准曲线,得到回归方程y=3.2274x-0.3338,R2=0.9993。
1.2.2 微拟球藻的发酵
1.2.2.1 发酵菌种的活化 将4 个菌株接种于MRS液态培养基中活化,传代培养2 次后放置在37 ℃恒温培养摇床上振荡培养24 h 备用。
1.2.2.2 微拟球藻的发酵 微拟球藻酶解后添加2%葡萄糖和1%的蛋白胨作为基质灭菌备用,分别接种KB1、KB2、KB3、KB4 四株乳杆菌,混菌处理接种四菌等比例混合后均质得到的混合菌液,标记为MIX。单菌和混菌发酵接种量均为1%,置于摇床培养箱37 ℃培养24 h,转速80 r/min。对照(CK)组酶解灭菌后不进行发酵处理,放置于常温备用。取5 mL 发酵后的样品于离心机5000 r/min 离心5 min,取上清液备用。
1.2.3 发酵微拟球藻营养活性成分测定
1.2.3.1 菌量、产酸能力和还原糖含量的测定 菌量:将培养24 h 的发酵微拟球藻酶解液取100 μL在MRS 固体上进行涂布,在37 ℃下培养48 h 后进行计数。按照式(1)计算菌体密度(CFU/mL)。
式中,平板上的菌落数为C;100 μL 为V;稀释倍数为M。
pH 和总酸:采用实验室pH 计测定pH。参考国标GB/T 12456-2021 测定总酸。
还原糖:采用DNS 比色法[11]。取1 mL 上清液加入2 mL 的3,5-二硝基邻羟基苯甲酸溶液煮沸8 min显色,流水冷却后加纯净水稀释,在487 nm 下测定吸光度,以葡萄糖标准溶液为标品做标准曲线,得到回归方程y=0.1636x-0.1601,R2=0.9991。
1.2.3.2 总酚、黄酮和多肽含量的测定 总酚:采用Folin-Ciocalteu 法[12]。取0.2 mL 样品上清液加入福林酚试剂反应5 min 后加入3 mL 0.2 g/100 mL 碳酸钠溶液,在75 ℃下反应15 min,流水冷却后在765 nm 下测其吸光度,以没食子酸为标品做标准曲线,得到回归方程y=0.0069x-0.0003,R2=0.9955。
黄酮:采用NaNO2-AlCl3法[13]。取3 mL 上清液,加入1 mL 0.5%的NaNO2反应5 min,加入1 mL 1%的AlCl3后25 ℃水浴 6 min,加入10 mL 1%的NaOH 溶液,最后填补70%的乙醇至25 mL 反应15 min,于510 nm 测定吸光度值,以榭皮素为标品做标准曲线,得到回归方程y=3.4369x-0.0023,R2=0.9985。
多肽含量的测定同1.2.1.4。
1.2.3.3 抗氧化活性的测定 DPPH 自由基清除能力的测定参照Martínez 等[14]方法。取2.5 mL 样品上清液,加入7.5 mL DPPH 溶液暗处反应30 min(A1),对照组用样品加95%无水乙醇(A2),空白组用纯净水加DPPH 溶液(A0),在517 nm 处测得吸光度A1、A2、A0。用式(2)计算。
FRAP 参考Benzie 等[15]的方法进行测定。取0.3 mL 样品上清液,加入2.7 mL TPTZ 工作液37 ℃反应15 min,在595 nm 处测其吸光度,以FeSO4为标品得到回归方程y=0.0037x+0.0003,R2=0.9999。
1.2.4 体外降血脂活性测定 牛磺胆酸钠结合率的测定参考何旭华等[16]的方法并稍作修改。取0.5 mL样品上清液,加入2 mL 0.3 mmol/L 牛磺胆酸钠溶液在37 ℃摇晃1 h 后,取0.5 mL 与2 mL 65%的硫酸溶液75 ℃水浴25 min 后冰浴10 min,387 nm 处测定吸光度为A样品。A对照用60%乙醇溶液代替样品,A空白用磷酸钠缓冲液代替牛磺胆酸钠,按式(3)计算。
胰脂肪酶抑制率的测定参考黄雪薇等[17]的方法并稍作修改。取1 mL 上清液与1 mL 0.5 mg/mL 胰脂肪酶溶液37 ℃反应30 min,加入20 μL 4-硝基苯基丁酸酯溶液37 ℃反应10 min,以加酶加样品溶液为实验组Ai,不加入酶溶液为空白组A0,不加入样品溶液为正常组A,在405 nm 处测定吸光值。按式(4)进行计算。
1.2.5 感官评价分析 组织12 名志愿者(6 男6 女,年龄18~40 周岁)进行感官评测[18],感官品评表见表2。将适量微拟球藻发酵酶解液倒入品尝杯中并随机排号,从四个方面进行打分。

表2 微拟球藻发酵酶解液感官品评标准表Table 2 Table of sensory evaluation criteria for fermentation enzyme hydrolysate of Nannochloropsis oceanica
1.3 数据处理
上述试验均进行三次平行测定,数据以均值±标准差表示。采用Design-Expert 10 软件进行响应面试验设计;用 SPSS 21 软件进行数据分析及显著性分析;用Excel 2010 软件对数据进行绘图。
2 结果与分析
2.1 微拟球藻酶解的工艺优化
2.1.1 单因素实验结果 如图1A 所示,随着酶解时间的增加多肽含量逐渐增多,并在3 h 时出现了最大值,随后下降。这可能是因为基质中的蛋白质酶解后转化为多肽被释放出来,随着时间延长多肽进一步被降解为氨基酸,故而含量下降[19]。随着酶量的增加多肽含量不断增多,在4%时最高(图1B),而后有下降趋势。推测可能是酶量的增多导致微拟球藻中的成分被更充分的酶解从而使多肽被更多的释放出来,而酶量过高时酶分子之间的相互水解作用导致了酶解效果下降,从而多肽含量下降[20]。随着酶解pH 的提高,多肽含量先下降后上升再下降,在pH8 时含量最大(图1C)。pH 影响酶分子和底物的离解状态,如果pH 不在适当范围内酶的活性就会减弱失活,降低酶水解效率[21],而在pH8 时酶的活性得到充分的释放,水解效率最高从而多肽含量最高。由图1D 可知,随着酶解温度的增加,多肽含量先下降后缓慢上升再逐渐下降。当温度达到70 ℃时,多肽含量最高,随后温度升高多肽含量下降。这可能是温度对木瓜蛋白酶活性的影响,过低或过高的温度都会影响酶活,而越接近最佳温度酶活力越高,释放的多肽越多。综上,选择酶解时间2~4 h、酶量3%~5%、酶解pH7~9 和酶解温度60~80 ℃进行响应面试验。
2.1.2 微拟球藻酶解响应面优化试验结果 综合上述试验结果,以酶量(A)、pH(B)、酶解时间(C)、酶解温度(D)为自变量,多肽含量为响应值,根据响应面法进行试验,试验设计与结果如表3 所示。

表3 响应面试验设计及结果Table 3 Response surface test design and results
通过Design-export 软件进行分析,得到多重二次响应面回归方程为:R=2.45+0.0731A+0.12B+0.15C+0.20D-0.18AB-0.030AC+0.17AD+0.030BC+0.085BD-0.077CD-0.23A2-0.67B2-0.015C2-0.26D2。根据表4 和对应方程可知,A(酶量)、B(酶解pH)、C(酶解时间)和D(酶解温度)对微拟球藻酶解液的多肽含量影响极显著(P<0.01)。同时可以看出模型F=66.54,P<0.0001,模型极显著,失拟项F=2.27,P>0.05,失拟项在回归模型中无显著性,说明该模型拟合度好,R2=0.9852,R2adj=0.9704,结果表明,该回归模型可以解释97.04%的实验数据差异,与实际情况吻合较好。

表4 回归模型的方差分析Table 4 Variance analysis of regression model
图2 为两因素交互作用对多肽含量影响的3D 图。可以观察到交互项A(酶量)B(酶解pH)和交互项A(酶量)D(酶解温度)对微拟球藻酶解液的多肽含量影响极显著;交互项B(酶解pH)D(酶解温度)和交互项C(酶解时间)D(酶解温度)对微拟球藻酶解液的多肽含量影响显著;交互项A(酶量)C(酶解时间)和交互项B(酶解pH)C(酶解时间)对微拟球藻酶解液的多肽含量影响不显著。
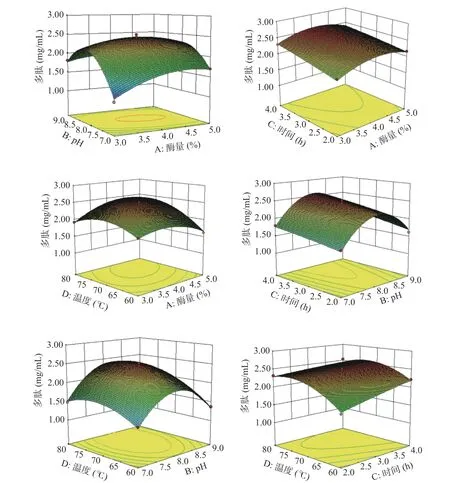
图2 交互项对微拟球藻多肽含量影响的响应曲面图Fig.2 Response surface diagram of the influence of interaction terms on the polypeptide content of Nannochloropsis oceanica
经响应面优化得到最优微拟球藻酶解工艺为酶量5.000%、pH8.009、酶解时间4.000 h、酶解温度75.635 ℃,多肽含量的理论值为2.484 mg/mL。为便于实际操作,将其修改为酶量5%、pH8.0、酶解时间4 h、酶解温度76 ℃,试验得含量为2.45 mg/mL,与最佳值接近,说明该模型可用。
2.2 微拟球藻发酵酶液特性的变化
益生菌增殖是微拟球藻中有效物质生物转化的前提。微拟球藻发酵24 h 后,混菌组活菌数最多,KB1 次之,菌量均大于107CFU/mL(图3A),说明微拟球藻是益生菌较好的生长基质,但是不同菌株之间具有一定的差异性,同时从侧面反映了微拟球藻在混菌发酵过程中乳杆菌之间的协同作用更加突出[22],所以混菌组有相对最多的活菌数。
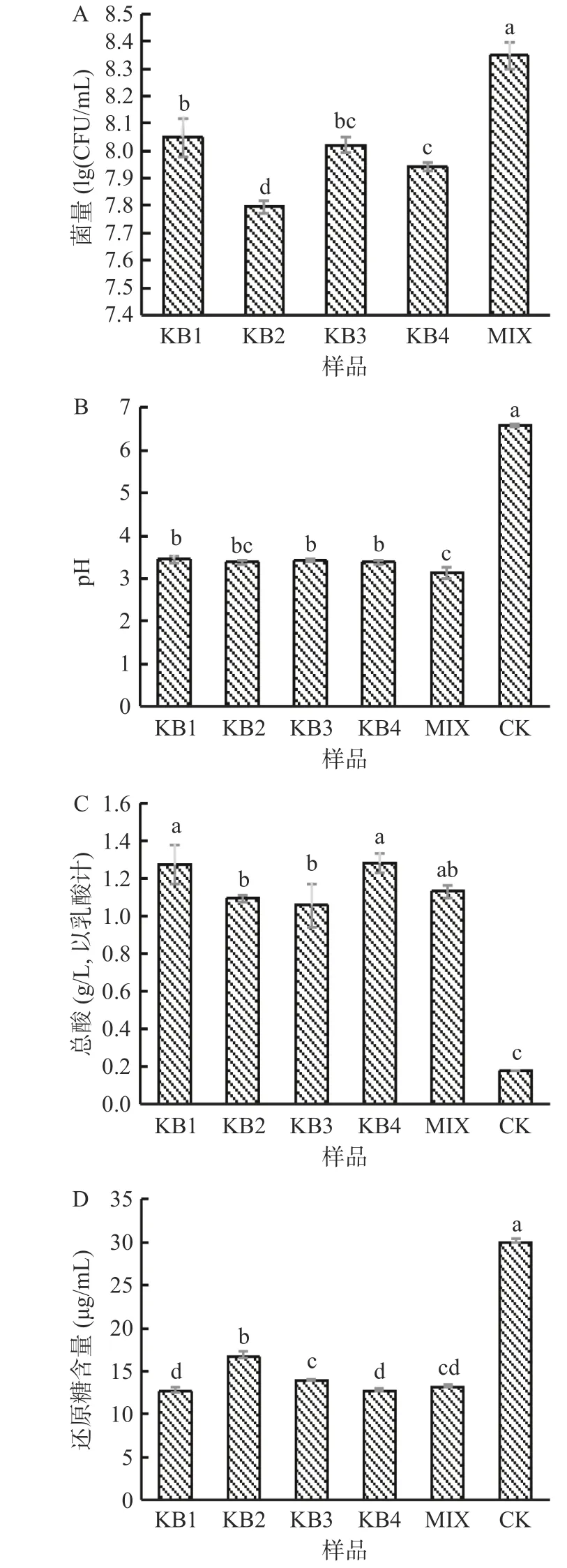
图3 微拟球藻酶解液发酵24 h 后菌量(A)、pH(B)、总酸(C)、还原糖(D)的变化Fig.3 The changes of viable count (A), pH (B), total acid (C)and residual sugar (D) after 24 h fermentation of enzymatic hydrolysate of Nannochloropsis oceanica
如图3B、3C 所示,益生菌发酵24 h 后pH 均显著下降(P<0.05),总酸含量显著增加(P<0.05)。与CK 组相比,各发酵处理总酸提高了4.9~6.1 倍。益生菌发酵可通过戊糖磷酸途径(HMP)和糖酵解途径(EMP)途径将基质中的糖类代谢产生乳酸和CO2,其中,CO2会形成碳酸,醛类会被氧化成酸类,从而降低发酵液的pH[23]。可知发酵后微拟球藻酶液产酸降低了发酵液的pH,且提高了其总酸的含量。
由图3D 可看出,发酵组的还原糖含量显著下降(P<0.05),其中KB4 发酵降幅最大,达57.6%。由于发酵过程中乳酸菌对微拟球藻基质中的糖类物质进行降解代谢,为自身生长繁殖利用,导致还原糖含量降低[24]。可知乳杆菌在发酵微拟球藻酶液的过程中利用了还原糖促进自身的繁殖。
2.3 发酵微拟球藻酶液主要活性成分的变化
植物基质经益生菌发酵后,经过一系列生物转化,可显著改变基质营养和功能组分[5]。如图4A 所示,不同处理条件下,总酚含量分别在9.3±0.1~10.0±0.0 μg/mL 之间,与CK 组相比,发酵组有上升且存在显著性差异(P<0.05)。总酚含量的提高可能是由于发酵过程产生的淀粉酶、纤维素酶等水解酶促进了总酚物质的释放,也可能与发酵过程中产生的单宁酶有关,单宁酶可以将复杂单宁降解为游离酚类物质从而提高总多酚的含量[25],所以发酵后微拟球藻酶液中多酚含量会有上升的趋势。
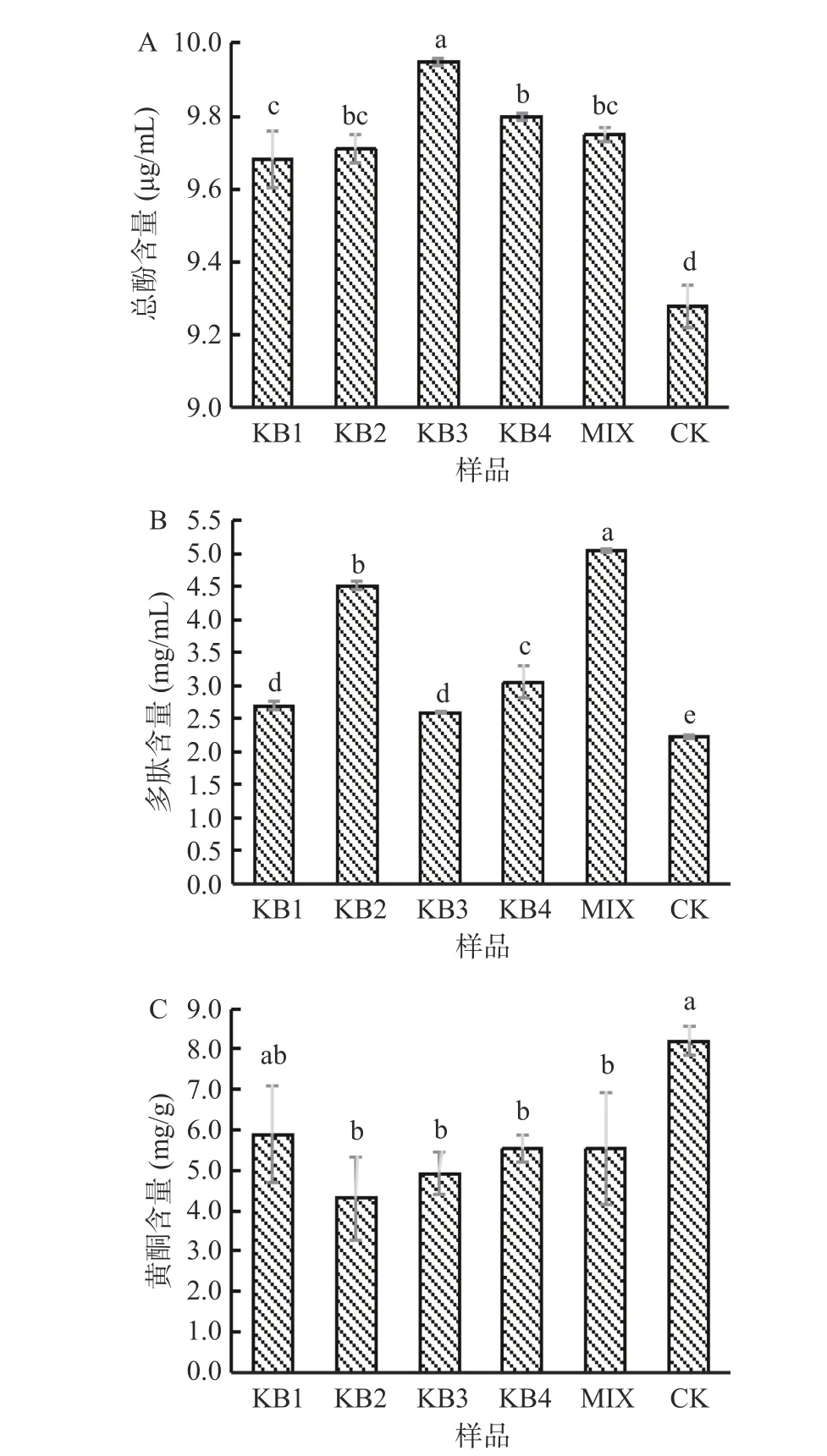
图4 微拟球藻酶解液发酵24 h 后的总酚(A)、多肽(B)、黄酮(C)含量的变化Fig.4 The changes of total phenol (A), polypeptide (B) and flavone (C) contents after 24 h fermentation of enzymatic hydrolysate of Nannochloropsis oceanica
如图4B 所示,发酵可显著提高微拟球藻多肽含量(P<0.05),与CK 相比,混菌组多肽含量提高了近1.3 倍。其原因可能是随着发酵的进行,菌株产酶量增加,特别是混菌酶系更加丰富,进一步酶切木瓜蛋白酶未发挥作用的位点使多肽增加,也有可能是微拟球藻在发酵过程中细胞的破坏程度不同,有效破坏微拟球藻细胞壁有利于胞内有效成分释放,使某些成分发生生物转化或者破坏一些大分子蛋白质的空间结构,从而将蛋白质分解成多肽等小分子物质[26],所以发酵后微拟球藻酶液中多肽含量会显著上升。
由图4C 可知,除KB1 组外其余组发酵后总黄酮含量显著下降(P<0.05)。其中,KB2 组总黄酮下降幅度最大,降幅为47.3%,一个可能原因是乳杆菌产生的二次代谢产物与黄酮化合物反应生成衍生物;另一种可能性是乳杆菌酶系种类繁多,不同的酶系可引发的化学反应不同,若黄酮类成分因乳杆菌酶的酶解作用发生结构变化,也可能产生发酵后含量降低的情况[27]。综上,发酵后微拟球藻酶液中总酚和多肽的含量有上升趋势而黄酮含量呈现下降趋势。
2.4 发酵微拟球藻酶液抗氧化活性的变化
乳酸菌发酵可以促进植物基质中活性物质的释放及新活性成分的转化,增强发酵基质的生物活性功能[28-30]。Niccolai 等[31]研究发现植物乳杆菌发酵螺旋藻能显著提高其抗氧化能力。由图5A 可知,与CK 相比,发酵组的DPPH 自由基清除率显著提高(P<0.05),其中,MIX 发酵组清除率最高,较CK 提高了119.8%。FRAP 代表的是亚铁离子浓度,浓度越高样品的抗氧化能力越强[32]。由图5B 可以看出,发酵可明显提高其铁离子还原力,KB3 发酵组和MIX 发酵组与CK 组差异显著(P<0.05),增幅为3.3%~24.3%。
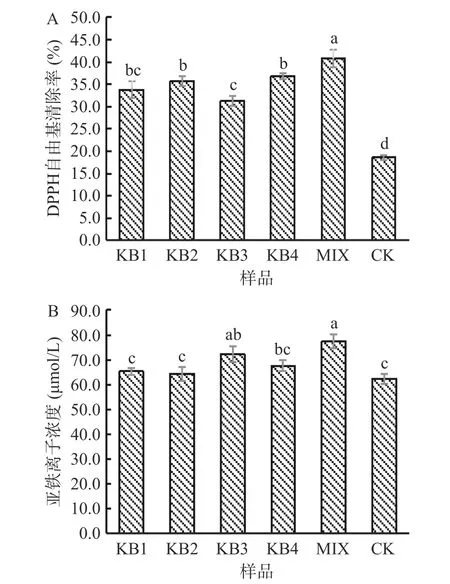
图5 微拟球藻酶解液发酵24 h 后的抗氧化活性的变化Fig.5 The change of antioxidant activity after 24 h fermentation of enzymatic hydrolysate of Nannochloropsis oceanica
抗氧化能力一般与黄碱素和植物单宁的含量呈显著正相关[13],且多肽等成分也有很好的抗氧化活性,从本文结果来看,发酵后总酚和多肽含量上升而黄酮含量下降,可能原因是发挥抗氧化作用的成分发生了改变,具有更高抗氧化活性物质的含量增加[33]。因此推测微拟球藻酶解后在益生菌的作用下,产生了一些有效的次生代谢产物,这些代谢产物取代了原来的活性成分发挥了抗氧化作用。可见,乳酸菌发酵可提高微拟球藻酶解液的抗氧化活性,但具有明显的菌株差异。
2.5 发酵微拟球藻酶液降血脂活性的变化
胆汁酸盐(胆汁酸的钠盐)可以增强脂肪和脂溶性营养物质在肠道中的水解程度,促进身体的消化吸收,因此样品对胆酸盐的结合率可以反映其降血脂的能力[34]。胰脂肪酶可促进脂肪的分解和吸收,抑制胰脂肪酶活性可以减少体内甘油单酯和脂肪酸,从而起到降血脂的作用[35]。如图6A、6B 所示,不同菌株发酵微拟球藻酶液的牛磺胆酸钠结合率和胰脂肪酶抑制率各不相同。其中,KB1、KB2 和KB3 发酵组的牛磺胆酸钠结合率显著增加(P<0.05),分别较CK 组提高2.5%、2.9%和3.3%,而KB4 和MIX 发酵组变化不显著(P>0.05);KB2、KB3 和KB4 和MIX 发酵组的胰脂肪酶抑制率显著提高(P<0.05),与CK 组相比增幅分别为23.9%、20.5%、17.2%和59.4%,而KB1 发酵组变化不显著(P>0.05)。微拟球藻发酵产物的牛磺胆酸钠结合能力和胰脂肪酶活力抑制能力的不同可能与乳酸菌在基质中产生的特异性物质有关[36]。乳杆菌结合胆酸盐能力可能与其产生的胆盐水解酶有关,在厌氧条件下催化分离结合态的胆盐为去结合型胆盐[37],从而提高胆酸盐结合能力,乳酸菌胆盐水解酶不同,催化分离结合态胆盐的能力也就不同,所以发酵牛磺胆酸钠结合率不同。从发酵后胰脂肪酶抑制活性变化可知,混菌发酵后的抑制活性最高,推测其原因可能是多个乳杆菌发酵产生的某些有效物质的组成和结构存在差异,而这些物质在抑制脂肪酶活性上存在一定的协同效应[38]。综上可知,酶菌协同处理微拟球藻是提高其降血脂活性的有效方法。
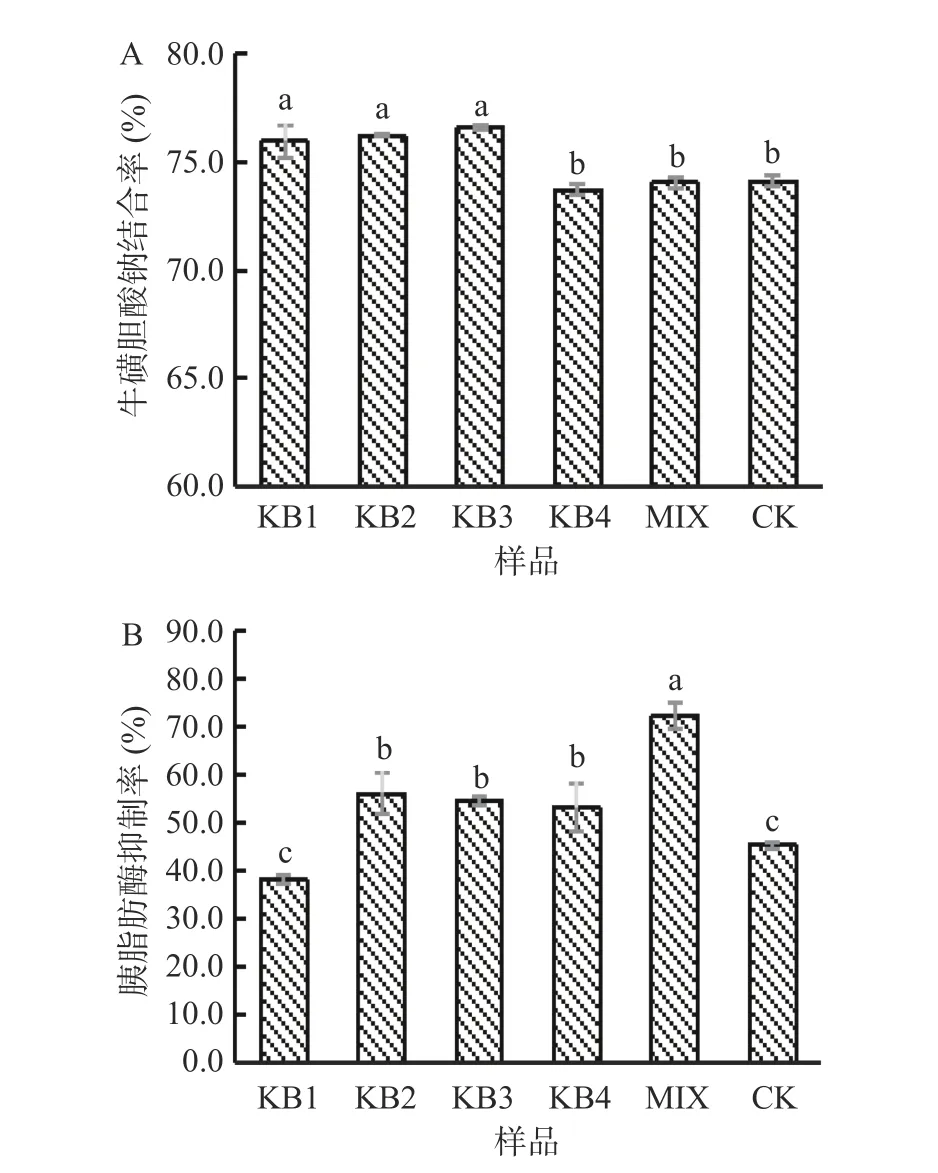
图6 微拟球藻酶解液发酵24 h 后的降血脂活性的变化Fig.6 The change of hypolipidemic activity after 24 h fermentation of enzymatic hydrolysate of Nannochloropsis oceanica
2.6 发酵微拟球藻酶液的感官评定
感官评定总分是香气、滋味、外观色泽、总体可接受性四部分总分之和。由图7 可知,发酵对微拟球藻感官评价有积极作用,未经发酵的CK 组感官评价最低,总分为46.6±8.6 分,发酵后均有提高,且混菌发酵MIX 组为最高总分64.2±6.2 分,二者差异显著(P<0.05),尤其是发酵后滋味显著改善,能明显区别出未发酵与发酵微拟球藻,发酵后的微拟球藻对其自身的腥味等异味有很大的改善作用。

图7 发酵对微拟球藻酶解液感官评定的影响Fig.7 The effect of fermentation on sensory evaluation of enzymatic hydrolysate of Nannochloropsis oceanica
腥味物质主要有多不饱和脂肪酸、醛类、胺类和酮类物质[39],而乳酸菌发酵可以将醛类、酮类等转化为醇类和酯类等风味物质[40],从而缓解不良风味。从感官评定结果可以得知,通过发酵处理可以显著改善风味,特别是混菌发酵效果最佳。混菌发酵能够弥补单一菌株的不足,各菌株之间发挥协同作用,协同众多的酶系参与蛋白质、多糖等复杂成分的合成从而改善风味。顾赛麒等[41]报道了发酵海带后挥发物数量降至24 种且感官评分到达70 分,即发酵可改善海带的感官品质。从本实验来看,尽管微拟球藻经发酵后感官风味有显著提升,但是总体上得分较低,可能是由于该藻本身腥味较重,单纯发酵所改善的程度还很难达到让人愉悦的感官体验,后期还需结合其他去腥和改善风味的方法,从产品研发的角度进一步深入研究。
3 结论
本文以微拟球藻藻泥为原料,采用木瓜蛋白酶酶解微拟球藻,利用单因素和响应面试验获得其最佳酶解工艺为:酶量5.0%、pH8.0、酶解时间4.0 h、酶解温度76 ℃;随后通过益生菌发酵酶解基质,酶菌协同处理后多肽的含量提高了20.9%~126.1%,总酚含量的提高幅度在4.3%~7.2%,同时总黄酮的含量降低幅度在28.1%~47.3%,混菌发酵组DPPH 自由基清除率提高了119.8%而胰脂肪酶清除率提高了59.4%。
综上所述,微拟球藻酶解液发酵后的多肽含量及抗氧化活性和降血脂活性显著提高,具有辅助治疗高血脂的潜在功效。然而后期还需全面分析益生菌发酵对微拟球藻产物中营养功能成分的影响,解析物质变化规律,同时利用动物试验进一步验证其在慢性疾病防治方面的作用效果并阐释相关机制。此外,尽管发酵后风味显著改善,在研发消费者能普遍接受的产品方面还需进行更深入的研究。总之,酶菌协同处理是微拟球藻高值化利用的有效方式,可利用微拟球藻发酵产物开发功能型食品。

