miR-328-3p调控Hspg2参与HCC发生发展研究
李书,唐玉莲,孙丽双,李根亮
(1. 右江民族医学院研究生学院,广西 百色 533000;2. 右江民族医学院医学检验学院,广西 百色 533000;3. 右江民族医学院基础医学院,广西 百色 533000)
肝细胞癌(hepatocellular carcinoma,HCC)是发生在肝细胞的恶性肿瘤,是世界第五大常见癌症和第四大癌症相关死亡原因。HCC具有极高的发病率和致死率,且易转移和复发,发病机制具有复杂性和异质性,很难彻底明确其致病过程。但经研究发现在HCC发生与转移过程中与肿瘤相关的蛋白基因都产生异常表达情况,研究其发生与表达量的变化可能为HCC的诊断治疗提供新靶点。同时明确靶向调控基因的miRNA和ceRNA调控网络有助于进一步提供研究异常基因表达机制的方向。
硫酸乙酰肝素蛋白聚糖2(heparan sulfate proteoglycan 2,Hspg2)位于第四号染色体上,是细胞外基质的重要成分,在基质和基膜中形成屏障结构,是生物信号分子的储存库。Hspg由一个核心蛋白,一个或多个硫酸化的糖胺聚糖和硫酸乙酰肝素链聚合而成的[1]。其中Hspg2存在EGF样结构域和层粘连蛋白结构域,可以通过与相关分子结合进而对细胞分化,运动以及对维持组织表型和促进组织存活起到关键作用。目前有关Hspg2的研究主要集中在血管生成以及神经系统疾病等方面[2-5],而对HCC的发生发展以及调控该基因的相关miRNA和ceRNA的研究甚少。
据此,本课题通过全转录组测序和实时荧光定量PCR(real-time fluorescence quantitative PCR,RT-qPCR),检测Hspg2基因在不同发展阶段肝组织和HCC组织的相对表达情况,并通过深圳华大基因的Dr.Tom多组学交互系统,分析全转录组数据中参与调控Hspg2的相关miRNA、ceRNA和PPI,分析Hspg2在HCC组织中过表达的可能分子机制。
1 材料和方法


1.2 小鼠HCC模型构建和全转录组测序 取100只SPF级别3~6周龄雄性昆明小鼠[长沙市天勤生物技术有限公司,许可证SCXK (湘)2020-0014]构建小鼠HCC 模型。分别收集注射H22肝癌细胞系3~5 d的小鼠的肝组织(OT组)、30~40 d未成瘤小鼠的肝组织(OS组),30~40 d成瘤小鼠的肝组织(C组)、瘤组织(H组)和同样方法生理盐水注射的对照小鼠的肝组织(OO组)。每个样本组织30 mg,重复3组,使用RNA提取试剂盒提取总RNA,送至深圳华大基因股份有限公司进行全转录组测序。本实验使用的实验动物经右江民族医学院动物实验伦理委员会批准(批准号:2020093001)。
1.3 高通量测序和RT-qPCR中各个样本Hspg2的相对表达量 借助华大基因的Dr.Tom多组学交互系统,统计各个样本中Hspg2的表达量,经Excel分析计算平均值和标准差后,GraphPad Prism 8.0绘制表达量图。总RNA提取,收集各样本组织总RNA,后经反转录试剂盒合成cDNA,进行实时荧光定量PCR检测。程序设定为:预变性95 ℃ 300 s。两步法变性95 ℃ 10 s,退火/延伸60 ℃ 10 s,循环40次。熔解曲线和冷却温度等采用仪器默认。采用2-ΔΔCt计算相对定量值,GraphPad Prism 8.0版本绘制相对表达量图。
1.4Hspg2转录本的相对表达量 基于生物信息学分析Hspg2的相关转录组测序数据,分析样本相对表达量和组间的差异情况。差异表达的阈值为:|log2(FPKM比值)|>1、q<0.05(q是q-value,校正的P)、各基因表达的FPKM>10。
1.5Hspg2相关基因的功能分析和互作网络图构建 通过深圳华大基因的Dr.Tom多组学交互系统分析数据,构建Hspg2相关基因的表达量聚类热图。通过miRwalk、TargetScan和ENCORI公共数据库进一步分析存在靶向调控Hspg2的miRNA和发挥ceRNA机制的RNA分子,Cytoscape绘制基因蛋白网络互作图和ceRNA网络图。最后进行GO和KEGG富集分析。
1.6 统计学方法 采用SPSS 20.0和GraphPad Prism 8.0软件和对计量资料进行统计学分析,采用单因素方差分析。P<0.05表示差异有统计学意义。
2 结果
2.1Hspg2在各样本组织中的表达 合成Hspg2和内参Gapdh引物序列(见表1),高通量测序数据和RT-qPCR结果共同显示(见图1),与OO组比较,Hspg2 mRNA在OT组、OS组、C组和H组中均表达上调,H组中明显过表达;测序数据中H组与各个组相比,以及OO组 vs OT组和OO组 vs OS组均有统计学意义(n=3,P<0.05)。在RT-qPCR结果中除H组 vs OS组和OS组 vs C组无统计学差异,其余各组均存在统计学差异(n=3,P<0.05)。

注:A.高通量测序中各样本Hspg2表达量;B.RT-qPCR实验各样本Hspg2表达量。OT组:注射H22肝癌细胞系3~5 d的小鼠的肝组织;OS组:注射H22肝癌细胞系30~40 d未成瘤小鼠的肝组织;C组:注射H22肝癌细胞系30~40 d成瘤小鼠的肝组织;H组:注射H22肝癌细胞系30~40 d成瘤小鼠的瘤组织;OO组:同法生理盐水注射的对照小鼠的肝组织。*P<0.05,**P<0.01,***P<0.001。

表1 RT-qPCR 引物
2.2Hspg2转录本相对表达量 在HCC中存在Hspg2 基因的3个转录本,分别是NM_008305.3、XM_006538575.1和XM_006538573.1(见图2)。转录本XM_006538573.1和NM_008305.3只在瘤组织中明显表达。而XM_006538575.1转录本在HCC组织和各时间段的对照样本中表达量明显增加,也就是说Hspg2基因在HCC组织中的过表达主要是转录本XM_006538575.1。进一步分析发现H组 vs OT组、H组 vs OO组、H组 vs C组、H组 vs OT组、H组 vs OS组差异都具有统计学意义(n=3,P<0.05),见表2。
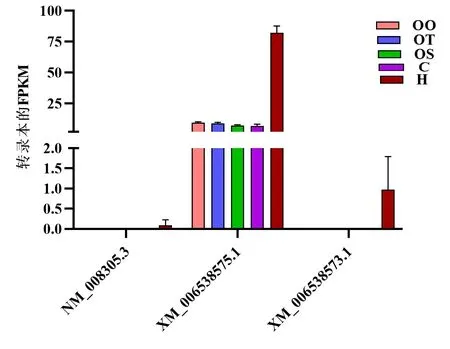
注:OT组:注射H22肝癌细胞系3~5 d的小鼠的肝组织;OS组:注射H22肝癌细胞系30~40 d未成瘤小鼠的肝组织;C组:注射H22肝癌细胞系30~40 d成瘤小鼠的肝组织;H组:注射H22肝癌细胞系30~40 d成瘤小鼠的瘤组织;OO组:同法生理盐水注射的对照小鼠的肝组织。
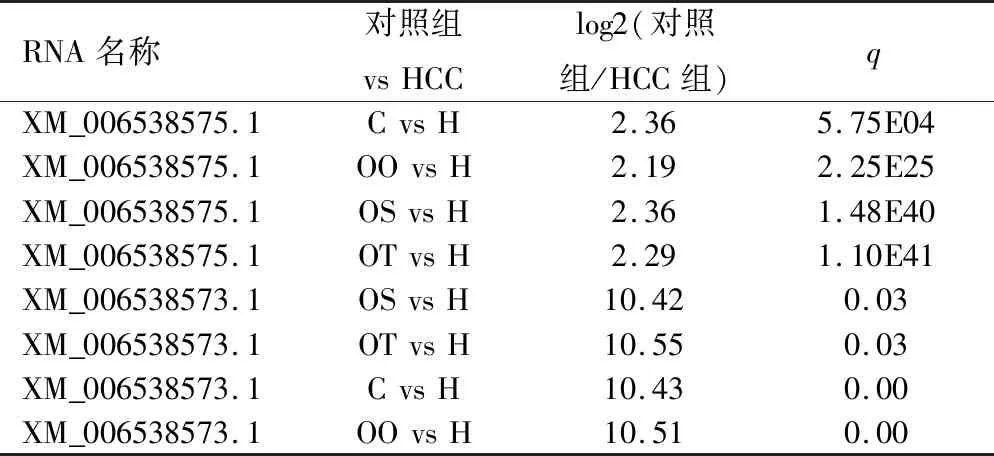
表2 Hspg2转录本在HCC和各时间段的对照样本中的表达量(FPKM)比较 (n=3)
2.3Hspg2相关基因的表达和互作网络分析 通过Hspg2相关基因分析发现HCC中存在大量与Hspg2具有网络互作关系的基因,最为密切联系的有35个(见图3)。聚类热图显示,相关基因在各个样本间表达量存在一定的差异但每个样本的生物学重复的样本中表达量几乎一致,组间也具有一定的差异(见图4)。Hspg2在HCC中表达量较高的前10个相关基因分别是Apoe、Sdc4、Fn1、Vcan、Hs6Dt、Hs3St5、Gpc2、Gpc5、Ndst4、Hs3St2。
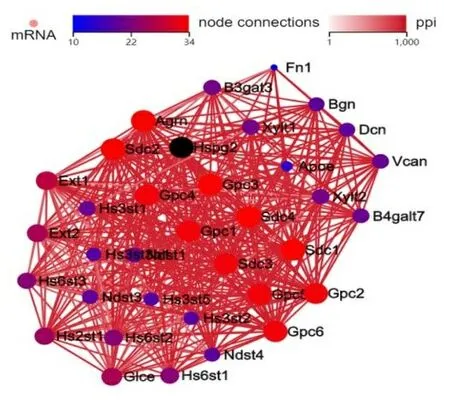
图3 Hspg2相关基因的网络互作图

图4 Hspg2相关基因表达量的样品间聚类热图(A)和组间聚类热图(B)
2.4Hspg2参与的ceRNA网络分析 基于TargetScan、RNAhybrid和miRWalk公共数据库中miRNA靶向关系预测,发现大量miRNA靶向调控Hspg2的表达,3个数据库重叠143个miRNA(见图5A)。进一步分析重叠miRNA测序数据,发现miR-328-3p的靶向关系预测值最高。在ENCORI数据库发现参与竞争结合miR-328-3p调控Hspg2 表达的lncRNA 13个,circRNA 54个(见图5B)。

注:A.miRNA靶向调控Hspg2表达的韦恩图;B.miR-328-3p参与的ceRNA网络图。
2.5Hspg2相关基因的功能分析 对Hspg2相关基因的功能富集分析,发现其主要位于细胞基底膜(GO:0005604),细胞表面(GO:0009986),细胞外基质(GO:0062023),含胶原蛋白的细胞外基质(GO:0062023),胞外区(GO:0005576)等细胞组分部位,通过参与基底膜组织形成(GO:0071711)、细胞黏附(GO:0030155),细胞迁移调控(GO:0030335)和血管生成(GO:0001525)等生物学过程进而发挥细胞基质黏附的胶原蛋白结合(GO:0098639),层粘连蛋白结合(GO:0043236),细胞外基质结合(GO:0050840)等功能,参与糖胺聚糖生物合成,代谢途径和PI3K-Akt-mTOR 等信号通路(见图6)。
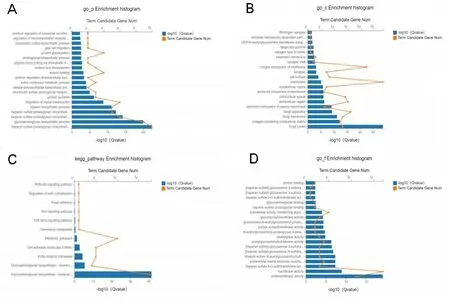
注:A.生物学过程;B.细胞组分;C.分子功能;D.KEGG通路。
3 讨论
研究结果发现Hspg2基因在HCC各样本组织中都上调表达,尤其H组明显,与其它各组比值差异均具有统计学意义。同时找到了Hspg2基因的3个转录本,其中XM_006538575.1转录本在各样本中的表达量相对较高,Hspg2在HCC组织中的过表达主要是转录本XM_006538575.1在HCC组织中的过表达。通过华大基因的Dr.Tom多组学交互系统分析获得35个与Hspg2相关的基因,表明该基因功能的复杂性和作用机制的多样性。基于公共数据库发现miR-328-3p可以靶向调控Hspg2,而各种lncRNA和circRNA可能通过竞争结合靶向调控Hspg2的miRNA构成ceRNA调控网络,进一步精细调控Hspg2基因的表达。对Hspg2 进行功能富集发现其主要位于细胞基底膜(GO:0005604),细胞表面(GO:0009986),细胞外基质(GO:0062023),含胶原蛋白的细胞外基质(GO:0062023)和胞外区(GO:0005576)等细胞组分部位,通过参与基底膜组织形成(GO:0071711),细胞黏附(GO:0030155),细胞迁移调控(GO:0030335)和血管生成(GO:0001525)等生物学过程发挥细胞基质黏附的胶原蛋白结合(GO:0098639),层粘连蛋白结合(GO:0043236)和细胞外基质结合(GO:0050840)等功能。
RT-qPCR结果发现相对于正常小鼠肝组织Hspg2在小鼠肝癌移植瘤中高表达。通过结合国内外的研究证实该基因同样在白血病、前列腺癌以及乳腺癌等癌组织中过表达参与到癌症的发生发展[6-8]。如在胶质瘤中perlecan/Hspg2的过表达,通过将脑细胞外基质转化为肿瘤微环境促进肿瘤发生[9]。近期在国内研究发现[10],Hspg2表达升高与HCC恶化程度密切相关,其可能参与HCC的发生发展,且在肝癌患者血清中显著增加,有可能成为肿瘤标志物的价值。本研究结果发现在调控Hspg2基因中miR-328-3p靶向结合分数最高,在相关miR-328-3p的研究中发现,靶向PYCR1的 miR-328-3p通过阻碍在肺腺癌细胞增殖和迁移来抑制细胞的恶性程度,同时有效促进细胞凋亡[11]。乳腺癌中miR-328-3p miRNA可以介导乳腺癌细胞的雄性激素受体调节,成为一种新的靶向治疗方向[12]。目前在肝癌研究中也发现miR-328-3p调节GLUT1介导的葡萄糖摄取和代谢,可能发挥与化疗药物的协同抗增殖作用[13]。miRNA-328-3p通过调节MMP-9抑制HCC细胞的增殖能力并促进其凋亡[14]。研究证明[15]存在可以竞争性结合miRNA调控Hspg2表达的lncRNA影响肿瘤的发生发展。Hspg2是细胞外基质 (ECM) 的一种高度糖基化的蛋白质成分,拥有大量的分子功能。其中Hspg2具有层粘连蛋白结构域,表皮生长因子结构域和钙结合EGF 样结构域。故此,存在细胞表面,细胞外基质和基底膜位置的Hspg2基因拥有与胶原蛋白、纤连蛋白、整合素、信号受体结合的分子功能,进而参与到细胞黏附连接、血管生成、基底膜形成等生物学过程中。在国内外的研究中发现Hspg2在黑色素瘤和肺癌中高表达,且与血管生成相关,可通过靶向抑制血管的生成有望成为治疗癌症的新手段[16-17]。全基因组测序数据显示HCC中存在Hspg2的突变[18],据此推断Hspg2可能由于存在细胞粘连的细胞组分和分子生物学功能,黏附乙肝等病毒或是Hspg2介导的细胞增殖和血管生成不受限制促进了肝癌的发生发展。
综上所述,Hspg2基因在HCC组织中的过表达和对HCC发生发展的调控可能主要通过以下几个方面实现:一是以XM_006538575.1转录本的过表达参与HCC发生发展;二是ceRNA网络中竞争性结合miR-328-3p进而抑制靶向调控Hspg2的表达;三是多种与Hspg2存在相互协调作用的基因和编码蛋白的异常改变也促进HCC的发生发展。

