改良RECIST评估方法对局部进展期胃癌新辅助化疗后疗效评估的探索
陈金湖, 方燕红, 叶青, 李阳明, 刘声源, 黄峰
作者单位: 福建 福州 350014,福建省肿瘤医院/福建医科大学肿瘤临床医学院 胃肠肿瘤外科
胃癌是消化系统最常见的恶性肿瘤之一,由于大部分早期胃癌缺乏特异性的临床表现,多数患者确诊时已处于进展期。随着胃癌围手术期治疗研究的进展与全球化,新辅助化疗已成为局部进展期胃癌(locally advanced gastric cancer,LAGC)的标准治疗策略[1-3]。术前对胃癌新辅助治疗的疗效评估是非常重要的,将指导后续治疗方案的选择。目前,肿瘤治疗疗效评估主要依据WHO标准[4]和RECIST标准[5]。WHO标准是以肿瘤的最长径与其最大垂直径的乘积来进行疗效评估,而RECIST标准、是采用肿瘤最大直径的变化率来进行疗效评估,更加简单易用,已取代WHO标准,成为目前实体瘤疗效评估的金标准。然而,RECIST标准的使用需要有可测量病灶,因胃为非实质性脏器,胃部病灶在RECIST标准中被定义为非可测量病灶,淋巴结短径需≥1.5 cm才被定义为可测量病灶,从而限制了RECIST标准在胃癌新辅助治疗的疗效评估中的作用。为了寻找更好的胃癌新辅助治疗疗效评估方法,各国学者在此方面进行了大量的探索研究,主要包括使用CT测量肿瘤体积、肿瘤的密度值、肿瘤最大长度、T分期的降期及内镜超声,双源CT碘摄取,MRI的ADC值测定和18F-FDG PET/CT的SUV值测定等[6-8]。然而,在不同研究中结果互相矛盾,目前尚未发现广泛认可的胃癌新辅助化疗的疗效评估方法,且多数研究中评估方法过于繁杂,不利于临床推广应用。因此,为了探索出一种临床上能够简便实用的评估方法,我们设计了这一临床研究课题,应用高分辨率CT测量最大淋巴结短径和胃部病灶最大厚度,分别以最大淋巴结短径和两者之和为评估值,建立两种改良RECIST标准,评估此两种方法在局部进展期胃癌新辅助化疗后疗效评估的作用,以期为临床应用提供简单有效的疗效评估方法。
1 资料与方法
1.1 资料收集 通过数字化病案管理系统检索2016年1月至2020年12月期间福建省肿瘤医院收治的新辅助化疗后行手术治疗的胃癌病例的临床资料。入组标准:①年龄18~80岁;②病理证实为胃癌;③CT诊断为局部进展期胃癌(临床分期:cT3-4N+M0),转移淋巴结短径≥1.5 cm;④初始治疗为全身化疗;⑤手术为胃癌D2手术和(或)扩大切除术;⑥病历资料详细、影像学资料及术后病理学资料完整;⑦新辅助化疗前2周内和手术前2周内均行256排螺旋CT检查。排除标准:①外院化疗后就诊我院手术的病例;②因出血、穿孔、梗阻等肿瘤急症行姑息性手术;③临床分期:M1病例;④合并其他未治愈恶性肿瘤(治愈后≤3年);⑤神经内分泌癌等罕见类型胃癌;⑥参加临床研究未公开数据的病例。本研究经医院伦理委员会审批通过。
1.2 影像疗效评估 RECIST 1.1标准:通过比较化疗前后淋巴结短径之和的改变评价疗效,限定被测靶病灶总数不超过5个,胃部病灶为不可测量病灶。mRECIST①标准:通过比较化疗前后最大淋巴结短径的改变评价疗效,胃部病灶为不可测量病灶。mRECIST②标准:通过比较化疗前后最大淋巴结短径与胃部病灶最大厚度之和的改变评价疗效,将胃部病灶定义为可测量病灶,测量值取胃部病灶最大厚度。
采用PACS软件在256排螺旋CT图像上测定所收集病例新辅助化疗前和手术前最大淋巴结短径和胃部病灶最大厚度,若新辅助化疗前短径≥1.5 cm淋巴结大于1枚,则测量全部短径≥1.5 cm淋巴结新辅助化疗前和手术前的短径。
mRECIST①和mRECIST②的缓解标准均参考RECIST1.1。完全缓解(CR):所有靶病灶消失,全部病理淋巴结短直径必须减少至<1.0 cm;部分缓解(PR):靶病灶直径之和比基线水平减少至少30%;疾病进展(PD):以整个实验研究过程中所有测量的靶病灶直径之和的最小值为参照,直径和相对增加≥20%;除此之外,必须满足直径和的绝对值增加≥0.5 cm;疾病稳定(SD):靶病灶减小的程度没达到PR,增加的程度也没达到PD水平,介于两者之间。将CR和PR病例定义为反应组,SD和PD病例定义为未反应组。
1.3 病理学评估 采用肿瘤退缩分级(tumor regression grade,TRG)[9]TRG 0(完全退缩):无肿瘤细胞残留(包括淋巴结);TRG 1(中等退缩):仅见单个或小灶癌细胞残留;TRG 2(轻微退缩)肿瘤残留但少于纤维化间质;TRG 3(无退缩)广泛肿瘤残留,无或少量肿瘤细胞坏死。将TRG 0、TRG 1和TRG 2病例为反应组,TRG 3定义为无反应组。
1.4 随访 通过数字化病案管理系统查阅各项临床资料,并进行随访,随访方式包括电话随访、门诊复查及查阅住院病历等方式。随访起始时间从患者首次化疗时间起,随访终点为患者出现肿瘤复发、远处转移或死亡。
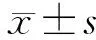
2 结果
2.1 临床资料 共纳入79例淋巴结短径≥1.5 cm新辅助化疗后行D2手术和(或)扩大切除术的局部进展期胃癌病例。男56例,女23例;年龄58(29~72)岁;肿瘤发生部位:近端胃36例(45.6%)、胃体18例(22.8%)、远端胃25例(31.6%);新辅助化疗方案包括两药方案和三药方案,两药方案包括奥沙利铂+氟尿嘧啶类58例(73.4%),紫杉醇类+氟尿嘧啶类8例(10.1%),三药方案为奥沙利铂+氟尿嘧啶类+紫杉醇类13例(16.5%),2例行联合使用信迪利单抗免疫治疗,10例联合应用靶向药物阿帕替尼(这12例系参加临床研究病例);化疗方案中采用2周和3周方案分别为29例(36.7%)和50例(63.3%),中位新辅助化疗周期数3(2~7)周期;手术距首次化疗时间为86(28~204)d;手术方式上,54例(68.4%)行全胃切除术,19例(24.1%)行远端胃大部切除术,6例(7.6%)行近端胃大部切除术,5例行联合脏器切除,3例联合胰体尾及脾切除,1例联合脾切除,1例联合部分横结肠切除;8例行16a2b1组淋巴结清扫术,其中R0切除率77例(97.5%),R1切除2例(2.5%);术后并发症发生率31.6%(25例),包括吻合口瘘3例,吻合口出血3例,胰漏1例,乳糜漏1例,腹腔出血1例,肺部感染9例,腹腔感染5例,肺栓塞1例; 69例(87.3%)行术后辅助化疗,辅助化疗周期3(0~10)周期;未发生围手术期死亡病例。
2.2 预后情况 截至2023年3月31日,完成随访74例,失访5例,随访率达93.7%,距离手术时间52(27~87)个月。43例出现肿瘤复发、远处转移或死亡,肿瘤复发转移37例,其中出现腹膜后淋巴结转移27例、肝转移8例、腹膜转移5例、远处淋巴结转移4例、骨转移2例、肾上腺转移1例、结肠转移1例、残胃复发癌1例,非肿瘤相关死亡或死亡原因不明6例。3年DFS 42.0%,中位DFS为21个月,95%CI:8.9~33.1个月,见图1。
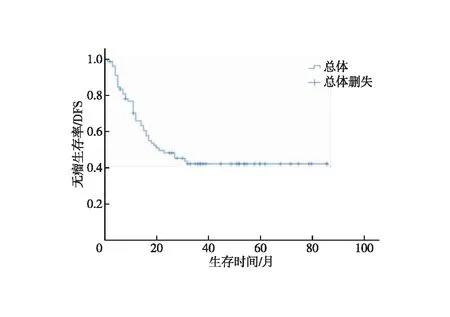
图1 局部进展期胃癌患者新辅助化疗后无瘤生存率分析
2.3 影像学疗效评价 新辅助前和术前CT评估间隔时间为76(25~206)d,约11周。新辅助化疗前CT评估肿瘤最大厚度为1.9(0.6~4.2)cm。共筛选出短径≥1.5 cm的转移性淋巴结103枚,淋巴结短径为2.0(1.5~4.6)cm。术前CT评估肿瘤最大厚度为1.3(0.5-3.5)cm,淋巴结短径为1.2(0.4~3.5)cm。依据RECIST1.1标准进行疗效评价,PR 52例(65.8%)、SD 25 例(31.6%)、PD 2例(2.5%),客观缓解率(ORR)为65.8%。反应组和未反应组的3年DFS差异有统计学意义(53.4%vs.21.6%,P=0.001,图2),反应组与未反应组的死亡风险比,差异有统计学意义(HR=0.386;95%CI:0.211~0.706,P=0.002)。依据mRECIST①标准进行疗效评价,PR 53例(67.1%)、SD 24 例(30.4%)、PD 2例(2.5%),客观缓解率(ORR)为67.1%;反应组和未反应组的3年DFS差异有统计学意义(52.3%vs.22.4%,P=0.003,图3),反应组对未反应组的死亡风险比,差异有统计学意义(HR=0.413;95%CI:0.226~0.756,P=0.004)。依据mRECIST②标准进行疗效评价,PR 48例(60.8%)、SD 29 例(36.7%)、PD 2例(2.5%),客观缓解率(ORR)为60.8%;反应组和未反应组的3年DFS差异有统计学意义(59.0%vs.18.4%,P=0.001,图4),反应组和未反应组的死亡风险比差异有统计学意义(HR=0.376;95%CI:0.204~0.691,P=0.002,图5)。
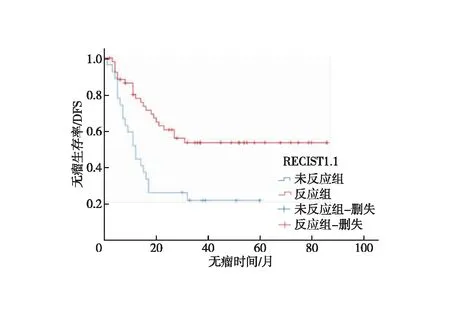
图2 依据RECIST1.1标准反应组与未反应组无瘤生存分析
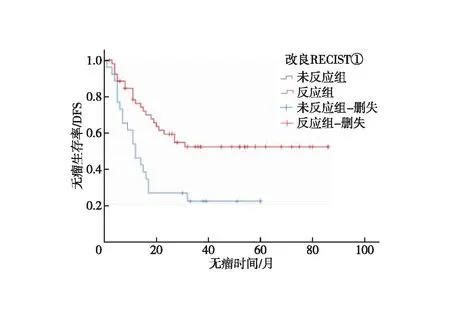
图3 依据改良RECIST①标准反应组与未反应组无瘤生存分析
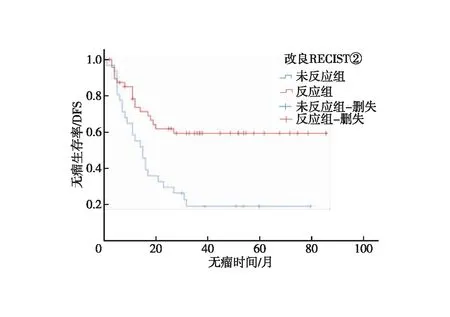
图4 依据改良RECIST②标准反应组与未反应组无瘤生存分析
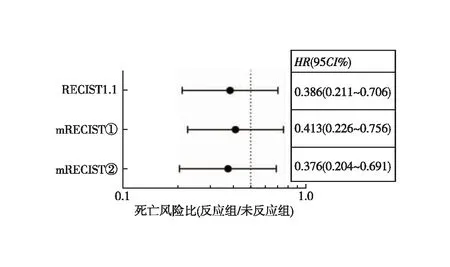
图5 依据不同评价标准反应组与未反应组的死亡风险比
2.4 病理学疗效评估 术后病理T分期:ypT0 12例(15.2%)、ypT1 4例(5.1%)、ypT2 14例(17.7%)、ypT3 4例(5.1%)、ypT4a 43例(54.4%)、ypT4b 2例(2.5%)。病例N分期:ypN0 20例(25.3%)、ypN1 15例(19.0%)、ypN216例(20.3%)、ypN3 28例(35.4%)。病例M分期:ypM0 75例(94.9%)、ypM1 4例(5.1%)。病理学效应:TRG 0级 10例(12.7%)、TRG 1级 11例(13.9%)、TRG 2级 28例(35.4%)、TRG 3级 30例(38.0%)。TRG 0~2级占72.0%。TRG 0~2级和TRG 3的3年DFS差异有统计学意义(1.4%vs.26.8%,P=0.019,图6),死亡风险比差异亦有统计学意义(HR=0.498,95%CI:0.273~0.909,P=0.023)。改良RECIST1.1标准、RECIST①和改良RECIST②标准与病理评估一致性均一般,Kappa系数分别为0.315、0.338和0.279。
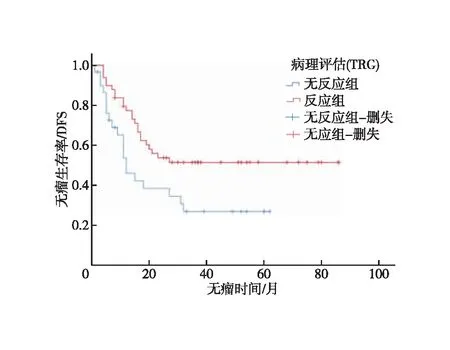
图6 依据肿瘤退缩分级标准反应组与无反应组无瘤生存分析
3 讨论
基于MAGIC和FNCLCC/FFCD 9703研究,在2013年左右,围手术期化疗成为英国和大部分欧洲国家LAGC的标准治疗策略[10]。基于德国的FLOT4-AIO研究结果[11],NCCN指南将围手术期化疗更改为首选推荐,围手术期化疗成为欧美国家LAGC的标准治疗策略。亚洲学者也积极探索围手术期化疗在LAGC中的应用,中国RESOLVE[12]、韩国PRODIGY[13]等研究为亚洲国家LAGC的围手术期最佳治疗选择提供了强有力的循证医学证据,围手术期化疗(新辅助化疗)已成为全球LAGC的标准治疗策略。2018年V1版NCCN指南[2]对胃癌围手术期治疗进行重大更新,在围手术期化疗或术前放化疗后,增加“反应评估”,对于评估手术不可切除者,增加全身治疗选项(之前对这些患者推荐手术治疗)。然而,各大胃癌围手术期化疗研究对在新辅助化疗后均未做详细的术前反应评估,具体如下:MAGIC研究[14]未做任何说明,FNCLCC/FFCD 9703研究[15]中术前末次化疗后2~4周有行CT检查评估是否出现局部肿瘤进展或远处进展,但明确提出未采用WHO或RECIST标准进行疗效评价,FLOT4-AIO研究[11]仍仅在外科手术前行CT(或MRI)和内窥镜检查以排除局部肿瘤进展或远处转移。
RECIST标准是欧洲癌症研究与治疗组织(European Cancer Research and Treatment Organization,EORTC)、美国国家癌症研究所(National Cancer Institute,NCI)及加拿大国立癌症研究所共同制定的新的实体瘤疗效评定标准,初版于在2000年公开发表,2009年再版并做了进一步完善,即RECIST标准(1.1版)[5]。它是一种基于一维测量的评价标准,规定肿瘤病灶最长径>10 mm或恶性淋巴结短径>15 mm(CT扫描层厚<5 mm)为可测量病灶,限定被测靶病灶总数≤5个(每个器官≤2个),通过比较疗前后所测病灶径线之和(包括非结节病灶的最长直径和结节病灶的短直径)的改变评价疗效。依据RECIST标准,胃作为非实质性器官,被定义为非可测量病灶,淋巴结短径需≥1.5 cm才被定义为可测量病灶,而一大部分LAGC并没有短径≥1.5 cm淋巴结,故无法进行影像学疗效评估,从而也可以解释为何各大胃癌围手术期化疗的临床研究未使用RECIST评估标准。
日本JCOG0405研究入组病例为Bulky N者,具体包括:①Bulky N2为3个第2站淋巴结≥1.5 cm或第2站融合成团淋巴结≥3 cm;②16N+为在16a216b1有1个淋巴结≥1 cm;该研究依据RECIST标准进行影像学评估,应答者和无应答者的3年总生存率差异无统计学意义(分别为60.6%和55.6%,P=0.35);相反地,依据组织学进行评估,在组织学上应答者和无应答者3年总生存率分别为73.1%和44.0%,差值为29.1%,有统计学意义(P=0.030)[16-17]。Liu等[18]对48例LAGC进行回顾性研究,共选择短径≥1.5 cm的转移性淋巴结81枚,每个病例LN直径总和化疗前平均1.9 cm(1.5~3.2 cm),化疗后平均1.6 cm(0.3~3.1 cm)。根据RECIST标准评估,17例(35%)患者达到PR,23例(48%)患者SD,8例(17%)患者PD,17例有反应,31例无反应,有反应组和无反应组的中位PFS分别为32个月和19个月(P=0.037),有反应组和无反应组的中位OS分别为43个月和29个月(P=0.012),差异均有统计学意义。以上两个研究结果存在明显差异,考虑RECIST标准作为胃癌新辅助治疗预后预测指标尚存在争议。
本研究回顾性分析79例淋巴结短径≥1.5 cm的新辅助化疗后行D2手术和(或)扩大切除术的胃癌病例,测量最大淋巴结短径和胃部病灶最大厚度,通过比较化疗前后最大淋巴结短径的改变定义为mRECIST①标准和通过比较化疗前后最大淋巴结短径与胃部病灶最大厚度之和的改变定义为mRECIST②标准。依据mRECIST②、mRECIST①和RECIST1.1进行疗效评价,反应组和未反应组的3年无瘤生存率差异均有统计学意义,因此认为3种影像学评估方法均能对胃癌新辅助化疗后疗效进行较好的评估。mRECIST②标准中反应组与未反应组死亡风险比略低于mRECIST①和RICIST1.1标准,HR值分别为0.376、0.386和0.413,因此认为mRECIST②对预后预测作用优于mRECIST①和RECIST。依据TRG评估标准,病理反应率(TRG 0、TRG 1及TRG 2)72.0%,TRG 0~2级和TRG 3的3年无瘤生存率差异有统计学意义,然而反应者对无反应者的死亡风险比为(HR=0.498),均高于mRECIST②、mRECIST①和RECIST1.1。可以看出,mRECIST②、mRECIST①及RECIST1.1标准对无瘤生存率的预测作用均优于TRG评估标准,因此我们认为TRG标准并不是最好的预后预测指标,也可以解释结果中RECIST1.1标准、改良RECIST①和改良RECIST②标准与病理评估一致性均一般相关(Kappa分别为0.315、0.338和0.279)。
两种改良RECIST标准均对局部进展期胃癌新辅助化疗后预后有较好的预测作用,采用最大淋巴结短径与胃部病灶最大厚度之和对局部进展期胃癌新辅助化疗后进行疗效评价略优于只用最大淋巴结短径或淋巴结短径之和进行疗效评价,是一种可选用的简便有效的疗效评估方法。

