直肠癌术后调强放疗降低S2/S3以上计划靶区剂量的临床效果
杨俊昌, 姚成云, 孙晓奕, 吴堂兵, 赵明宏, 夏春军
直肠癌是常见的消化道恶性肿瘤之一,手术是Ⅱ、Ⅲ期直肠癌最主要的治疗手段,但单纯手术治疗后复发率较高,术前放化疗能够提高低位肿瘤的括约肌保存率,是局部晚期直肠癌患者的首选治疗方法;对于未行术前放化疗的患者,术后放化疗亦是强烈推荐的治疗方案[1-3]。文献报道术后常规放疗治疗范围大,易对正常组织造成损伤,发生放射性肠炎反应,影响患者生活质量[4-5]。而调强放疗(intensity modulated radiotheraphy,IMRT)技术能一定程度上降低小肠、膀胱等直肠周围正常组织的受照剂量[6]。严利明等[7]研究显示,直肠癌术后淋巴结阴性患者临床靶区(clinical target volume,CTV)上界降低至S1/S2水平,小肠的V15~V45受照射体积均明显减少,但是剂量学上的优势能否转化为临床获益鲜有文献报道。本研究根据淋巴结复发转移风险及小肠分布范围,在S2/S3水平处分界设置高、低危淋巴引流区,探讨降低S2/S3以上计划靶区(planning target volume,PTV)剂量对小肠高剂量照射体积及患者生存情况的影响。
1 资料与方法
1.1 一般资料
选择2017年3月1日至2019年9月30日于建湖县人民医院普外科行直肠全系膜切除手术(TME)治疗的直肠癌患者60例。纳入标准:①经病理学确诊为直肠腺癌;②TNM分期为Ⅱ、Ⅲ期;③卡氏功能状态量表(Karnofsky Performance Status,KPS)评分≥80分;④心电图、血常规、肝肾功能正常;⑤既往无盆腔放疗病史;⑥签署放化疗知情同意书。排除标准:①T4、N2或远处转移;②有放化疗禁忌证。本组60例患者中男38例,女22例,年龄46~73岁,中位年龄64岁。将患者随机分为对照组和试验组,每组30例。本研究获医院伦理委员会批准(批准号:JY-LL-201709-J004)。
1.2 放疗
1.2.1 CT模拟定位 俯卧位固定体位,CT模拟定位前1.5 h、1.0 h和30 min分次口服20%泛影葡胺20 ml及1 000 ml饮用水充盈膀胱,采用三维激光灯标记一前、两侧等中心体表标记点(扫描时用铅点标记)。采用西门子双源CT(SOMATOM Definition Flash)增强扫描,扫描范围:膈顶水平至股骨上中1/3段,层厚0.5 cm。将扫描图像资料传至Monaco计划系统。
1.2.2 靶区定义和勾画 靶区勾画遵循国际辐射单位与测量委员会(International Commission on Radiation Units and Measurements,ICRU)第83号报告[8]原则。临床靶区(clinical target volume,CTV)包括原发肿瘤高危复发区域(直肠癌术后瘤床、直肠周围系膜、骶前、坐骨直肠窝)和区域淋巴引流区(髂总血管淋巴引流区、直肠系膜区、髂内血管淋巴引流区、闭孔淋巴引流区)。在S2/S3水平处分界设置高、低危淋巴引流区,S2下缘以下淋巴结引流区设为高危区CTV1,S2下缘以上淋巴结引流区设为低危区CTV2。PTV为CTV前后、左右外放0.7 cm,头脚方向外放1.0 cm。PTV1、PTV2分别为CTV1、CTV2前后、左右外放0.7 cm,头脚方向外放1.0 cm。危及器官参照美国放射肿瘤协会(RTOG)[9]要求勾画:小肠(上界为PTV上缘1 cm处,下界勾画小肠结束)、膀胱、双侧股骨头。
1.2.3 计划设计 对照组:PTV处方剂量为50 Gy/25 f,2.0 Gy/f。试验组:PTV1处方剂量为50 Gy/25 f,2.0 Gy/f;PTV2处方剂量为45 Gy/25 f,1.8 Gy/f。危及器官:小肠V30<40%,Dmax<52 Gy;膀胱V50<50%;股骨头V50<5%。IMRT计划在ELEKTA precise直线加速器施照。
1.2.4 评价参数 根据ICRU83号报告,靶区剂量评估参数包括:PTV所接受最大剂量Dmax即2%PTV受到的剂量(D2%)、最小剂量Dmin即98%PTV受到的剂量(D98%)。靶区均匀性指数(homogeneity index,HI)为(D2%-D98%)/D50%,HI值越小,靶区均匀性越好;靶区适形度指数(conformal index,CI)为靶区接受的处方剂量/靶区体积×靶区接受的处方剂量/全身接受处方剂量体积,CI值越接近1,适形度越好。危及器官剂量参数:小肠45 Gy、50 Gy受照射体积(cc)及小肠V10、V20、V30、V40、V45、V50;膀胱V20、V30、V40、V45、V50。
1.3 化疗方案
患者术后均接受以卡培他滨为基础的同期化疗或辅助化疗。①放疗同期化疗:1 250 mg/m2,2次/d,治疗2周后停药1周,3周为1个疗程。②辅助化疗:XELOX方案,奥沙利铂130 mg/m2第1天静滴,卡培他滨1 000 mg/m2,2次/d,治疗2周后停药1周,3周为1个疗程,共4疗程。
1.4 观察指标
1.4.1 基本资料 收集患者手术方式,肿瘤距肛缘距离0~5 cm行Miles手术,6~10 cm行Dixon手术;肿瘤分化程度:1级、2级、3级;T分期:T1、T2、T3、T4;N分期:N0、N1、N2;参照美国癌症联合会(AJCC)分期第8版分期标准:TNM分期为Ⅰ、Ⅱ、Ⅲ、Ⅳ期。
1.4.2 放化疗不良反应 根据CTCAE V4.03标准[10]评价并记录放化疗不良反应,包括放射性肠炎、放射性膀胱炎、放射性皮炎、白细胞减少、血小板减少、血红蛋白减少,分为1~5级。
1.5 随访
术后采用门诊复诊及电话等方式对患者进行随访,每3个月随访1次,随访截止时间为2022年9月30日。统计两组患者的总生存期(overall survival,OS)、无局部复发生存期(locoregional relapse-free survival,LRFS)、无远处转移生存期(distant metastasis free survival,DMFS)。
1.6 统计学方法
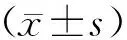
2 结果
2.1 临床资料特点的比较
两组患者年龄、性别、手术方式、肿瘤位置、肿瘤分化程度、T分期、N分期、肿瘤分期等临床资料比较差异均无统计学意义(P>0.05,表1)。

表1 两组患者临床资料比较
2.2 靶区和危及器官剂量分布的比较
2.2.1 两组HI和CI比较 对照组、试验组HI分别为0.053±0.004、0.055±0.006,组间差异无统计学意义(n=30,t=1.831,P=0.083)。两组CI分别为0.681±0.033、0.688±0.030,组间差异无统计学意义(n=30,t=1.651,P=0.115)。
2.2.2 两组小肠、膀胱剂量分布比较 试验组小肠V50、V45明显低于对照组(P<0.05),两组小肠V10、V20、V30、V40差异均无统计学意义(P>0.05,表2、图1)。两组膀胱V20、V30、V40、V45、V50差异均无统计学意义(P>0.05,表3、图1)。
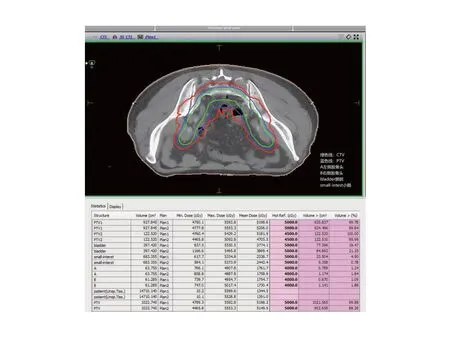
图1 1例直肠癌Dixon术后靶区及剂量分布图 男性,67岁,T3N1M0(Ⅲ期)
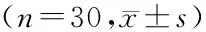
表2 两组小肠剂量分布比较

表3 两组膀胱剂量分布比较
2.3 急性不良反应
两组放射性肠炎差异有统计学意义(P<0.05),其中对照组以1、2级为主,试验组以0、1级为主。对照组有7例患者出现1~2级放射性膀胱炎,试验组有8例患者出现1~2级放射性膀胱炎,无3级急性反应,差异无统计学意义(P>0.05)。两组放射性皮炎、白细胞减少、血小板减少、血红蛋白减少差异均无统计学意义(P>0.05,表4)。
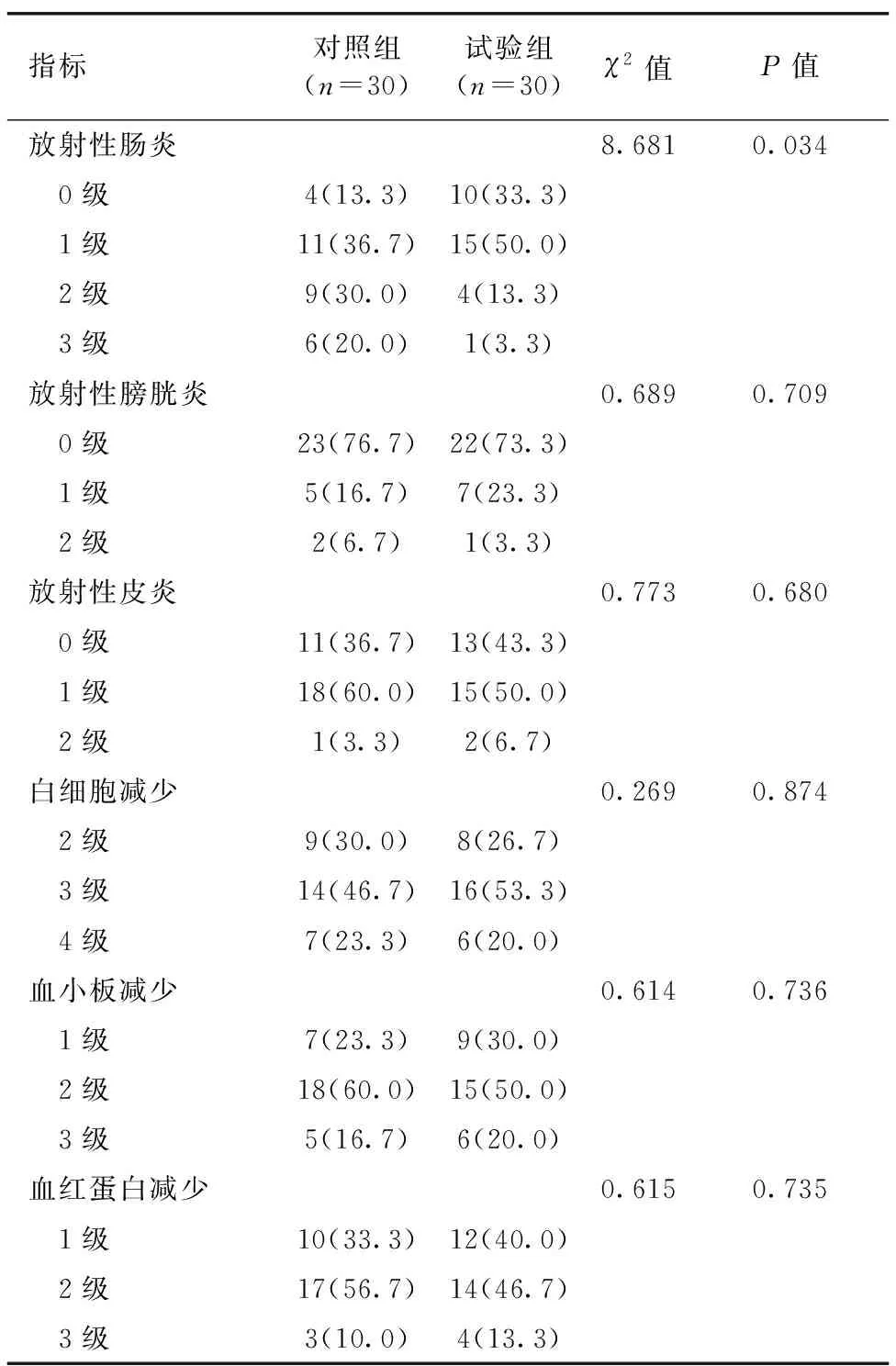
表4 两组患者放化疗的急性不良反应比较[例(%)]
2.4 近期生存情况的比较
全组患者均获随访,随访时间为14~66个月,中位随访时间为47个月。对照组1、3年LRFS分别为93.3%、83.3%,试验组为93.3%、86.7%,两组患者LRFS差异无统计学意义(χ2=0.116,P=0.734,图2);对照组1、3年DMFS分别为96.7%、80%,试验组为93.3%、83.3%,两组患者DMFS差异无统计学意义(χ2=0.110,P=0.741,图3);对照组1、3年OS分别为100.0%、86.7%,试验组为100%、90%,(χ2=0.164,P=0.685,图4)。对照组有5例出现局部区域复发,其中1例坐骨直肠窝复发,4例直肠系膜区及髂内淋巴结引流区复发;有6例出现远处转移,其中有3例局部复发合并远处转移;4例患者死亡,死于肿瘤广泛转移器官衰竭。试验组有4例出现局部区域复发,其中1例坐骨直肠窝复发,3例直肠系膜区及髂内淋巴结引流区复发;有5例出现远处转移,其中有2例局部复发合并远处转移,3例患者死亡,死于肿瘤广泛转移器官衰竭。9例局部区域复发均为盆底或S2/S3水平以下的盆腔淋巴结引流区复发。
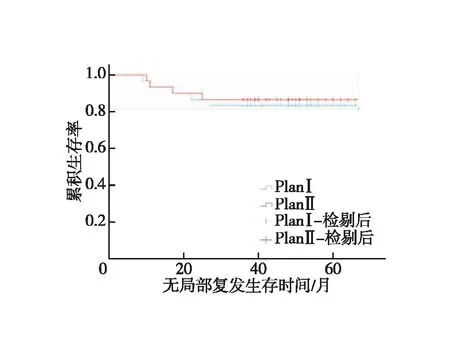
图2 两组患无局部复发生存时间的Kaplan-Meier曲线
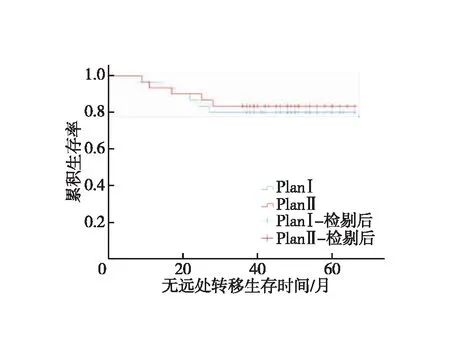
图3 两组患者无远处转移生存时间的Kaplan-Meier生存曲线
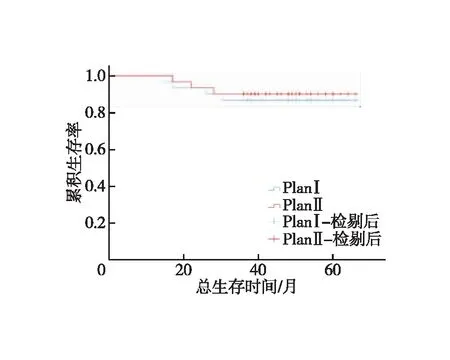
图4 两组患者总生存时间的Kaplan-Meier曲线
N0和N1亚组分析。①N0患者:对照组1、3年LRFS分别为100.0%、90.0%,试验组为100.0%、87.5%,两组LRFS差异无统计学意义(χ2=0.015,P=0.904,图5);对照组1、3年DMFS分别为100.0%、90.0%,试验组为100.0%、87.5%,两组DMFS差异无统计学意义(χ2=0.015,P=0.904,图6);两组1、3年OS均为100.0%。②N1患者:对照组1、3年LRFS分别为90.0%、80.0%,试验组为90.9%、86.4%,两组LRFS差异无统计学意义(χ2=0.296,P=0.586,图7);对照组1、3年DMFS分别为95.0%、75.0%,试验组为90.9%、81.8%,两组DMFS差异无统计学意义(χ2=0.253,P=0.615,图8);对照组1、3年OS分别为100.0%、80.0%,试验组为100.0%、86.4%,两组OS差异无统计学意义(χ2=0.296,P=0.586,图9)。
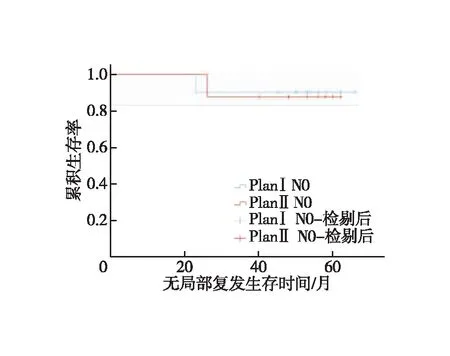
图5 N0患者无局部复发生存时间的Kaplan-Meie存曲线
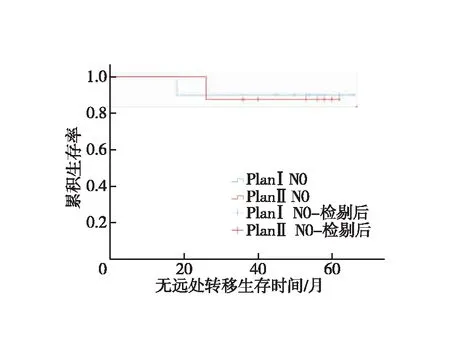
图6 N0患者无远处转移生存时间的Kaplan-Meier曲线
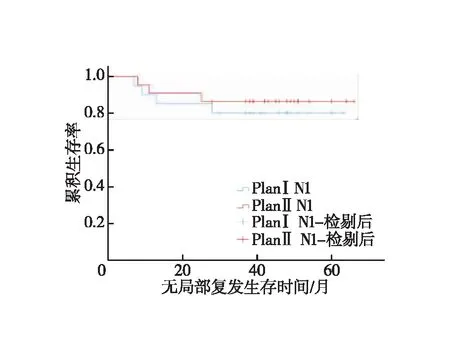
图7 N1患者LRFS的Kaplan-Meier曲线
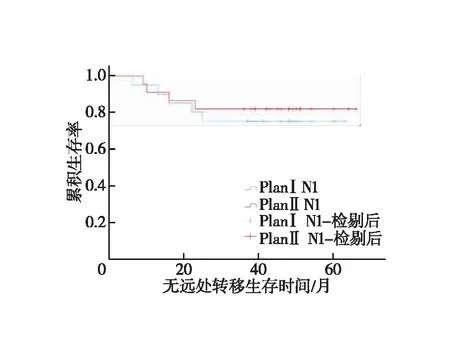
图8 N1患者无远处转移生存时间的Kaplan-Meier生存曲线

图9 N1患者总生存时间的Kaplan-Meier生存曲线
3 讨论
随着肿瘤精确放疗技术及设备的不断发展,IMRT技术已广泛用于直肠癌放射治疗,其主要通过提高靶区适形度增加肿瘤组织剂量及减少周围正常组织受量,可在同一次治疗过程中对不同照射区域给予不同的照射剂量,与三维适形放疗(three dimensional conformal radiation therapy,3D-CRT)技术比较,减少了小肠的受照射体积和剂量,降低放射性肠炎的发生率[11-12]。
多项研究显示,在接受IMRT治疗的直肠癌患者中,俯卧位并采用有孔腹部定位装置和充盈膀胱可以有效降低小肠V5~V20低剂量照射体积,但是25~45 Gy高剂量受照体积无明显减少[13-15]。Nijkamp等[16]在3D模型研究发现直肠癌患者将CTV上界下移至S2/S3水平,可以减少15~35 Gy受照射的小肠体积达80%。Li等[17]研究发现直肠癌患者术前行IMRT,盆腔淋巴结引流区照射剂量降为41.8 Gy,2年LRFS为94.3%,OS为96%。而Hernando-Requejo等[18]研究发现,直肠癌患者术前行IMRT,盆腔淋巴结引流区照射剂量为46 Gy,3年OS达95%。上述研究提示适当降低S2/S3水平以上淋巴结引流区放疗剂量不会影响患者的近期生存情况。本研究中试验组降低S2/S3以上PTV剂量至45 Gy,而S2/S3以下PTV剂量仍为50 Gy,小肠的V45、50低于对照组,明显减少了小肠V45、50高剂量受照体积,而小肠V10~V40及膀胱V20~V50差异均无统计学意义。Gallagher等[19]报道小肠高剂量照射体积V45>78 cc或V50>17 cc明显增加肠道不良反应的发生率。Perna等[20]研究认为小肠接受45 Gy、50 Gy(V45≥50 cc、V50≥13 cc)的照射体积可作为急性2级放射性肠炎的预测指标。小肠V45、V50高剂量受照射体积与放射性肠炎的发生密切相关。对照组V50、V45受照射体积分别为(28.80±13.26)cc和(61.60±28.42)cc,而试验组为(6.30±6.20)cc和(45.50±24.10)cc,试验组仅3.3%患者出现3级急性放射性肠炎,明显低于对照组20%,而后者与Chen[21]、Li等[22]报道结果相似(19.23%和20.5%)。
官雯菊等[23]研究发现,直肠癌T分期对TME术后骶前及髂内淋巴结引流区复发无明显影响,N分期对骶前淋巴结引流区复发无明显影响,而N+与N0间髂内淋巴结引流区复发差异有统计学意义,但该研究未对N1、N2期进一步分层与N0期进行比较。本研究进一步行N0和N1亚组分析显示,N0和N1患者LRFS、DMFS、OS在试验组与对照组间差异均无统计学意义,有9例局部区域复发均为盆底或S2/S3水平以下的高危盆腔淋巴结引流区复发。因此,笔者认为Ⅱ、Ⅲ期直肠癌患者降低S2/S3以上水平PTV放疗剂量至45 Gy是安全可行的。
综上,Ⅱ、Ⅲ期直肠癌术后IMRT降低S2/S3以上PTV剂量可缩小小肠V45、V50高剂量受照体积,降低急性放射性肠炎发生率,且对近期生存情况无明显影响,而对患者远期疗效及不良反应的影响尚需进一步研究验证。

