替吉奥联合吉西他滨在胰腺癌根治术后的应用效果
查颖,王俊,黄钲焘,曾鹏飞,王国兴,刘凯
胰腺癌为临床常见消化道恶性肿瘤,胰腺癌确诊后,5年生存率为10%,是临床恶性肿瘤中预后较差的一种[1]。胰腺癌病变早期症状隐匿,无典型性,临床诊断难度较大,近年来该病发病率和病死率明显增高。多数患者确诊时均错失手术最佳时机,即使接受病变局限根治术,术后转移率和复发率仍较高,疾病预后、手术根治率差。因此,临床多在胰腺癌根治术后辅以化疗治疗。1997年时,吉西他滨已成为临床治疗胰腺癌的一线药物[2];近年临床实践显示,两药联合(白蛋白结合型紫杉醇、吉西他滨)、三药联合(FOLFIRINOX)所获得的疗效,比单一使用吉西他滨更佳,并可延长患者生存时间,但不良反应发生率升高和治疗费用增加,临床应用存在局限性。替吉奥为氟尿嘧啶类药物,不良反应少,使用方便[3]。与单一使用吉西他滨比较,吉西他滨联合替吉奥治疗可延长胰腺癌患者无进展生存时间,提升疗效。鉴于此,本研究观察替吉奥联合吉西他滨在胰腺癌根治术后的应用效果,报道如下。
1 资料与方法
1.1 临床资料 回顾性选取2018年1月—2023年1月遵义医科大学第三附属医院/遵义市第一人民医院收治的胰腺癌行胰腺癌根治术患者68例,按照术后用药方案不同分为观察组和对照组,各34例。观察组男23例,女11例;年龄42~69(54.15±1.19)岁;肿瘤位置:胰体、胰尾部12例,胰头部22例;分期:Ⅲ期14例,Ⅳ期20例;分型:未分化癌9例,腺癌10例,囊腺癌15例。对照组男22例,女12例;年龄41~68(54.65±1.25)岁;肿瘤位置:胰体、胰尾部13例,胰头部21例;分期:Ⅲ期17例,Ⅳ期17例;分型:未分化癌10例,腺癌9例,囊腺癌15例。2组患者临床资料比较差异无统计学意义(P>0.05),具有可比性。本研究通过医院伦理委员会审核批准。
1.2 纳入及排除标准 纳入标准:符合《中国胰腺癌诊治指南》[4]中胰腺癌诊断标准,经活检、细胞学检查、经内镜逆行胰胆管造影术(ERCP)、CT、B超等检查确诊;满足胰腺癌根治术手术指征。排除标准:入组前已接受生物治疗、放疗、化疗者;血常规、肝肾功能异常者;其他恶性肿瘤者,如乳腺癌、肺癌等;精神、认知障碍者;预估生存时间<3个月者;Karnofsky评分≥60分者;中途转院或未按医嘱用药、未配合结果指标检测者。
1.3 治疗方法 对照组予注射用盐酸吉西他滨(Lilly France S.A.S.生产)1 000 mg/m2第1、8天静脉滴注,滴注时间<30 min;卡培他滨片(上海罗氏制药有限公司生产)1 250 mg/m2第1~14天饭后口服,每天2次。观察组予吉西他滨(用法用量同对照组)联合替吉奥胶囊(山东新时代药业有限公司生产)每次60 mg饭后口服,每天2次,第1~14天连续给药。21 d为1个周期,2组均持续治疗4个周期。治疗期间密切监测患者体征,如肝肾指标、血常规等,并实施对症干预。
1.4 观察指标与方法 (1)血清肿瘤标志物:治疗前后采集患者空腹静脉血4 ml,离心处理分离血清,使用全自动生化分析仪(迈瑞-BS220型),采用酶联免疫吸附试验检测糖类抗原19-9(CA19-9)、糖类抗原153(CA153)、糖类抗原125(CA125)、癌胚抗原(CEA);(2)T淋巴细胞和NK细胞计数:治疗前后采集患者空腹静脉血3 ml,离心处理分离血清,使用流式细胞仪检测CD8+、CD4+、CD3+、NK细胞计数;(3)生存率:随访患者1年,记录其6个月、1年生存率;(4)不良反应:包括胃肠道反应、肝肾心功能损害、骨髓抑制等。
1.5 疗效评定标准 依据《中国胰腺癌诊治指南》[4]中胰腺癌判定标准评估疗效,完全缓解:肿瘤标志物水平恢复正常,1个月内未发生新病灶;部分缓解:1个月内,病灶直径缩小≥30%;稳定:病变无恶化,或直径缩小<30%;进展:出现新病灶或靶病灶直径增加≥5 mm。

2 结 果
2.1 治疗效果比较 观察组完全缓解率为88.24%,高于对照组的55.88%(χ2=8.838,P=0.003),见表1。
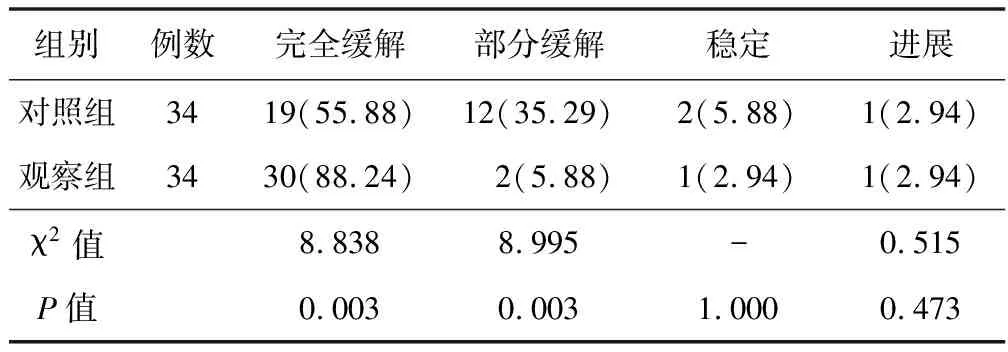
表1 对照组与观察组治疗效果比较 [例(%)]
2.2 血清肿瘤标志物比较 治疗前,2组CA19-9、CA153、CA125、CEA水平比较差异无统计学意义(P>0.05);治疗4个周期后,2组CA19-9、CA153、CA125、CEA水平低于治疗前,且观察组低于对照组(P均<0.01),见表2。

表2 对照组与观察组治疗前后血清肿瘤标志物比较
2.3 T淋巴细胞亚群和NK细胞计数比较 治疗前,2组CD8+、CD4+、CD3+及NK细胞计数比较差异无统计学意义(P>0.05);治疗4个周期后,2组CD8+、NK细胞计数低于治疗前,CD4+、CD3+高于治疗前,且观察组变化幅度大于对照组(P均<0.01),见表3。

表3 对照组与观察组治疗前后T淋巴细胞亚群和NK细胞计数比较
2.4 生存率比较 观察组随访6个月生存率为73.53%、随访1年生存率为52.94%,高于对照组的47.06%、26.47%(P均<0.05),见表4。

表4 对照组与观察组生存率比较 [例(%)]
2.5 不良反应比较 观察组与对照组不良反应总发生率比较差异无统计学意义(11.76% vs. 14.71%,P=1.000),见表5。

表5 对照组与观察组不良反应比较 [例(%)]
3 讨 论
胰腺癌为临床较为常见的消化性肿瘤病变,其恶性度高。相关报告称,胰腺癌若在治疗上无突破性进展,预估2030年则成为导致美国居民癌症死亡的主要原因之一[5]。目前临床治疗胰腺癌的唯一方案为手术切除,但早期胰腺癌患者的症状隐匿,仅表现为大便形状或习惯变化、恶心、背痛、上腹痛等非特异性症状,造成患者首次就诊时确诊率仅为15%~20%[6]。随着医学技术改进和新型仪器引进,胰腺癌微创手术和开放手术疗效、安全性均明显提升,但术后复发率、转移率高和手术总切除率低,患者预后不佳,其5年生存率<10%[7]。近年临床实践发现,治疗胰腺癌仅依赖外科手术,无法确保疗效[8]。20世纪90年代后,辅助治疗已成为胰腺癌根治术后的标准疗法,主要包含辅助放化疗、辅助化疗。
王喆等[7]研究发现,胰腺癌患者体内BNIP3蛋白水平与吉西他滨化疗敏感性有关,胰腺癌根治术后接受吉西他滨化疗,其无进展生存时间可达14个月,总生存时间达18个月,甚至更长。证实了胰腺癌根治术后使用吉西他滨治疗的有效性,但单一用药效果不理想。杨若朦等[9]报道112例晚期胰腺癌患者,发现经GS化疗(吉西他滨+替吉奥)的疾病控制率71.43%与AG化疗(吉西他滨+白蛋白紫杉醇)的疾病控制率83.93%差异无统计学意义,GS方案在成本方面更具优势,对恶性肿瘤患者来说,在保证经济同时疗效也有所保障。本研究结果显示,观察组完全缓解率高于对照组,提示吉西他滨联合替吉奥的疗效更好。分析原因为,吉西他滨为二氟核苷类抗代谢性药物,存在细胞周期特异性,主要作用于病灶细胞DNA合成阶段,其进入细胞内经脱氧胞苷激酶磷酸化生成双氟脱氧胞苷三磷酸核和双氟脱氧胞苷二磷酸活性产物,阻碍鸟苷配对和DNA合成,停止合成DNA链,进而导致DNA断裂,促使病灶细胞凋亡,胞苷脱氧酶代谢活性丧失[10]。替吉奥主要成分为奥体拉西钾、替加氟、吉美嘧啶等,杀灭病灶细胞同时,对健康组织有保护作用,其靶向作用良好。药物中所含的替加氟抗癌效果显著;吉美嘧啶为二氢嘧啶脱氢酶抑制剂,可降低替加氟带来的个体差异,延长药效时间,增强疗效。
CA19-9为低聚糖肿瘤抗原,属于细胞膜糖脂质,在血清中主要表现形式为唾液黏蛋白,为目前评估胰腺癌敏感性最高的一种标志物。CA153为临床评估乳腺癌的常用特异性标志物,主要来源于具备分泌功能的上皮细胞,如子宫、胃肠道、肺、乳腺等,正常人体排泄物中其水平偏低,若发生癌变则会显著增高。CA125为糖蛋白性肿瘤相关抗原,主要存在于卵巢肿瘤上皮细胞中,因此临床多将其用于评估子宫内膜癌、卵巢癌。CEA为人类胚胎抗原特性的酸性糖蛋白,其用于临床监测和筛查多个肿瘤病变,如胃肠癌等。已有报道显示,CA125、CEA、CA19-9在胰腺癌患者体内呈高表达。强馨等[11]报道称,CEA、CA19-9等指标与胰腺癌患者病理分期呈正性关系,用于初筛胰腺癌病情有积极意义。本研究显示,观察组血清肿瘤标志物优于对照组,提示替吉奥联合吉西他滨、治疗效果更优。分析原因为,替吉奥属于氟尿嘧啶新兴衍生物,药物中所含的吉美嘧啶,对5-氟尿嘧啶(5-FU)转变为二氢嘧啶脱氢酶有选择性拮抗效果,进而增加机体5-FU浓度。所含的替加氟属于5-FU前体药,经人体口服后,具备较高生物利用率,并可在机体中转变为5-FU,具有抗肿瘤作用。吉西他滨联合替吉奥可加强对DNA合成的抑制效果,并阻碍细胞增殖和分裂,具备较强抗肿瘤功效。本研究还显示,观察组治疗后免疫指标改善明显,生存率高于对照组,且未明显增加不良反应。
综上所述,胰腺癌根治术后患者接受吉西他滨联合替吉奥治疗,可有效控制机体血清肿瘤标志物,抑制病变进展,且可改善机体免疫功能,延长患者术后生存时间。但本研究受研讨时间等多因素影响,未分析替吉奥胶囊使用剂量是否会影响疗效,此后研究可将其作为重点分析内容。
利益冲突:所有作者声明无利益冲突。

