金属药物在肿瘤免疫原性细胞死亡中的研究进展
王欣如,郝炳荣,孙丽新,李欣(中国药科大学江苏省药效研究与评价服务中心,南京 210009)
恶性肿瘤已成为全球主要的致死性疾病之一,对人类的生命健康构成了严重的威胁,为全球经济带来了沉重的负担[1-2]。目前,恶性肿瘤的治疗手段以手术切除、化学疗法、放射疗法等常规方法为主,而这些方法具有副作用大、疗效差、易转移和复发率高等缺点,容易导致患者预后不良甚至死亡[3]。免疫疗法是一种新兴的治疗手段,弥补了传统治疗方法的不足[4]。其中,诱导肿瘤细胞发生免疫原性细胞死亡(immunogenic cell death,ICD)是免疫疗法的一种类型。该疗法表现为化疗在非特异性杀伤肿瘤细胞时可以通过多种机制增强肿瘤细胞的免疫原性,肿瘤细胞在发生死亡的同时,由非免疫原性转化为免疫原性而介导抗肿瘤免疫应答,激活免疫系统攻击肿瘤细胞,从而抑制肿瘤生长甚至根除肿瘤。
以往的观点认为金属药物主要通过非特异性细胞毒性作用杀死肿瘤细胞。然而,越来越多的证据表明,顺铂、奥沙利铂、三氧化二砷等经典金属化疗药物和新型金属配合物在发挥细胞毒性的同时,还可以诱导机体产生抗肿瘤免疫反应[5-6]。金属药物诱导抗肿瘤免疫反应的作用涉及免疫效应器的直接激活或失活、肿瘤细胞的免疫识别以及诱导ICD等多个方面[7]。
本文就ICD的作用机制、分子标记及ICD诱导剂的研究现状进行综述,并在此基础上总结可诱导ICD的金属药物的研究进展,以期为开发诱导ICD的金属药物提供参考。
1 诱导肿瘤细胞发生ICD的分子机制
ICD是一种调节性细胞死亡(regulated cell death,RCD),也是一种新型的肿瘤免疫治疗方法[8]。在放疗和部分类别化疗药物的作用下,垂死的肿瘤细胞可产生大量的活性氧(reactive oxygen species,ROS),产生的ROS通过激活特定的信号通路或直接作用于内质网,引发内质网应激。在内质网应激的驱动下,许多ICD相关的损伤相关分子模式(damage associated molecular patterns,DAMPs)[如钙网蛋白(calreticulin,CRT)、高迁移率族蛋白1(high mobility group protein 1,HMGB1)、腺苷三磷酸(adenosine triphosphate,ATP)等]被运输或分泌到细胞外,这些DAMPs会促进树突状细胞(dentritic cell,DC)的成熟活化,成熟的树突状细胞通过活化γδT细胞使其产生白细胞介素-17(IL-17),增加细胞毒性T细胞(cytotoxic T lymphocytes,CTLs)对肿瘤组织的杀伤,或者直接将抗原呈递给CTLs[9],CTLs被招募到肿瘤微环境(tumor microenvironment,TME)后,在肿瘤坏死因子-α(tumor necrosis factorα,TNF-α)、干扰素-γ(interferon-γ,IFN-γ)等各种促炎细胞因子的作用下杀伤残留的肿瘤细胞[10](见图1)。
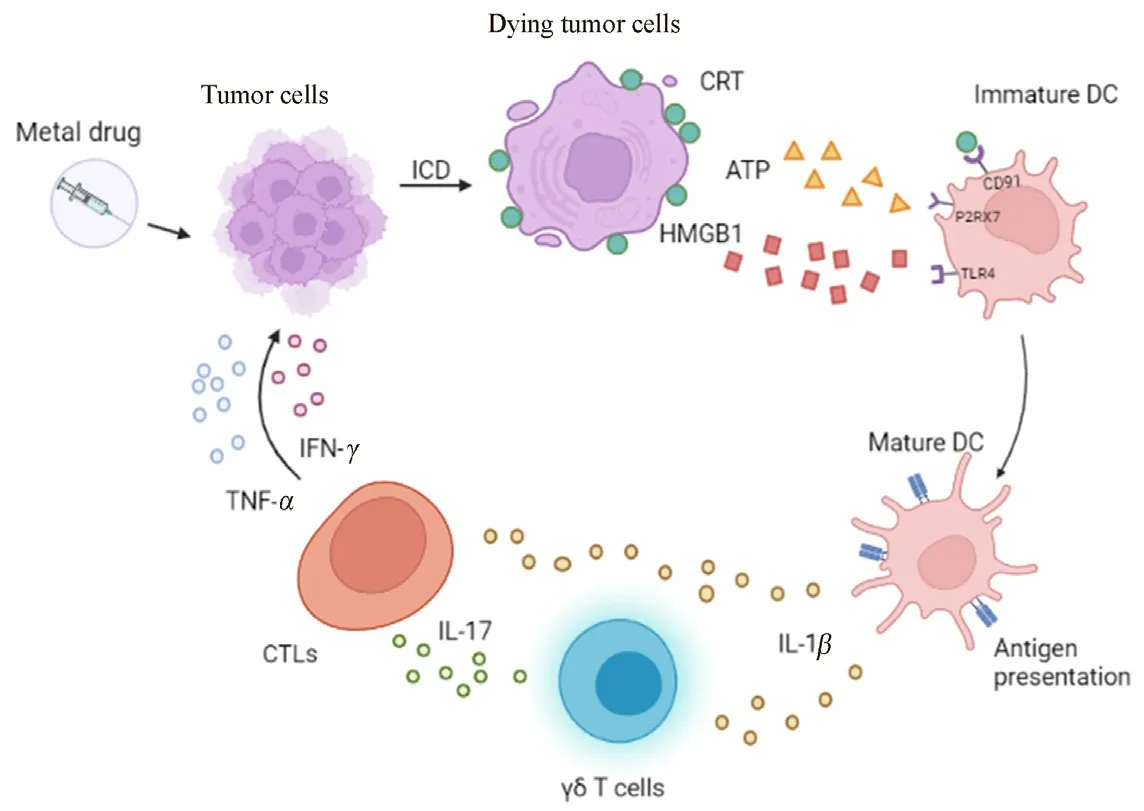
图1 ICD死亡机制的示意图Fig 1 Scheme of mechanism of ICD
当肿瘤细胞发生ICD时,释放的DAMPs除了CRT、HMGB1和ATP之外,还包括热休克蛋白(heat shock protein,HSP)、Ⅰ型干扰素(type 1 IFN)和膜联蛋白A1(annexin A1,ANXA1)等。下文将综述这些与ICD相关的DAMPs激活免疫系统的作用机制。
1.1 CRT在ICD中的作用机制
CRT是一种46 kDa的Ca2+结合蛋白,是内质网腔中最丰富的蛋白质之一,具有分子伴侣活性和调节Ca2+稳态的功能[11]。在ICD发生早期,诱导剂激活蛋白激酶R样内质网激酶(protein kinase RNA-like endoplasmic reticulum kinase,PERK),导致真核起始因子2α(eukaryotic initiation factor 2 alpha,eIF2α)被磷酸化,进而募集转录激活因子4(activating transcription factor 4,ATF4),最终使内质网发生应激反应[12]。在应激作用下,CRT通过胞吐的形式转运到细胞膜外,内质网蛋白57(endoplasmic reticulum protein 57,ERp57)重新定位,一旦CRT与ERp57复合物暴露在细胞表面,就会发出“Eat me”信号,诱导肿瘤抗原呈递并刺激机体发生特异性免疫反应,杀伤细胞[13]。
1.2 HMGB1在ICD中的作用机制
HMGB1是一种染色质结合蛋白。在ICD发生后期,由于细胞膜透化,HMGB1被释放到细胞外,可与抗原呈递细胞上的模式识别受体结合[14]。HMGB1与Toll样受体4(Toll-like receptor 4,TLR4)结合后会活化髓样分化因子(myeloid differentiation primary response gene 88,MyD88),抑制吞噬体和溶酶体的融合,从而加速树突状细胞的成熟和对抗原成分的吞噬[15-16]。
1.3 ATP在ICD中的作用机制
ICD发生过程中分泌ATP需要自噬的调控,这意味着自噬缺陷的肿瘤细胞将无法引发相关的免疫反应[17]。ATP被分泌后,作为“Find me”信号与嘌呤受体P2Y2相互作用,将未成熟的树突状细胞、巨噬细胞和中性粒细胞吸引到垂死肿瘤细胞部位[18]。此外,ATP还可介导核苷酸与嘌呤受体P2X7的相互作用,引起NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)炎症小体的激活,从而使促炎细胞因子分泌增加[19]。
1.4 HSPs在ICD中的作用机制
HSP70和HSP90在垂死肿瘤细胞膜上的表达具有免疫刺激特性[20]。在发生ICD时,HSP70转移到细胞膜上,与共刺激分子CD40相互作用从而促进包括CTLs在内的CD8+T细胞的活化[21];HSP90与树突状细胞上的CD91相互作用从而促进肿瘤抗原向CTLs的交叉呈递。这些过程促进了机体免疫系统的激活,对治愈肿瘤具有重要意义。
1.5 Type 1 IFN在ICD中的作用机制
Type 1 IFN是启动免疫应答、激活效应T细胞和自然杀伤细胞的关键细胞因子,具有抗病毒和免疫调节作用[22-23]。当肿瘤细胞发生ICD时,胞质核酸分泌到胞外,内源性RNA激活Toll样受体3(Toll-like receptor 3,TLR3)产生Type 1 IFN,导致CXC-趋化因子配体10(CXC chemokine ligand-10,CXCL10)释放,从而发挥免疫刺激作用[24]。同时,胞质DNA的积累会通过激活cGASSTING通路诱导树突状细胞分泌Type 1 IFN,进而增强CD8+T细胞和自然杀伤细胞(NK细胞)的杀伤作用,并提高记忆T细胞的活力[25-26]。
1.6 ANXA1在ICD中的作用机制
ANXA1在中性粒细胞、嗜酸性粒细胞和单核细胞等多种细胞中存在[27]。ANXA1与磷脂结合并影响类花生酸的产生[28],对炎症的调节和消退具有重要作用。在ICD发生过程中,垂死肿瘤细胞释放ANXA1,激活抗原呈递细胞并促使其向肿瘤细胞迁移,促进免疫细胞对肿瘤细胞的吞噬[29]。
2 ICD诱导剂研究现状
自首次发现阿霉素具有ICD诱导能力之后,多种临床药物也被发现可以诱导ICD,这些药物被统称为ICD诱导剂。在体外检测肿瘤细胞经药物处理后ICD相关DAMPs只能确定药物是否具有诱导ICD的潜力,因此还需进行小鼠疫苗接种实验来进一步评价其是否为ICD诱导剂。小鼠疫苗接种实验模型(见图2)于2005年由Casares等[30]首次提出,在体外用受试化合物诱导小鼠肿瘤细胞死亡,然后将处理过的垂死肿瘤细胞接种到具有免疫活性的同源小鼠的一侧,一周后,将相同类型的未处理的肿瘤细胞接种到小鼠的另一侧。接种后,监测无瘤小鼠的比例,能够显著减少肿瘤发生的化合物即可被认为是ICD诱导剂。这是由于被ICD诱导剂处理过的垂死肿瘤细胞可作为“无毒抗原”,注射时激活小鼠免疫系统,当表达相同抗原的肿瘤细胞再次被接种后,免疫系统原有的记忆再次激活,产生强烈的免疫应答来阻止肿瘤细胞的生长,发挥“肿瘤疫苗”的作用。因此,诱导肿瘤细胞发生ICD具有提高肿瘤治疗效果和改善患者预后的潜力。
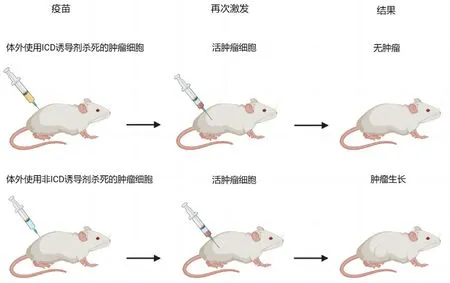
图2 ICD的实验性定义Fig 2 Experimental definition of ICD
除了小鼠疫苗接种实验之外,涉及ICD发生过程的多种相关指标也用于ICD诱导剂的评估标准,包括各种DAMPs的水平、T细胞的数量、T细胞的免疫表型(如确定CTLs的表型)、相关细胞因子的水平(如IFN-γ、TNF-α),通过检测这些指标可提示ICD诱导剂作用的可能位点[31]。
研究发现ICD诱导剂主要作用于各种细胞器,例如内质网、溶酶体、线粒体和细胞核[32]。内质网应激被认为是触发ICD的关键事件。Vanmeerbeek等[33]发现大多数ICD诱导剂具有诱导内质网应激的能力。因此,根据ICD诱导剂诱发肿瘤细胞内质网应激机制的差异对其进行分类。ICD诱导剂被分为Ⅰ型、Ⅱ型两种类型(见表1),其中Ⅰ型是ICD诱导剂的主要类型[34]。Ⅰ型诱导剂作用于肿瘤细胞后,通过靶向细胞溶质蛋白、影响DNA复制、干扰质膜和线粒体膜通道等间接介导内质网应激,导致细胞发生氧化应激从而诱导ICD[35]。Ⅱ型诱导剂与Ⅰ型的不同之处在于它直接选择性地作用于内质网,改变其稳态使内质网应激从而诱导ICD。与Ⅰ型诱导剂相比,Ⅱ型诱导剂可增加DAMPs的分泌,具有更强的ICD诱导能力,在抗肿瘤免疫方面更有优势[36]。
已知的临床ICD药物大都属于Ⅰ型诱导剂,这些ICD诱导剂可能依赖于特定的肿瘤类型,即一种肿瘤的ICD诱导剂可能对另一种肿瘤无效,因此现有的药物无法满足临床需求[37]。通过表型筛选,已经发现了一些具有ICD 诱导能力的天然产物,如辣椒素、紫草素、白藜芦醇等[38]。
与此同时,除了奥沙利铂,多种直接作用于内质网的金属配合物也被发现可以诱导ICD,提示金属配合物除了具有细胞毒性作用之外,还可以通过诱导ICD发挥抗肿瘤作用,这可以提升金属配合物的临床使用价值,也为ICD诱导剂的开发提供了一个丰富的资源库。
3 金属配合物在诱导ICD中的作用
与有机化合物相比,金属配合物具有结构多样性、配体交换、氧化还原特性和催化特性等性质[39],因此能够实现独特的作用机制。越来越多的金属配合物被证明具有诱导ICD的能力,下面将系统概述金属配合物作为ICD诱导剂的研究进展。
3.1 铂类药物在诱导ICD中的作用
顺铂、卡铂和奥沙利铂等铂类配合物用于全世界超过50%癌症患者的治疗[40],是应用最广泛的抗肿瘤药物之一,对多种癌症具有公认的疗效。长期以来,人们普遍认为铂类药物的抗肿瘤机制是通过损伤DNA从而引起肿瘤细胞死亡[41]。然而,最近发现此类药物还可以通过诱导肿瘤细胞发生ICD,进而增强免疫系统对肿瘤细胞的杀伤作用,实现更优的抗肿瘤效果。
3.1.1 经典铂类药物 在诱导ICD方面,不同的铂类药物之间表现出很大差异。Tesniere等[42]发现奥沙利铂可以在结肠癌细胞中引发ICD介导免疫反应,顺铂则不能,其原因可能是奥沙利铂会引起结肠癌细胞强烈的内质网应激反应。另一项研究评估了一线抗肿瘤药物卡铂的免疫原性作用,结果显示,与奥沙利铂、顺铂不同,卡铂在多种非小细胞肺癌细胞系中可以引发CRT易位,但在非小细胞肺癌细胞系A549中却不能引发CRT易位,且不能促使ATP和HMGB1释放[43]。这提示了经典铂类药物的ICD诱导能力可能具有一定的肿瘤细胞选择性,但目前的研究仍较少。
3.1.2 新型Pt(Ⅱ)配合物 除了经典的铂类药物,一些通过结构修饰开发出的Pt(Ⅱ)配合物,也表现出了很强的ICD诱导效应。Wong等[44]报道了除FDA批准的铂类药物外第一个可引起ICD的金属配合物Pt-NHC。后续研究发现,Pt-NHC诱导ICD是通过直接触发内质网应激产生ROS介导的,属于Ⅱ型ICD诱导剂[45]。对Pt-NHC结构进行修饰得到Platin-ER[46],发现其是通过促进小鼠结肠癌细胞CT26中HSP90的释放从而诱导肿瘤细胞发生ICD。Huang等[47]报道了一种含有氨基磷酸盐配体的新型铂(Ⅱ)配合物Pt-1,Pt-1可以诱导人膀胱癌细胞发生ICD,同时还可促进树突状细胞成熟以及IFN-γ、TNF-α分泌增加。Yamazaki等[48]报道了一种含焦磷酸盐配体的铂(Ⅱ)配合物PT-112,它可与免疫检查点阻断(immune checkpoint blockade,ICB)疗法协同作用诱导更强的免疫反应。PT-112与PD-L1阻断剂联用还可促进CTLs浸润,这种ICD和ICB协同作用的新方法,有望在结直肠癌的治疗中产生更好的疗效。这些新型的Pt(Ⅱ)药物,都是在发挥原有的化疗作用的同时,引发了ICD反应,提示其具有化疗与免疫治疗相结合的能力,该类药物具有良好的开发前景。
3.1.3 新型Pt(Ⅳ)药物 相较于Pt(Ⅱ)配合物,新型Pt(Ⅳ)药物具有配体交换惰性的特点,且易进行功能化修饰,同时新颖的结构和多样化的活性机制使其拥有了更多优异的性质。Sabbatini等[49]报道了一种以组蛋白脱乙酰酶抑制剂为配体的Pt(Ⅳ)配合物,可促进结肠癌细胞的免疫调节作用,诱导强大的ICD反应。Groer等[50]将Pt(Ⅳ)-生育酚与透明质酸纳米载体络合,开发了一种ICD诱导剂HA-Pt(Ⅳ),在口腔鳞状细胞癌细胞中可促进CRT外翻,在小鼠疫苗接种实验的免疫健全小鼠中观察到良好的肿瘤抑制效果。Sun等[51]设计合成了辣椒素衍生物修饰的铂(Ⅳ)化合物,该化合物不仅会导致DNA损伤,还可引发人胰腺癌细胞PANC-1细胞CRT的易位,并伴随ATP和HMGB1的释放,对人胰腺癌细胞表现出有效的ICD诱导作用。目前Pt(Ⅳ)配合物诱导ICD的构效关系尚未明确,推测轴向上接入的配体的化学结构和生理功能可能是Pt(Ⅳ)配合物诱导ICD的关键因素。因此,进一步探寻其构效关系将有助于新型可诱发ICD的Pt(Ⅳ)配合物的设计开发。
合理设计的光笼铂配合物,可以用光实时控制并激活,有助于避免“脱靶”效应并可以引发ICD介导的抗肿瘤反应。基于这些潜在的益处,Deng等[52]报道了一种基于奥沙利铂的光笼Pt(Ⅳ)前药,它可实现有效地核仁积累以及“按需”激活。在光激活后,可诱导顺铂耐药肺癌细胞发生ICD,以独特的作用方式逆转耐药,这为设计可控激活和靶向核仁的Pt(Ⅳ)前药提供了一种新方向。Novohradsky等[53]报道了一种可被光活化的Pt(Ⅳ)配合物,在被可见光激活后具有强细胞毒性,能产生Pt(Ⅱ)并释放叠氮基和羟基自由基,同时通过引发自噬促进释放DAMPs从而诱导ICD。这种独特的免疫调节特性使光笼铂配合物有别于其他铂类药物,可能会显著增强抗肿瘤功效,同时也证实自噬在促进垂死细胞释放ATP,增加免疫原性方面发挥重要作用。
3.2 铱配合物在诱导ICD中的作用
铱(Ⅲ)配合物由于具有强大的抗肿瘤活性而被关注并进行研究。近年来,有文献报道铱(Ⅲ)配合物具有诱导ICD的作用。
Wang等[54]研究设计了一个含有环磷酰胺类似物的Ir(Ⅲ)配合物,其在A549细胞中选择性定位于内质网并引起CRT外翻、促进HMGB1和ATP释放。但在人乳腺癌细胞(MDA-MB-231)中ICD诱导效率低下,说明该铱配合物诱导ICD依赖于特定的肿瘤类型,但具体机制尚不清楚。Vigueras等[55]报道了一种光活化的Ir(Ⅲ)配合物,其作用于人黑色素瘤细胞A375后选择性定位于线粒体和内质网并引发ICD,提示该Ir(Ⅲ)光敏剂作为ICD诱导剂开发具有良好的前景。Wang等[56]最新报道了一种可高效诱导ICD的光敏剂Ir(Ⅲ)复合物Ir-pbt-Bpa,在光照射下产生单线态氧和超氧阴离子自由基,通过同时诱导铁死亡和ICD的方式杀伤黑色素瘤细胞,从而实现长期的抗肿瘤作用。综上,这些Ir(Ⅲ)配合物具有复合功能,在直接作用于肿瘤细胞时,还可通过ICD抑制肿瘤,综合发挥药效,为后续铱配合物的开发提供了参考。
3.3 钌配合物在诱导ICD中的作用
由于钌(Ru)配合物不仅可以与DNA结合,还具有较强的蛋白结合能力,因此基于钌的金属配合物很早就开展了抗肿瘤活性研究。目前,已有四种钌基配合物作为抗肿瘤药物进入临床研究[57]。然而,直到近些年,钌配合物作为ICD诱导剂的潜力才开始得到关注。
Wernitznig等[58]对一种已进入临床研究的钌基药物KP1339进行了ICD诱导能力研究。通过人结肠癌细胞HCT116细胞球体模型研究发现,KP1339可以介导结肠癌细胞产生CRT易位以及其他ICD相关的标志物。他们还设计了一种Ru(Ⅱ)芳烃配合物plecstatin-1[59],在人结肠癌细胞中可以使ROS增加,刺激CRT暴露,介导伴侣蛋白HSP70和HSP90的表达增加,从而诱导ICD。许多基于钌的金属配合物是高效的光敏剂,Konda等[60]设计了两种具有双重抑制模式的Ru-PDT复合物ML19B01和ML19B02可以在黑色素瘤细胞中通过光动力疗法(photodynamic therapy,PDT)诱导ICD,并激活炎症通路,使肿瘤生长延迟、肿瘤负荷减少,提示了钌类药物有望通过联合PDT提高抗肿瘤效果,甚至防止肿瘤复发。
3.4 金配合物在诱导ICD中的作用
金配合物作为潜在的抗肿瘤剂越来越受到关注。金配合物主要是通过抑制硫氧还蛋白还原酶(thioredoxin reductase,TrxR)活性发挥细胞毒性作用。直到最近,有研究发现金配合物可刺激免疫系统发生免疫反应,诱导肿瘤细胞发生ICD[61]。
Sen等[62]报道了一种含萘醌结构的化合物Au(Ⅰ)-NHC,它可通过升高ROS的水平和减少ROS的失活来诱导肿瘤细胞死亡,其中大多是通过诱导ICD导致的肿瘤细胞死亡。Mule等[63]研究了一种具有强效抗肿瘤效果的新型Au(Ⅰ)配合物BQ-AurIPr,能够有效促进DAMPs的产生,显著增加肿瘤细胞的免疫原性,与FDA批准的诱导ICD的药物阿霉素和奥沙利铂相比,具有更高的ICD诱导效率。金诺芬(auranofin,AF)是一种金配合物,1985年被批准用于风湿性关节炎的治疗。AF是一种TrxR抑制剂,Van等[64]报道了一种将AF和低温常压等离子体联合处理的策略,联合治疗后发现,胶质母细胞瘤细胞中TrxR活性降低、ROS水平升高,ICD相关的DAMPs分泌显著增加,提示AF具备ICD诱导能力。综上,这些金配合物都表现出了强大的ICD诱导能力,大多通过升高细胞内ROS的水平介导内质网应激来触发ICD。
3.5 铜配合物在诱导ICD中的作用
铜(Cu)是一种内源性金属,当其与适当的配体形成铜配合物时,可用于提高细胞内的ROS水平。这为设计铜配合物的ICD诱导剂提供了思路。Kaur等[65]研究了一种靶向内质网并产生ROS的铜配合物,该配合物在乳腺癌干细胞中可以诱导ICD,从而有效抑制乳腺癌干细胞的增殖。Wang等[66]报道了一种可有效诱导ICD的铜基纳米级配合物Cu-NCPs,其在与放射治疗联用时显示出协同作用,结合PD-L1阻断疗法可增强免疫反应,提示Cu-NCPs作为ICD诱导剂在肿瘤治疗中具有应用前景。
除了以上几类常见的具有抗肿瘤活性的金属配合物可诱导ICD外,最近一些含其他金属(如砷[67]、铁[68]、锇[69]等)的配合物也被证实具有诱导ICD的能力,其诱导机制包括介导ROS产生、内质网应激等,说明金属药物诱导肿瘤细胞发生ICD的研究受到了更多的关注,这有助于提高金属药物ICD诱导剂的研究水平和后续的开发研究。
4 总结与展望
现有的研究表明从垂死肿瘤细胞中释放的DAMPs可以激活特定抗肿瘤免疫反应的能力,诱导ICD从而发挥抗肿瘤作用。诱导ICD是一种新型肿瘤免疫疗法,具有良好的临床应用前景。
在确认ICD的研究中,还有很多需要继续解决的问题,如导致某种细胞死亡方式具有免疫原性的因素尚不清楚,对影响垂死肿瘤细胞免疫原性的因素也了解不多。目前的ICD 研究主要是在肿瘤细胞和肿瘤疫苗接种模型(小鼠疫苗接种实验)中进行的,但小鼠疫苗接种实验具有明显的限制性且只有少量同基因肿瘤模型;更重要的是,由于不同物种间的不相容性,也无法评估人类肿瘤细胞在小鼠体内的免疫作用,因此构建合适的体内筛选与验证模型变得尤为重要,如开发原位和基因工程小鼠模型以测试ICD。
了解肿瘤治疗药物诱导释放DAMPs和激活机体免疫系统的分子途径和分子机制可评估其将细胞死亡的非免疫原性诱导剂转化为ICD诱导剂的潜力,也可为改进肿瘤疫苗接种策略提供理论参考。相比于其他类型的ICD诱导剂,金属ICD诱导剂的开发具有作用强的特点,但仍然存在一些亟待解决的问题。金属药物诱导ICD的能力目前还不能根据其化学结构或性质来预测,因此确定金属药物与诱导ICD之间的构效关系是目前亟待解决的问题。确定合适的剂量和给药时间以实现最优的免疫治疗效果是金属ICD诱导剂临床研究的重要挑战。
总之,诱导ICD的金属药物是抗肿瘤药物研究的一个快速发展的领域,已经显示出良好的应用前景。随着研究的深入和研究水平的提高,具有ICD作用的金属药物将获得更多的关注和研究,并为临床肿瘤的免疫治疗提供新的治疗药物。

