氢氧化亚铁被氧化生成红褐色固体现象的探究

摘要: 从氢氧化亚铁被氧化过程中遇到的实际问题出发,从理论与实践两个方面对该实验产生的异常现象进行分析、讨论。实验中有红褐色固体物质生成,红褐色固体渐渐变暗。用磁铁靠近红褐色固体时,红褐色固体(沉淀)中有部分固体能被磁铁吸引。说明氢氧化亚铁的氧化产物中含有一定量的四氧化三铁。
关键词: 氢氧化亚铁制备; 氧化反应; 实验探究
文章编号: 1005-6629(2023)09-0084-03 中图分类号: G633.8 文献标识码: B
1 问题提出
《普通高中化学课程标准(2017年版2020年修订)》对“氢氧化亚铁的制备”提出了活动建议[1];人教版、鲁科版和苏教版教材中也都设计了该实验:在FeSO4溶液中加入NaOH溶液[2~4],观察实验现象。教材中对该实验的现象描述为:在试管中加入NaOH溶液,产生的白色沉淀逐渐转化为灰绿色,最后变为红褐色固体,这是氢氧化亚铁被空气中的氧气氧化为氢氧化铁的缘故。实验过程中发生的化学反应为:FeSO4+2NaOHFe(OH)2↓+Na2SO4、 4Fe(OH)2+O2+2H2O4Fe(OH)3。
笔者在多年的教学中一直认为,该实验最后得到的红褐色固体为Fe(OH)3,没有其他物质生成。在本学期一次上课的过程中,笔者让学生分组完成氢氧化亚铁的制备,有一位学生站起来说,他们小组得到红褐色沉淀的颜色又变暗了,好像红褐色沉淀中有黑色固体产生。听到该小组的结果后,每个小组都对自己小组的沉淀进行了认真观察,大多数小组发现实验中产生的红褐色固体渐渐变暗,甚至有些发黑。红褐色固体为什么会逐渐变暗、发黑,难道有新的物质产生了吗?
2 推测和设计实验证明红褐色固体变暗的原因
通过查阅文献资料,发现有关该问题的研究较少,周改英等在“对氢氧化亚铁制备实验的商榷与建议”一文中提出[5],白色Fe(OH)2一旦生成便会缓慢转化为Fe3O4等物质,混合物的颜色随时间的推移而逐渐加深,但文章中并未通过实验证明Fe(OH)2在缓慢氧化的过程中生成Fe3O4。
实验中红褐色固体变暗是产生了四氧化三铁吗?带着这个问题笔者和学生对红褐色的固体进行了分析与探究。根据中学化学知识,FeO和Fe3O4均为黑色且难溶于水的固体,其中的黑色固体可能是FeO或Fe3O4。FeO和Fe3O4又是如何产生的呢?硫酸亚铁和氢氧化钠反应的过程,先生成了白色沉淀,一段时间后产生了少量的褐色固体Fe(OH)3,此时沉淀是Fe(OH)2和Fe(OH)3的混合物。FeO中铁元素的价态为+2价,如果产生了氧化亚铁,则FeO可能是白色沉淀Fe(OH)2分解的产物。在无氧的环境下,将白色氢氧化亚铁固体放置一段时间后,若产生黑色固体,则说明红褐色固体变暗是由于Fe(OH)2分解產生了FeO。Fe3O4中铁元素的价态既有+2也有+3价,如果在亚铁盐和铁盐的混合溶液中加入氢氧化钠,溶液中立即产生黑色固体,则说明红褐色固体变暗是由亚铁盐、铁盐和氢氧化钠共同产生了四氧化三铁。四氧化三铁具有磁性,用磁铁靠近变暗的固体,若固体能被磁铁吸引,则可说明实验过程中红褐色固体变暗的原因是生成了四氧化三铁。
3 实验探究黑色固体的成分
3.1 在氢氧化钠溶液中加入少量硫酸亚铁溶液的反应
(1) 实验步骤:在小试管中加入10mL 8mol·L-1氢氧化钠溶液,将胶头滴管伸入到液面下,逐滴加入0.1mol·L-1硫酸亚铁溶液,挤一滴,移动胶头滴管的位置,再挤一滴……,当试管中产生了较多的白色沉淀时,停止加入硫酸亚铁溶液[6],立即用一橡胶塞塞住试管口,观察实验现象。
(2) 实验现象:当在氢氧化钠溶液中加入硫酸亚铁溶液时,产生悬浮于液面的白色沉淀,沉淀慢慢下沉,一段时间后,白色沉淀沉降在试管的底部,整个过程不产生灰绿色沉淀,一段时间后试管底部的固体仍为白色。
(3) 实验结论:在浓的氢氧化钠溶液中加入硫酸亚铁稀溶液,白色沉淀的颜色一直未发生改变,说明制备氢氧化亚铁时,产生的氢氧化亚铁若要一直保持白色状态,需要氢氧化钠溶液过量,防止生成的氢氧化亚铁吸附溶液中未反应的二价铁离子,使白色固体变为灰绿色[7]。由于试管底部的固体一直处于白色状态,说明氢氧化亚铁不易发生分解产生氧化亚铁。
3.2 在硫酸铁溶液中加入氢氧化钠溶液的反应
(1) 实验步骤:在试管中加入10mL 0.1mol·L-1硫酸铁溶液,用胶头滴管加入2mol·L-1的氢氧化钠溶液,一段时间后,用强力磁铁靠近试管中的固体,观察实验现象。
(2) 实验现象:在硫酸铁溶液加入氢氧化钠溶液,试管中立即产生红褐色沉淀。一段时间后,红褐色沉降在试管的底部,且固体的颜色一直处于红褐色,用强力磁铁靠近试管底部的红褐色固体时,固体不能被磁铁吸引。
(3) 实验结论:固体的颜色一直未发生变化,且红褐色不能被磁铁吸引,说明氢氧化铁沉淀未发生分解。
3.3 亚铁盐和铁盐的混合物与氢氧化钠溶液的反应
(1) 实验步骤:在试管中依次加入5mL 0.2mol·L-1的硫酸亚铁溶液和硫酸铁溶液,然后在其中滴加几滴2mol·L-1的氢氧化钠溶液,当溶液中产生沉淀时,在试管外用磁铁靠近试管底部,将磁铁由试管底部慢慢移向液面,观察实验现象。
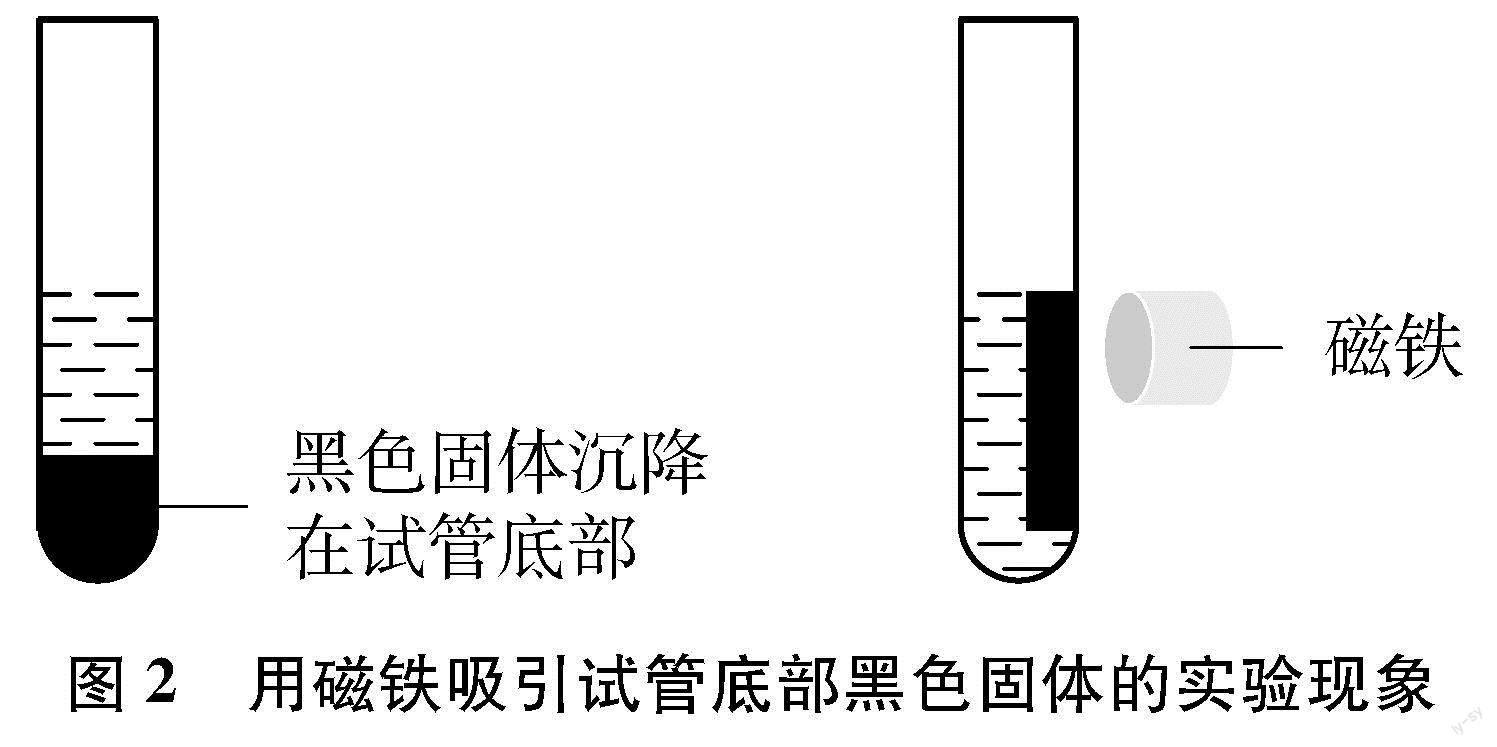
(2) 实验现象:在硫酸亚铁和硫酸铁的混合溶液中滴加几滴氢氧化钠溶液,立即产生大量的黑色块状固体,且生成的黑色固体悬浮在溶液中,上层清液立即变为无色透明,其变化过程如图1所示。当磁铁靠近试管底部的黑色固体时,溶液中的黑色固体能被磁铁吸引,将强力磁铁慢慢移至液面上方时,黑色固体能随着磁铁的移动而移动。继续滴加氢氧化钠溶液,振荡试管,整个试管中产生了黑色固体,静置,黑色固体全部沉降在试管的底部,再用磁铁靠近黑色固体时,黑色固体全部被磁铁吸引到了试管的一侧,试管的另一侧为澄清透明溶液,实验现象如图2所示。
(3) 实验结论:黑色固体能被磁铁吸引,说明黑色固体全部为四氧化三铁。产生四氧化三铁的原理为:Fe2++2Fe3++8OH-Fe3O4↓+4H2O。
3.4 在硫酸亚铁溶液中加入氢氧化钠溶液的反应
(1) 实验步骤:在试管中加入少量的硫酸亚铁溶液,然后加入氢氧化钠溶液,振荡试管后,静置一段时间,在试管外用磁铁靠近试管底部,将磁鐵由试管底部慢慢移向液面上,观察实验现象。
(2) 实验现象:当氢氧化钠滴入硫酸亚铁溶液中,观察到有白色沉淀生成,白色沉淀迅速转化为灰绿色,且悬浮于液面。振荡试管,静置一段时间,首先在溶液上方的试管内壁产生红褐色沉淀,溶液中的灰绿色固体逐渐变为红褐色,当试管中的固体全部沉降在试管的底部时,用磁铁靠近试管底部时,试管内少量的固体随着磁铁的移动而移动。
(3) 实验结论:先产生的白色沉淀为氢氧化亚铁,固体变为灰绿色是由于生成的氢氧化亚铁吸附了未反应的二价铁离子,振荡试管时,灰绿色固体与空气中的氧气接触,空气中的氧气将部分氢氧化亚铁和被吸附的二价铁离子氧化,生成了氢氧化铁或三价铁离子,生成的三价铁离子与尚未反应的二价铁离子在碱性环境中共同生成了四氧化三铁。
由以上4组实验现象可以看出,在制备氢氧化亚铁时,白色沉淀转化为灰绿色沉淀,一段时间变为红褐色时,红褐色的固体中既有氢氧化铁,也有少量的四氧化三铁,生成的四氧化三铁导致红褐色固体的颜色变暗。
4 结语
从氢氧化亚铁被氧化过程中遇到的实际问题出发,从理论与实践两个方面对该问题进行了分析和验证,证明了氢氧化亚铁在被氧化的过程中有少量四氧化三铁生成。之后,在此基础上,又通过改变亚铁盐和氢氧化钠溶液的浓度,改变空气与氢氧化亚铁的接触面积,在玻璃片上滴加8~10滴饱和硫酸亚铁溶液,然后用小喷壶在硫酸亚铁的表面喷洒少量的饱和氢氧化钠溶液,瞬间在玻璃片上产生白色沉淀,白色沉淀又快速变成灰绿色,一段时间后灰绿色固体变为黑色固体。用小刀把玻璃片上的固体刮下,干燥后,用一段细铁丝靠近黑色固体,黑色固体能和铁丝之间相互吸引。通过以上实验可得,亚铁盐溶液的浓度越大,空气与氢氧化亚铁的接触面积越大,生成的四氧化三铁就越多。
教师在教学中应引导学生关注实验过程中的每一个细节,当实验现象与预期效果不一致时,要多加思考,坚持不懈地加以探究,或许会有意外的收获[8]。作为一名一线的化学教师,只有贵在动手,勤于实践,才能发现更多的问题,获得更多的启发。
参考文献:
[1]中华人民共和国教育部制定. 普通高中化学课程标准(2017年版2020年修订)[S]. 北京:人民教育出版社, 2020:16.
[2]王晶, 郑长龙主编. 普通高中教科书·化学必修第一册[M]. 北京:人民教育出版社, 2019:67.
[3]王磊主编. 普通高中教科书·化学必修第一册[M]. 济南:山东科学技术出版社, 2019:88~89.
[4]王祖浩主编. 普通高中教科书·化学必修第二册[M]. 南京:江苏凤凰教育出版社, 2020:103~104.
[5]周改英, 王玉秋, 许焕武. 对氢氧化亚铁制备实验的商榷与建议[J]. 化学教育, 2014,(17):72~75.
[6]徐建飞, 张平, 杜淑贤. 制备氢氧化亚铁实验方案再探究[J]. 化学教学, 2015,(7):54~57.
[7]李周平, 庞立霞. 亚铁盐与氢氧化钠溶液反应的实验改进[J]. 化学教学, 2023,(4):71~73.
[8]李周平. 氢氧化亚铁制备及氧化性实验的改进[J]. 化学教学, 2023,(2):68~71.

