聚乙二醇干扰素α-2a联合恩替卡韦治疗慢性乙型肝炎的临床疗效
徐春华,刘长明,杜杰
作者单位: 410005 长沙市第一医院感染科
慢性乙型肝炎(CHB)是由乙型肝炎病毒(HBV)感染引起的一种持续存在的肝脏疾病[1],其治疗目标为抑制病毒复制、减轻肝脏炎症、预防肝纤维化和肝硬化病情进展,降低肝癌发生风险[2]。恩替卡韦是一种核苷类似物(NAs),可通过抑制HBV的DNA聚合酶活性而阻断病毒的复制及增殖[3],但长期使用恩替卡韦易产生耐药性,导致其对病毒的抑制效果下降。聚乙二醇干扰素α-2a作为一种长效干扰素类药物,不仅可直接抑制病毒复制,还可调节宿主免疫反应,增强免疫细胞的活性和病毒清除能力[4]。聚乙二醇干扰素α-2a与恩替卡韦是2种不同药理机制的药物,联合应用可能具有协同作用。本研究观察聚乙二醇干扰素α-2a联合恩替卡韦治疗CHB的疗效,现报道如下。
1 资料与方法
1.1 临床资料 根据治疗方法不同将2021年10月—2022年10月长沙市第一医院收治的80例CHB患者分为恩替卡韦组和联合组,各40例。2组患者临床资料比较,差异无统计学意义(P>0.05),见表1。

表1 恩替卡韦组与联合组临床资料比较
1.2 病例选择标准 纳入标准:(1)符合CHB的诊断标准;(2)年龄18~60岁。排除标准:(1)既往有恩替卡韦、聚乙二醇干扰素α-2a过敏史者;(2)合并其他类型肝炎者;(3)长期饮酒者。
1.3 治疗方法 恩替卡韦组采用恩替卡韦片(中美上海施贵宝制药有限公司生产)0.5 mg/次,口服,1次/d。联合组在恩替卡韦组基础上联合聚乙二醇干扰素α-2a注射液(上海罗氏制药有限公司生产)180 μg/次,皮下注射,1次/周。2组患者均连续治疗6个月。
1.4 观察指标与方法 (1)肝功能指标、肝纤维化指标及炎性因子:于治疗前及治疗6个月后采集2组患者静脉血,经离心处理后取上清液,使用全自动生化分析仪检测患者血清丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、白蛋白(Alb)、总胆红素(TBil);采用ELISA检测患者血清透明质酸(HA)、层粘连蛋白(LN)、Ⅲ型前胶原(PC-Ⅲ)、Ⅳ型胶原(Ⅳ-C)及白介素-6(IL-6)、白介素-10(IL-10)、肿瘤坏死因子-α(TNF-α)水平。(2)外周血单个核细胞(PBMCs)表面细胞表达水平:于治疗前及治疗6个月后使用流式细胞仪检测患者的Toll样受体4(TLR4)、高尔基体糖蛋白73(GP73)。(3)不良反应:包括流感样症状、血糖升高、甲状腺功能亢进。

2 结 果
2.1 肝功能指标比较 2组治疗前血清ALT、AST、Alb、TBil水平及治疗6个月后血清AST、Alb、TBil水平比较,差异无统计学意义(P>0.05);治疗6个月后,2组血清ALT、AST水平低于治疗前,且联合组血清ALT水平低于恩替卡韦组(P<0.01),见表2。

表2 恩替卡韦组与联合组治疗前后肝功能指标比较
2.2 肝纤维化指标比较 治疗前,2组血清HA、LN、PC-Ⅲ、Ⅳ-C水平比较,差异无统计学意义(P>0.05);治疗6个月后,2组血清HA、LN、PC-Ⅲ、Ⅳ-C水平低于治疗前,且联合组低于恩替卡韦组(P<0.01),见表3。
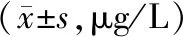
表3 恩替卡韦组与联合组治疗前后肝纤维化指标比较
2.3 血清炎性因子比较 治疗前,2组血清IL-6、IL-10、TNF-α水平比较,差异无统计学意义(P>0.05);治疗6个月后,2组血清IL-6、IL-10、TNF-α水平低于治疗前,且联合组低于恩替卡韦组(P<0.01),见表4。

表4 恩替卡韦组与联合组治疗前后血清炎性因子比较
2.4 PBMCs表面细胞表达水平比较 治疗前,2组外周血TLR4、GP73表达水平比较,差异无统计学意义(P>0.05);治疗6个月后,2组外周血TLR4、GP73
表达水平低于治疗前,且联合组低于恩替卡韦组(P<0.01),见表5。

表5 恩替卡韦组与联合组治疗前后PBMCs表面细胞表达水平比较
2.5 不良反应比较 2组治疗期间流感样症状、血糖升高、甲状腺功能亢进发生率比较,差异无统计学意义(P>0.05),见表6。

表6 恩替卡韦组与联合组不良反应比较 [例(%)]
3 讨 论
CHB是全球范围内广泛流行的严重公共卫生问题[5]。CHB可导致肝硬化、肝癌等严重并发症,给患者的健康和生活质量带来严重影响。干扰素α和NAs是临床治疗CHB的常用治疗药物[6]。干扰素α可抑制病毒复制并增强免疫反应,而NAs则可通过抑制病毒DNA聚合酶活性来阻断病毒复制[7]。然而,单药治疗可使部分患者产生抗药性,导致疗效下降或无法实现持久的病毒学响应。近年来,联合用药策略在乙型肝炎治疗中引起了广泛关注。
恩替卡韦是临床上常用的NAs,药物作用机制主要包括:(1)抑制HBV的反转录过程:恩替卡韦可进入感染的肝细胞内,被磷酸化成活性形式,通过与HBV的反转录酶结合而抑制HBV的反转录过程[8],阻止病毒将其RNA转录为DNA,并阻碍病毒的复制和增殖;(2)抑制病毒的DNA链延伸:恩替卡韦通过与HBV的DNA聚合酶结合,抑制病毒DNA链的延伸,进而阻碍病毒的复制过程,减少新的病毒颗粒产生[9]。聚乙二醇干扰素α-2a是临床常用的干扰素α类似物,通过将干扰素α-2a与聚乙二醇结合,延长药物半衰期,延长其抗病毒效果[10]。其治疗机制主要包括:(1)抑制病毒复制和病毒蛋白的表达:聚乙二醇干扰素α-2a可直接抑制HBV的复制过程,阻止病毒的DNA合成和蛋白质表达[11],通过抑制病毒复制酶的活性,阻断病毒RNA和DNA的合成,从而减少新的病毒颗粒的产生;(2)免疫调节作用:聚乙二醇干扰素α-2a可调节宿主免疫功能,增强免疫细胞对HBV的识别和清除能力,同时还可激活天然杀伤细胞及其他免疫细胞,促进宿主免疫系统的抗病毒反应,抑制病毒的复制和增殖。
持续炎性反应可促进肝脏纤维化进展。在炎症刺激下,肝脏组织中的星状细胞可活化并产生胶原蛋白等纤维化物质,导致纤维组织在肝脏中沉积。随着时间的推移,肝纤维化可能进一步演变为肝硬化,影响肝脏的结构和功能[12]。本研究结果显示,治疗6个月后联合组血清ALT及HA、LN、PC-Ⅲ、Ⅳ-C水平低于恩替卡韦组,表明聚乙二醇干扰素α-2a联合恩替卡韦治疗CHB可有效改善患者的肝功能,减缓肝纤维化进程,分析原因为聚乙二醇干扰素α-2a与恩替卡韦分别具有不同的抗病毒机制,联合使用可协同发挥抗病毒作用,双重抑制病毒复制,降低病毒载量,从而减轻肝脏炎性反应,改善肝功能,其中聚乙二醇干扰素α-2a可通过抑制炎性递质的产生、诱导病毒感染的肝细胞凋亡,以及促进肝脏修复和再生等多种机制减轻肝脏炎症和损伤,从而减少肝脏纤维化的形成和进展,保护肝功能[13]。
HBV感染可使机体免疫系统被激活,导致肝脏炎性反应发生,进而导致炎性细胞(如淋巴细胞、巨噬细胞等)的浸润和炎性递质释放。长期的炎性反应会导致肝细胞受损和坏死,进一步加重肝脏损伤。TLR4是一种免疫识别受体,广泛分布于多种免疫细胞和非免疫细胞上,包括肝脏细胞,其可通过识别和结合HBV的RNA,激活免疫细胞和促炎细胞的炎性反应[14]。炎性递质如细胞因子(TNF-α、IL-6)产生、TLR4激活炎性反应和免疫应答是CHB患者出现炎症的重要组成部分。GP73是一种膜结合型糖蛋白,主要表达于高尔基体和肝脏中,参与调节炎性反应和肝损伤过程,通过与TLR4相互作用,促进炎性细胞的激活和炎性因子产生,从而加剧肝脏炎性反应。本研究结果显示,治疗6个月后联合组血清IL-6、IL-10、TNF-α水平低于恩替卡韦组,且联合组PBMCs表面的TLR4、GP73表达水平低于恩替卡韦组,表明聚乙二醇干扰素α-2a联合恩替卡韦治疗CHB能够有效减轻炎性反应,降低PBMCs表面TLR4、GP73表达水平,分析原因为聚乙二醇干扰素α-2a联合恩替卡韦可以协同发挥抗病毒效应,降低病毒载量,减轻病毒感染对免疫系统的刺激,从而减轻炎性反应,其中聚乙二醇干扰素α-2a具有调节免疫系统的功能[15],增加天然杀伤细胞的活性、促进抗原递呈细胞的功能以及调节T细胞的免疫应答,通过这些免疫调节作用平衡炎性反应和免疫应答,减少过度的炎症刺激,从而降低TLR4和GP73表达水平。本研究结果还显示,2组治疗期间流感样症状、血糖升高、甲状腺功能亢进发生率比较无统计学差异,可见聚乙二醇干扰素α-2a联合恩替卡韦治疗CHB具有较高安全性。
综上所述,聚乙二醇干扰素α-2a联合恩替卡韦治疗CHB能够有效改善患者的肝功能,减缓肝纤维化进程,减轻机体炎性反应,调节机体免疫功能,且安全性较高。
利益冲突:所有作者声明无利益冲突。

