小分子酪氨酸激酶抑制剂A2B通过调控PI3K/Akt通路诱导胃癌细胞凋亡*
敖嘉怡, 叶连宝, 马宇昕, 褚夫江, 周 畅△
(1广东药科大学基础医学院人体解剖与组织胚胎学系,广东 广州 510006;2广东药科大学药学院药物化学系,广东 广州 510006;3广东药科大学基础医学院/广东省生物活性药物研究重点实验室,广东 广州 510006)
胃癌是一种常见的起源于胃粘膜上皮细胞的恶性肿瘤,其在恶性肿瘤中全球发病率居第五位、死亡率居第四位[1]。进展期胃癌患者难以通过外科手术等手段进行根治性治疗,目前主要治疗方案仍是联合化疗,但有效的化疗药物种类较少且易出现毒副作用。而传统细胞毒性药物对胃癌治疗效果已达到瓶颈,分子靶向药物与其相比具有低毒、高效等特点,因此近年来开发新型分子靶向药物成为胃癌研究热点之一。小分子酪氨酸激酶抑制剂A2B 是一种由本课题组前期以来那替尼(neratinib)和新型细胞间充质-表皮转化因子(cellular mesenchymal-epithelial transition factor, c-Met)抑制剂MET-2 [spiro(indoline-3,4'-piperidine)-2-ones]作为先导结构设计合成的氨基嘧啶类化合物,体外活性实验证实A2B 对表皮生长因子受体(epidermal growth factor receptor,EGFR)和人表皮生长因子受体2(human epidermal growth factor receptor 2, HER2)具 有 双 重 抑 制 作用[8],但该药物在胃癌治疗中的抗癌效应及分子机制尚未明确。研究表明EGFR、HER2 及c-Met 的高表达与胃癌预后不良有关[2-3],而磷脂酰肌醇3-激酶(phosphoinositide 3-kinase, PI3K)/蛋白激酶B(protein kinase B, PKB/Akt)信号通路为EGFR、HER2 及c-Met三者共同作用的下游通路[4-6],该通路的异常激活能够抑制肿瘤细胞凋亡。本项工作拟以EGFR 及HER2 高表达的人胃癌细胞SGC-7901 为主要研究对象,以EGFR、HER2 及c-Met 为作用靶点,聚焦PI3K/Akt信号通路及肿瘤细胞凋亡途径,探讨A2B抗胃癌的作用及相关分子生物学机制,为研发治疗胃癌的新型小分子酪氨酸激酶抑制剂提供参考资料。
材 料 和 方 法
1 实验材料
1.1 试剂 胎牛血清购自TOCYTO;RPMI-1640 培养液、PBS 缓冲液购自Gibco;0.25%胰蛋白酶购自BI;青、链霉素双抗溶液购自HyClone;CCK-8 试剂盒购自Glpbio;二甲基亚砜(DMSO)购自Sigma;Beyo-Click™ EdU-488 细胞增殖检测试剂盒、SDS-PAGE 快速配胶试剂盒、Annexin V-FITC 细胞凋亡检测试剂盒、线粒体膜电位检测试剂盒(JC-1)均购自上海碧云天生物技术有限公司;EGFR 抗体、HER2 抗体、c-Met 抗体、B 细胞淋巴瘤2(B-cell lymphoma-2, Bcl-2)抗体、Bcl-2 相关X 蛋白(Bcl-2-associated X protein,Bax)抗体、caspase-3/p17/p19 抗体、PI3K 抗体和山羊抗兔Ⅱ抗购自Proteintech;山羊抗鼠Ⅱ抗购自上海泊湾生物技术有限公司;Akt 抗体和p-Akt 抗体购自常州市祥泰生物技术有限公司;小分子酪氨酸激酶抑制剂A2B 由本课题组叶连宝教授前期设计合成,已获得专利授权[7]。
1.2 仪器 二氧化碳细胞培养箱购自Thermo Fisher;酶标仪购自Bio-Rad;化学发光成像与分析系统购自上海天能科技有限公司;BD FACSCalibur 流式细胞仪购自BD。
2 实验方法
2.1 细胞培养 人胃癌细胞株SGC-7901 由本实验室保存,在含10%胎牛血清、1%青、链霉素双抗溶液的RPMI-1640 培养液中贴壁培养,并置于37 ℃、5%CO2培养箱中,每两天换液一次,取对数生长期细胞进行后续实验。
2.2 CCK-8 法检测细胞活力 取对数生长期人胃癌细胞SGC-7901 制备成5×104/mL 单细胞悬液,以每孔100 µL 接种于96 孔板中,置于37 ℃、5% CO2培养箱中培养过夜,待细胞贴壁后根据分组更换新鲜培养液。分组为对照组(正常培养组)、不同浓度(2.5、5、10、20、40、80、100 和160 µmol/L)的A2B 实验组和仅添加培养液的空白组,每组4 个复孔。继续培养24、48 和72 h 后,每孔加入含10 µL CCK-8 溶液,置于37 ℃、5% CO2培养箱中孵育2~3 h,酶标仪检测450 nm 波长处各孔的吸光度(A)值,以空白孔调零,计算细胞相对活力,并使用SPSS 软件计算IC50值。细胞相对活力(%)=(A实验组-A空白组)/(A对照组-A空白组)×100%。实验重复3 次。
2.3 平板集落形成实验检测细胞集落形成能力将处于对数生长期SGC-7901 细胞以每孔1×103接种于6孔板中,待细胞贴壁后去除原培养液,分为4组:对照(control)组(细胞正常培养组)、溶剂组(vehicle组,用含0.08% DMSO 培养液处理细胞)和A2B (10和20 µmol/L)实验组,后续实验分组情况同此描述。置于37 ℃、5% CO2培养箱中,10 d 后终止培养。经4%多聚甲醛固定细胞15 min 后,结晶紫染色10 min,随后使用流水清洗并晾干拍照记录,于倒置显微镜下计算大于50个细胞的集落数,实验重复3次。
2.4 EdU 细胞染色实验检测细胞增殖情况 EdU细胞染色实验[17]使细胞DNA 标记上荧光探针,增殖的细胞呈现绿色荧光,Hoechst 33342 染液使活细胞的细胞核呈现蓝色荧光。取对数生长期SGC-7901细胞以每孔2×104接种于24孔板中,细胞贴壁后随机分为4 个实验组。药物处理24 h 后去除一半原培养液,更换为含EdU 的新鲜培养液,置于37 ℃培养箱中孵育2 h。终止培养后根据试剂盒中说明书进行后续实验,通过荧光倒置显微镜拍照,采用ImageJ 软件对EdU+细胞及活细胞计数,实验重复3次。
2.5 Annexin V-FITC/PI 双染法检测细胞凋亡率Annexin V-FITC/PI 双染法[18]可用于检测细胞凋亡情况,其中Annexin V-FITC 可以染色早期凋亡细胞,呈现绿色荧光;PI可以染色坏死细胞或晚期凋亡细胞,呈现红色荧光。取对数生长期SGC-7901 细胞接种于10 cm 培养皿,细胞贴壁后随机分为4 个实验组。药物处理24 h 后用不含EDTA 的胰蛋白酶消化收集全部细胞,制备成3×105/mL的单细胞悬液,用预冷的PBS 洗涤1~2 次,细胞沉淀中加入200 µL Annexin VFITC 结合液重悬细胞,加入5 µL Annexin V-FITC 和10 µL PI,室温避光孵育15~20 min,随后使用流式细胞仪检测细胞凋亡率,实验重复3次。
2.6 JC-1 染色法检测细胞线粒体膜电位变化 JC-1 染色法[19]可通过JC-1 从红色荧光到绿色荧光的转变检测线粒体膜电位的下降情况。细胞接种及给药同2.5,药物处理24 h 后用不含EDTA 的胰蛋白酶消化收集细胞,PBS 洗涤1~2 次后用0.5 mL 完全培养液重悬细胞,随后加入0.5 ml JC-1染色工作液,充分混匀后置于37 ℃培养箱中孵育25 min。孵育结束后,40.2×g、4 ℃离心3 min,去除培养液后用1×JC-1染色缓冲液洗涤2 次,最后用400 µL 1×JC-1 染色缓冲液重悬细胞,并使用流式细胞仪检测JC-1 红绿荧光比例,实验重复3次。
2.7 Western blot 检测蛋白表达情况 细胞接种及给药同2.5,药物处理24 h后用胰蛋白酶消化收集全部细胞,预冷的PBS 洗涤细胞1~2 次,加入适量的裂解液置于冰浴中裂解20 min,利用细胞超声破碎仪超声8 s,共2~3次,低温高速离心机中4 ℃、9 558.7×g离心10 min 后收集上清液,用BCA 定量试剂盒进行蛋白定量后加入5×上样缓冲液高温变性。每组取20~30 µg 蛋白进行SDS-PAGE,然后低温转膜至0.22 µm PVDF 膜,TBST 洗膜1~2 次,每次5 min,5%脱脂奶粉溶液封闭2 h,按照说明书比例用抗体稀释液稀释Ⅰ抗/Ⅱ抗,加入Ⅰ抗于4 ℃环境中孵育过夜;Ⅰ抗孵育结束后,TBST 洗膜10 min×3 次,室温下加入Ⅱ抗孵育1 h,TBST 洗膜10 min×3 次;置于ECL 显影液中显影,并利用化学发光成像与分析系统拍照记录,最后用ImageJ软件分析灰度值。
3 统计学处理
利用GraphPad Prism 9.0 或SPSS Statistics 26.0软件对实验结果进行统计学分析,计量资料以均数±标准差(mean±SD)表示,利用单因素方差分析(oneway ANOVA)检验各组间差异,以P<0.05 为差异有统计学意义。
结 果
1 A2B对人胃癌细胞SGC-7901及正常胃粘膜细胞GES-1活力的影响
利用CCK-8 法于24、48 和72 h 检测A2B 作用于人胃癌细胞SGC-7901 的IC50值分别为26.85、19.58和12.24 µmol/L(图1A)。同时检测了A2B作用于正常胃粘膜细胞GES-1 24 h 后的IC50值为48.68 µmol/L(图1B),通过拟合曲线换算A2B 作用于胃癌细胞24 h 的IC50浓度下,GES-1 细胞相对活力为72.84%。考虑到后续其他细胞功能学实验细胞存活状态,故将后续部分实验条件设定为10 和20 µmol/L A2B 作用于SGC-7901细胞24 h。
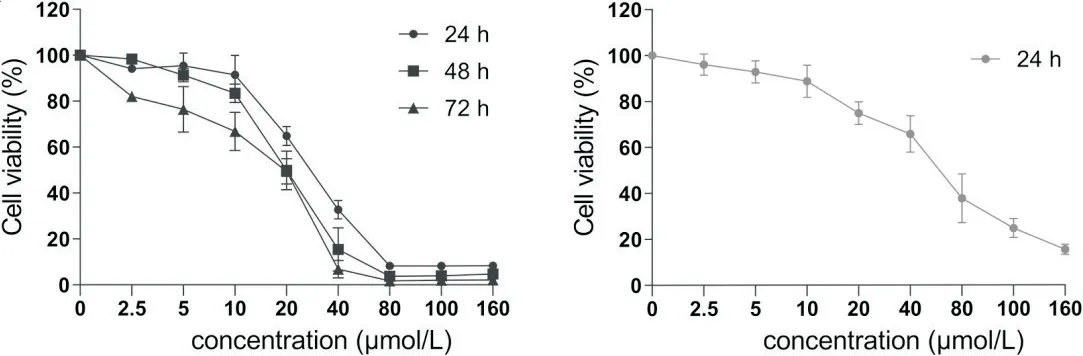
Figure 1.The viability of SGC-7901 cells (A) and GES-1 cells (B) was decreased after treatment with A2B (CCK-8 assay).Mean±SD.n=3.图1 A2B抑制人胃癌细胞SGC-7901及正常胃粘膜细胞GES-1的活力
2 A2B 对人胃癌细胞SGC-7901 中EGFR、HER2及c-Met蛋白表达的影响
Western blot 实验结果显示,与溶剂(vehicle)组相比,A2B (10 µmol/L)组中EGFR和HER2蛋白表达量显著减少(P<0.01),而c-Met蛋白表达量无显著变化,A2B (20 µmol/L)组中EGFR、HER2 及c-Met 蛋白表达量均显著减少(P<0.01),见图2。

Figure 2.A2B down-regulated the protein expression of EGFR, HER2 and c-Met in SGC-7901 cells.The protein expression levels of EGFR, HER2 and c-Met in SGC-7901 cells treated with 10 and 20 µmol/L A2B for 24 h were measured by Western blot.Mean±SD.n=3.*P<0.05, **P<0.01 vs control group; ##P<0.01 vs vehicle group; △P<0.05, △△P<0.01 vs A2B (10 µmol/L) group.图2 A2B下调人胃癌细胞SGC-7901中EGFR、HER2和c-Met蛋白的表达水平
3 A2B对人胃癌细胞SGC-7901增殖能力的影响
EdU 染色实验结果显示,与vehicle 组相比,A2B(10 µmol/L)组和A2B (20 µmol/L)组中EdU+细胞比例显著减少且活细胞数也逐渐减少(P<0.01);与A2B (10 µmol/L)组相比,A2B (20 µmol/L)组中EdU+细胞比例下降更为显著(P<0.01),见图3A。平板集落形成实验结果显示,与vehicle 组相比,A2B(10µmol/L)组和A2B (20 µmol/L)组中集落数显著减少(P<0.01),见图3B。
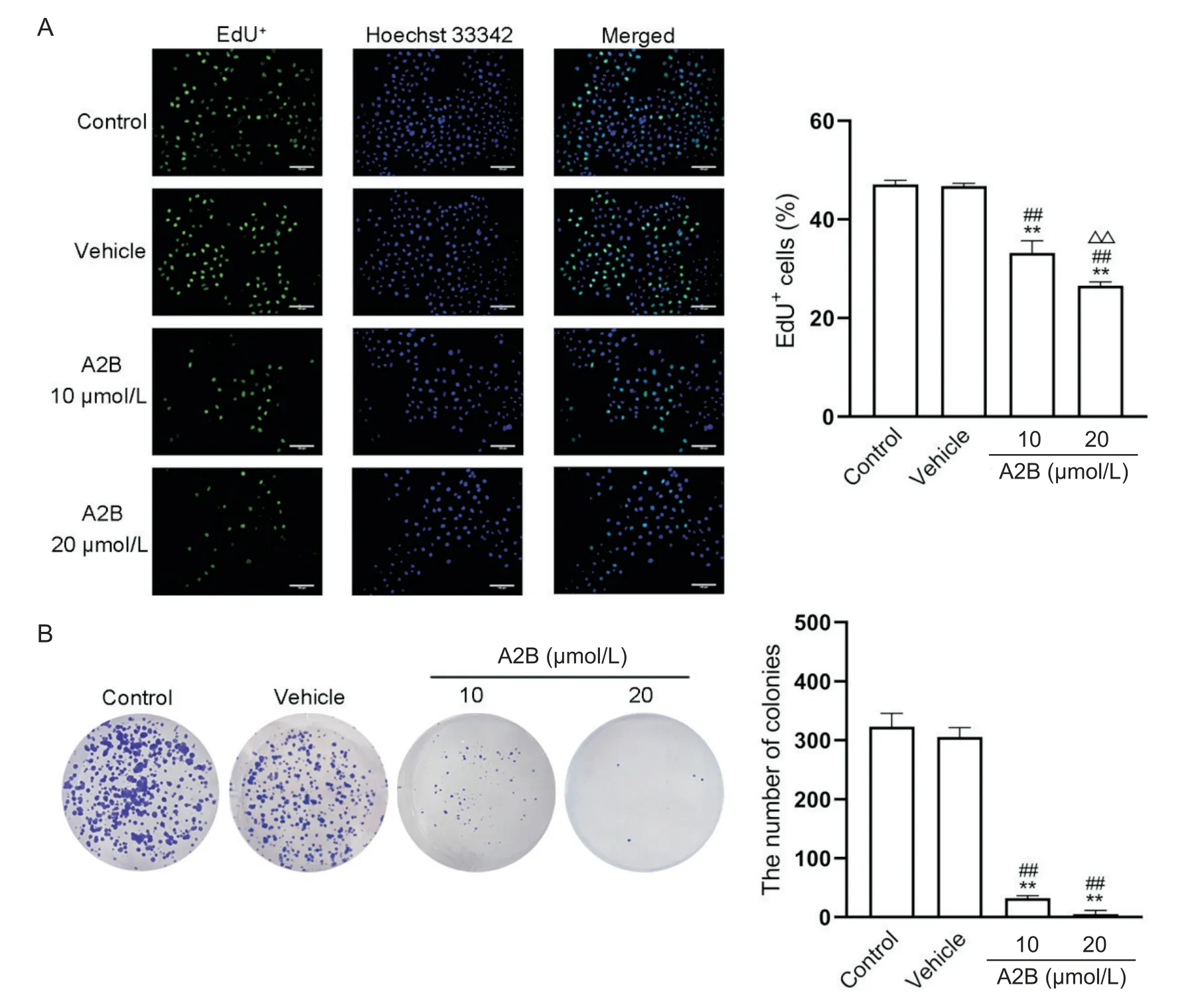
Figure 3.Effect of A2B on the proliferation of SGC-7901 cells.A: the numbers of EdU+ cells were decreased after treatment with 10 and 20 µmol/L A2B for 24 h (EdU staining, scale bar=100 µm); B: SGC-7901 cells showed weak proliferation ability with fewer colony counts after treatment with 10 and 20 µmol/L A2B for 24 h in the plate colony formation assay.Mean±SD.n=3.**P<0.01 vs control group; ##P<0.01 vs vehicle group; △△P<0.01 vs A2B (10 µmol/L) group.图3 A2B对人胃癌细胞SGC-7901增殖能力的影响
4 A2B对人胃癌细胞SGC-7901凋亡的影响
Annexin V-FITC/PI 双染法结果显示,与vehicle组相比,A2B (10 µmol/L)组和A2B (20 µmol/L)组中细胞凋亡率显著增加(P<0.05);与A2B (10 µmol/L)组相比,A2B (20 µmol/L)组的细胞凋亡率增加更为显著(P<0.01),见图4A。JC-1 染色法结果显示,与溶剂(vehicle)组相比,A2B (10 µmol/L)组和A2B(20 µmol/L)组中JC-1 绿色荧光比例显著增加(P<0.01);与A2B (10 µmol/L)组相比,A2B (20 µmol/L)组的JC-1 绿色荧光比例增加更为显著(P<0.05),见图4B。利用Western blot 检测凋亡相关蛋白,与溶剂组相比,A2B (10 µmol/L)组中caspase-3 表达量显著减少(P<0.05),A2B (20 µmol/L)组中Bax/Bcl-2 和cleaved caspase-3 表达量显著增加且caspase-3 表达量显著减少(P<0.05);与A2B (10 µmol/L)组相比,20 µmol/L A2B 对Bax/Bcl-2 和caspase-3 的调控更加显著(P<0.05),见图4C。
5 A2B 对 人 胃 癌 细 胞SGC-7901 中PI3K/Akt 信 号通路蛋白表达的影响
Western blot 结果显示,与vehicle 组相比,A2B(10 µmol/L)组和A2B (20 µmol/L)组中p-Akt/Akt 比值均显著减少(P<0.05);与A2B (10 µmol/L)组相比,A2B (20 µmol/L)组中p-Akt/Akt 比值减少更为显著(P<0.05),见图5。

Figure 5.A2B down-regulated the ratio of p-Akt/Akt in SGC-7901 cells.Mean±SD.n=3.*P<0.05, **P<0.01 vs control group; #P<0.05, ##P<0.01 vs vehicle group; △P<0.05 vs A2B (10 µmol/L) group.图5 A2B下调人胃癌细胞SGC-7901中p-Akt/Akt比值
讨 论
目前,临床上胃癌治疗应用的分子靶向药物主要分为单克隆抗体、小分子抑制剂和抗体偶联药物。分子靶向药物可通过阻断肿瘤细胞异常活化的信号通路或抑制过表达的靶标,从而达到抗肿瘤的目的[16]。
小分子酪氨酸激酶抑制剂A2B 是一种含有螺环结构的氨基嘧啶类化合物,由来那替尼和新型c-Met抑制剂MET-2作为先导结构设计合成。前期实验结果已证实A2B 对野生型EGFR 和HER2 的抑制效果与来那替尼抑制效果相当[8],但其对胃癌细胞的作用及分子机制尚不清楚。本研究通过体外实验验证了A2B 能够抑制人胃癌细胞SGC-7901增殖。CCK-8实验结果显示A2B 呈时间-浓度依赖性抑制SGC-7901 细胞活力,且对正常胃粘膜细胞GES-1 活力影响小于SGC-7901 细胞。EdU 细胞染色实验和平板集落形成实验结果都进一步证实了A2B 能显著抑制SGC-7901细胞的增殖能力。
EGFR、HER2及c-Met同属于酪氨酸激酶受体家族,是近年来胃癌分子靶向药物的“明星靶点”。Fu等[9]研究表明丹皮酚能够显著下调HER2,抑制NFκB 信号通路的激活,从而抑制SGC-7901 细胞增殖、诱导细胞凋亡。作为合成A2B 的先导结构,来那替尼能够选择性抑制HER2 和EGFR 的表达,而MET-2是一种新型c-Met 抑制剂。研究表明EGFR 抑制剂的耐药机制与MET基因扩增有关[20],故基于来那替尼与MET-2 的结构优化或许可打破EGFR 抑制剂的耐药。本研究通过Western blot 实验检测到10µmol/L A2B 能够显著下调EGFR 和HER2 蛋白表达水平,而20 µmol/L A2B 能够同时下调EGFR、HER2及c-Met蛋白表达水平。以上结果说明,在分子生物学基础上A2B 对EGFR、HER2 及c-Met 的靶向作用与其药物设计目标一致。
细胞凋亡属于细胞程序性死亡的一种,细胞凋亡调控与胃黏膜组织的癌变过程存在联系[10]。内源性线粒体途径是细胞凋亡发生的途径之一,其早期标志性事件是线粒体膜电位的破坏。Li 等[19]研究表明中草药花椒提取物可通过破坏人肝癌细胞的线粒体膜电位,激活细胞线粒体凋亡途径、抑制肿瘤细胞增殖。本研究通过AnnexinV-FITC/PI 双染法和JC-1染色法证实了A2B 实验组中SGC-7901 细胞凋亡率增加且细胞线粒体膜电位降低。抗凋亡蛋白Bcl-2和促凋亡蛋白Bax 同属于Bcl-2 家族,研究表明通过调控两者蛋白表达能够激活caspase-9、caspase-3 及其下游底物PARP 进而诱发细胞凋亡[11,14]。本研究结果显示经A2B 处理后SGC-7901 细胞中caspase-3蛋白表达水平下调,Bax/Bcl-2 比值及cleaved caspase-3蛋白表达水平上调,进一步说明A2B能够激活SGC-7901细胞中线粒体凋亡途径,诱导细胞凋亡。
PI3K/Akt 信号通路在胃癌的发生发展过程中发挥重要作用。研究表明,抑制PI3K/Akt信号通路的异常激活能够抑制肿瘤细胞增殖,促进细胞凋亡和自噬[12-13,15]。同时PI3K/Akt信号通路是EGFR、HER2和c-Met三者共同作用的下游通路[4-6]。本研究检测到经A2B 处理后SGC-7901 细胞中Akt 磷酸化水平显著降低,同时影响了PI3K/Akt信号通路下游线粒体途径中Bax 和Bcl-2 的表达,表明A2B 可能通过抑制SGC-7901细胞中PI3K/Akt信号通路激活诱导细胞凋亡。
综上所述,本研究以小分子酪氨酸激酶抑制剂A2B 为切入点,验证了A2B 在人胃癌细胞SGC-7901中能够同时抑制EGFR、HER2 及c-Met 的表达。同时本研究探讨了A2B 通过调控PI3K/Akt信号通路诱导人胃癌细胞SGC-7901 发生线粒体凋亡的分子机制。下一步我们将通过建立胃癌细胞荷瘤裸鼠模型验证体内实验是否与体外实验结果一致。

