牦牛卵母细胞体外成熟培养及孤雌发育研究
王立斌, 王强龙, 潘阳阳, 赵天, 丁天翊, 崔燕, 余四九
(甘肃农业大学动物医学院,甘肃省牛羊胚胎工程技术研究中心,兰州 730070)
卵母细胞质量与孤雌激活胚胎发育潜能之间的关系是研究的焦点,人工激活孤雌生殖的的研究相继在小鼠[1]、兔[2]、羊[3]、猪[4]、牛[5]以及猴子[6]等动物中开展[7]。1999 年,Sun 等[8]证实了卵母细胞在体外发育到MⅡ中期会停滞,直到受精或激活才会进一步发育,高水平的成熟促进因子(maturation promoting factor,MPF)和细胞静止因子(cytostatic factor,CSF)共同维持MⅡ期的卵母细胞,当卵母细胞受精或受到外界刺激,胞内Ca2+呈多次有规律的升高,破坏了MPF 和CSF 的平衡,从而引发减数分裂恢复。
卵母细胞体外培养过程中核质成熟不同步是制约后续胚胎发育的瓶颈,通过体外模拟卵泡液的微环境使卵母细胞生长发育最终具有受精能力是体外胚胎发育的关键。但是,卵母细胞从成熟到发育为早期胚胎涉及复杂的生物学过程,任何异常因素的干扰都会导致其减数分裂停滞和受精失败[9-10]。研究表明,体外培养卵母细胞和早期胚胎的发育潜力均低于动物体内,这也表明体外培养体系与动物体生理内环境差距较大,其培养体系、培养方式仍需进一步优化。
孤雌激活属于无性生殖的范畴,可以实现无雄性参与诱导卵母细胞激活分裂和发育[9],通过不同的物理(电激活)或化学方法[(氯化锶、乙醇、离子霉素与6-二甲基氨基嘌呤(6-dimethylaminopurine,6-DMAP)]对卵母细胞进行激活,最终使停滞在MⅡ期的卵母细胞完成第二次减数分裂,并抑制第二极体排出,从而产生正常二倍体的胚胎[11]。研究卵母细胞孤雌激活及后续胚胎的发育过程,对于深度认识生命的起始、个体发育、细胞分化、核移植、胚胎移植以及动物克隆等具有重要的参考意义。迄今为止,有关鼠、兔、牛、羊、猪、马和猴的孤雌生殖研究已有报道,但不同物种或同一物种的不同种系,对孤雌激活的反应不同[12]。研究发现,卵母细胞体外成熟时间长短对其孤雌激活效率有一定影响,随着培养时间延长,可引发老化卵孤雌发生,在鼠、兔、牛的相关研究中,激活率随卵龄增加而上升[13],但是体外培养时间过长却限制了孤雌激活率,可能是老龄卵母细胞cyclinB的降解途径对细胞内Ca2+释放更为敏感所致。另外,影响卵母细胞孤雌激活的因素很多,如激活方法、电参数、激活液种类和含量水平、培养液种类、激活时间及卵母细胞采集方法等[14],对卵母细胞孤雌激活率、卵裂率及孤雌发育率有较大影响。受体卵母细胞的有效激活及发育能力的研究,是核移植重构胚发育的关键,对提高核移植效率及孤雌胚胎发育的研究具有重要意义[15]。孤雌激活胚胎作为胚胎学的研究模型,可以避免伦理道德的约束,为体外胚胎发育、形态学鉴定以及基因分析提供依据。
牦牛是青藏高原地区特有的哺乳动物,生活环境恶劣,繁殖力低下。研究牦牛卵母细胞体外培养及孤雌激活胚胎发育,对深入研究牦牛早期胚胎发育、提升其受胎率等均有重要意义。为探讨牦牛卵母细胞的不同处理方式与后续孤雌激活胚胎发育之间的潜在联系,本研究比较了卵丘-卵母细胞复合体(cumulus-oocyte complexs,COCs)和裸卵、TCM199 培养不同时间以及体外培养12 h的COCs 消化之后再培养对其孤雌激活胚胎发育的卵裂率、囊胚率的影响,有助于突破四细胞期发育阻滞、提高囊胚率、降低卵裂畸形率,可为进一步开展牦牛卵母细胞孤雌激活寻求可靠的激活、培养方法提供依据。
1 材料与方法
1.1 主要仪器和试剂
所用主要试剂有TCM199 培养液(Gibco,Grand Island,NY,USA)、G1 胚胎培养液(Gibco,USA)、FBS(foetal bovine serum,HyClone,Uruguay Origin,South America)、杜 氏 磷 酸 盐 缓 冲 液(dulbecco’s phosphate buffered saline, DPBS)(Gibco,USA)、0.1%透明质酸酶、离子霉素(Sigma-AIdrich)、6-二甲基氨基嘌呤(Sigma-AIdrich)、细胞固定液(Gibco,USA),其他试剂均为国产分析纯。
所用主要仪器有四孔板(Nunc,Roskilde,Denmark)、CO2培养箱(Thermo Fisher,USA)、倒置显微镜(Olympus,Japan)、体视显微镜(Olympus,Japan)等。
1.2 卵母细胞的获取
于10 月份从青海省西宁市定点屠宰场采集5~8岁健康牦牛的卵巢,置于37 ℃含有双抗(青霉素、链霉素)的生理盐水中,3~5 h 内带回实验室,再清洗3 次。用12号针头的10 mL 注射器在无菌环境中自卵巢表面可见卵泡吸取卵泡液,在体视显微镜下用自制的捡卵针挑选胞质均匀、形态完好、被卵丘细胞紧密包裹(≥3 层)的卵丘-卵母细胞复合体(COCs)。
1.3 试验设计
1.3.1 COCs 和裸卵的孤雌激活效果检测 将培养24 h 的COCs 分成两部分:一部分不做处理;一部分用0.1%(质量体积分数)的透明质酸酶消化,操作过程中用移液器反复吹打,并观察卵丘细胞脱落情况。将两部分COCs 分别进行孤雌激活,体外培养,观察卵裂情况。
1.3.2 TCM199 不同培养时间的孤雌激活效果检测 分别对体外培养24、36 h 的COCs 进行筛选,用透明质酸酶消化,去除卵母细胞周围的卵丘细胞,并用DPBS 清洗,进行孤雌激活,体外培养,观察卵裂情况。
1.3.3 裸卵再培养后孤雌激活效果检测 对体外培养12 h 的COCs,用0.1%的透明质酸酶消化,去除卵母细胞周围的卵丘细胞,并用含有血清的DPBS 清洗,再次移入TCM199 培养液中培养12 h,进行孤雌激活,体外培养,观察卵裂情况。
1.4 体外培养
挑选表面包裹≥3 层的卵丘细胞,并且未发生扩张的COCs,用含有1%胎牛血清的DPBS 微滴清洗3 次,移入含有50 μL TCM199 培养液的四孔板,COCs的最终密度为100个·mL-1。胚胎培养条件为:温度38.5 ℃、CO2含量5%、湿度100%条件下分别培养24 、36 h,用于后续孤雌激活。
1.5 消化、筛选
将培养24、36 h 的COCs 用0.1%的透明质酸酶进行消化,除去卵母细胞外面所有的卵丘细胞,观察第一极体排出情况。选择透明带完整,胞质均匀、形态良好、卵周间隙清晰,具有第一极体的卵母细胞,用DPBS进行清洗。
1.6 牦牛卵母细胞体外孤雌激活
在培养皿中做50 μL的孤雌激活微滴,分别为5 μmol·L-1离子霉素(ionomycin)和2 mmol·L-16-二甲基氨基嘌呤(6-DMAP),用石蜡油进行覆盖,移入胚胎培养箱平衡2 h。
使用DPBS 将牦牛卵母细胞清洗3次,收集成熟的卵母细胞,使用0.1%的透明质酸酶进行消化,随时观察卵丘细胞与卵母细胞的脱离情况。筛选优质卵母细胞再次清洗,将其在离子霉素微滴中处理5 min,再次清洗,移入6-DMAP 的微滴中4 h,使卵母细胞激活。
1.7 体外培养
将清洗之后的卵母细胞移至石蜡油覆盖的胚胎培养液微滴中,每个微滴中放20 个卵母细胞,置入培养箱进行培养,培养体系为:38.5 ℃、5%CO2和100%湿度,连续培养1周;培养期间通过体视显微镜观察并记录卵裂情况,根据胚胎发育情况,收取2~4 细胞、5~8 细胞、9~16 细胞期胚胎和囊胚,分别做冻存和固定处理。
1.8 数据分析
将试验数据用SPSS 21.0 软件进行单因素方差分析和显著性分析,数据用平均值±标准误表示,P<0.05表示差异显著。
2 结果与分析
2.1 孤雌激活胚胎的体外发育
对卵母细胞进行体外培养(图1A), 使用倒置显微镜观察牦牛卵母细胞在体外培养过程中的成熟情况(图1B、C)。用0.1%的透明质酸酶消化成熟的COCs(图2),挑选含有第一极体的卵母细胞进行孤雌激活(图3A),早期胚胎发育良好。挑选形态较好的2-细胞期胚胎(孤雌激活后的卵母细胞一分为二,形成2 个卵裂球)、4~8 细胞期胚胎(含4~8 个细胞)、8~16 细胞期胚胎(含8~16 个细胞)、桑椹胚(内含32 个左右细胞组成的细胞团)和囊胚(内部产生囊胚液、出现囊胚腔)(图3),分别进行固定保存。
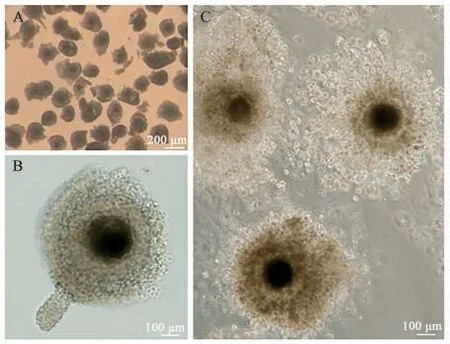
图1 牦牛卵母细胞Fig. 1 Yak oocytes

图2 透明质酸酶消化后的卵母细胞Fig. 2 Oocytes digested by hyaluronidase
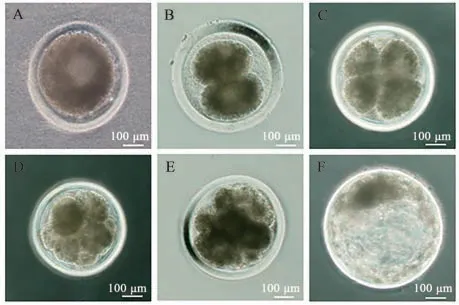
图3 孤雌激活之后的卵母细胞不同发育阶段Fig. 3 Different developmental stages of oocytes after parthenogenetic activation
2.2 COCs和裸卵的孤雌激活效果
将成熟的COCs经0.1%透明质酸酶消化之后进行孤雌激活,其卵裂率、囊胚率均显著高于未消化的处理组(表1)。培养7 d 后发现,COCs 组脱卵丘,表明卵母细胞体外培养过程中周围的卵丘细胞可分泌细胞因子,有助于卵母细胞成熟,从而影响后期孤雌激活效果。
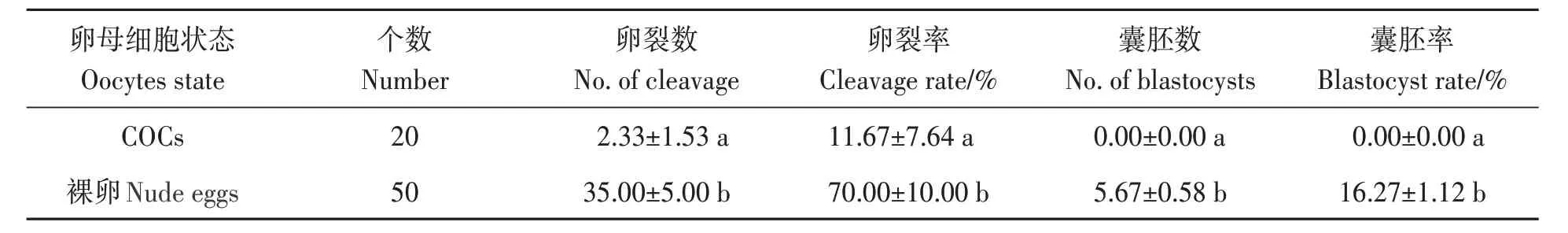
表1 COCs和裸卵的孤雌激活效果Table 1 Parthenogenetic activation effects of COCs and nude eggs
2.3 TCM199培养时间对孤雌激活效果的影响
将牦牛卵母细胞分别培养24、36 h后进行孤雌激活,对卵母细胞成熟率、孤雌胚胎卵裂率、囊胚率进行统计。结果(表2)显示,培养24 h的COCs,经透明质酸酶消化之后进行孤雌激活,其成熟率、卵裂率、囊胚率均显著高于体外培养36 h的处理组。
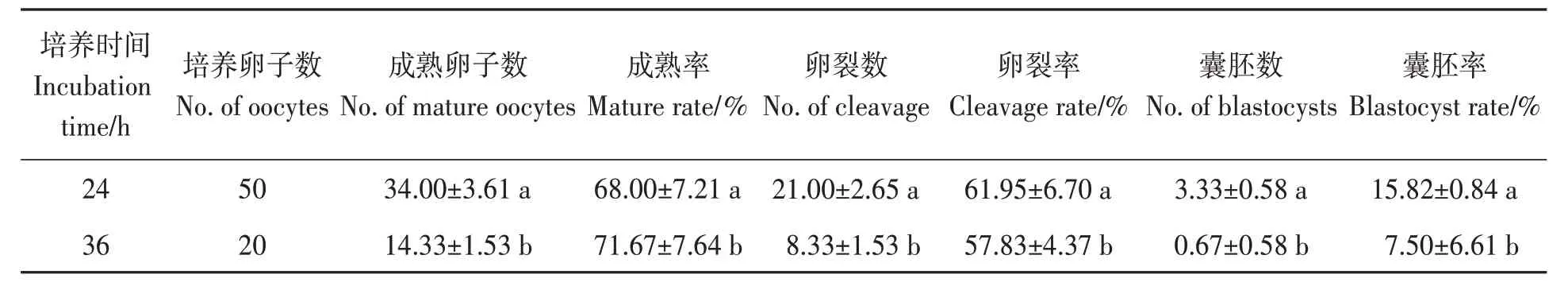
表2 不同培养时间下牦牛卵母细胞的成熟和孤雌激活胚胎发育Table 2 Maturation and parthenogenetic development of yak oocytes under different culture time
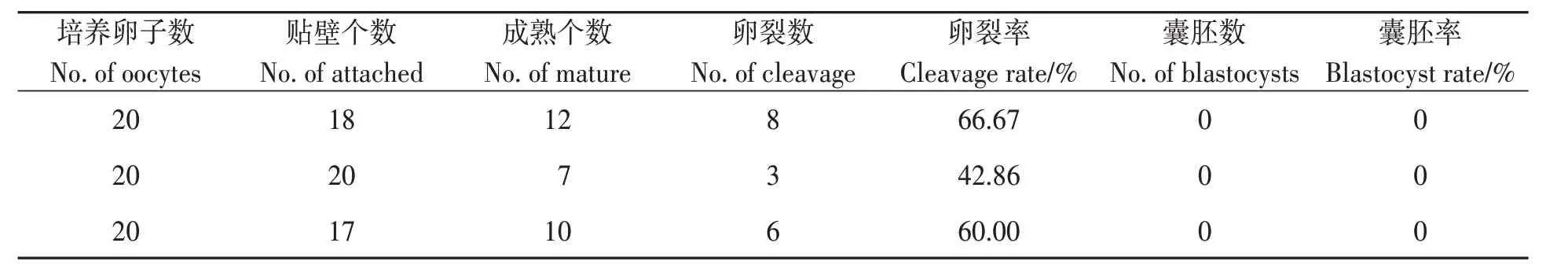
表3 裸卵再培养对孤雌激活效果的影响Table 3 Effects of reculture of nude oocytes on parthenogenetic activation
2.4 裸卵再培养对孤雌激活效果的影响
通过对透明质酸酶消化之后的卵母细胞进行二次培养,结果发现,大多数卵母细胞在培养过程中发生贴壁,后续的试验操作很难进行,但经过培养并进行孤雌激活处理,仍然有个别早期胚胎形成,最终无法形成囊胚。
3 讨论
目前,主要依据形态学(卵裂率、胚胎形态、细胞总数和内细胞团数等)衡量体外胚胎的发育潜能[16]。卵母细胞在体外培养成熟过程中受诸多因素干扰,进而影响后期胚胎的发育及囊胚形成[17]。卵泡中的卵母细胞和周围上皮形成COCs,卵丘细胞和卵母细胞通过缝隙连接与桥粒实现信号传导和物质交换,二者相互依赖,形成一个结构功能共同体。研究表明,卵丘细胞可以合成特殊蛋白,能够启动或抑制卵母细胞成熟[18]。卵母细胞也能通过分泌细胞因子影响卵丘透明质酸酶的合成并调节卵丘细胞扩散,从而解除卵丘-卵母细胞的连接,促使减数分裂的重新启动。卵丘细胞对卵母细胞成熟的启动并非具有主导作用,应该只有促进或抑制的辅助作用。研究表明,卵丘细胞的生长状态与卵母细胞的发育密切相关,卵丘细胞凋亡脱落对卵母细胞成熟、体外受精以及早期胚胎发育均有影响[19]。在动物体内,促黄体生成素(luteinizing hormone, LH) 刺激卵丘细胞产生蛋白聚糖和糖蛋白,并且在卵丘层周围形成细胞外基质,称为卵丘扩展。扩展的卵丘细胞与卵母细胞形成COCs,可以保护卵母细胞免受机械外力作用,避免卵泡或输卵管中蛋白酶降解,从而对卵母细胞起到保护作用[20]。本研究中,对体外培养24 h的COCs,部分不进行消化处理直接孤雌激活,部分消化为裸卵进行孤雌激活,未消化的COCs孤雌激活率明显低于消化之后的COCs,说明卵母细胞周围的卵丘细胞阻碍了孤雌激活效果。
Ozils 等[2]最初发现兔的未成熟卵母细胞在体外培养过程中逐渐发育成熟。表明卵母细胞体外培养时间直接影响其成熟度,进而对孤雌激活效果有明显的影响。研究发现,卵母细胞核成熟与胞质成熟不同步,而胞质成熟与否直接决定胚胎发育能力[21-22]。不同动物卵母细胞体外成熟所需时间不同,一般以18~24 h 为宜,26 h 以后卵母细胞老化。牛卵母细胞体外培养成熟的最佳时间为20~24 h[23],培养时间少于20 h,卵丘扩展不充分,培养时间超过24 h,卵母细胞会退化衰老[24]。本研究发现,牦牛卵母细胞体外培养24 h 再进行孤雌激活,胚胎发育能力明显高于体外培养36 h 的处理组,说明体外培养36 h,会使卵母细胞老化,同时出现透明带硬化。透明带是包裹卵子的糖蛋白,能保护卵子和早期胚胎免受外界刺激。离子霉素是一种高效钙离子载体,通过动员钙库释放Ca2+而 产 生 生 物 学 作 用[25]。2001 年,Nakagawa等[26]发现,用离子霉素联合6-DMAP 可有效激活卵母细胞,提高孤雌胚胎发育率,最后发育至囊胚。但孤雌胚胎发育能力很低,通过比较,体外培养24 h的卵母细胞孤雌胚发育能力明显高于体外培养36 h。体外培养12 h 的COCs,卵母细胞成熟率低,经透明质酸酶消化之后,再移入TCM199 培养液进行培养,12 h后发现,卵母细胞大多数发生贴壁,很难进行下一步操作。细胞贴壁的前提是具备可以贴附的支持物表面,细胞依靠自身分泌的或培养基中提供的贴附因子,才能在表面上生长繁殖。本课题组前期试验中发现,培养的COCs受到污染或卵丘细胞脱落导致COCs 发育不充分的情况下,也会有部分贴壁,说明该过程有细胞贴附因子的生成。而裸卵再培养或许促进了相关因子的合成与分泌。
影响卵母细胞成熟、孤雌胚胎发育的因素很多,除以上设置组别的不同处理方式外,培养基成分的差异也会影响发育效果,培养皿的材质、实验室环境以及个人操作手法,都会产生影响。此外,卵母细胞来源、母牦牛的年龄胎次也会影响体外发育;卵巢离体时间在4 h 以内为好,但偶尔因交通运输状况导致卵母细胞移入培养液的时间会有所延长,卵母细胞对外界环境的变化产生应激反应,直接影响后期孤雌激活效果。研究显示,猪卵巢离体时间对卵母细胞体外成熟有影响,其成熟率随着时间的延长而降低[26];牦牛屠宰主要在冬季,样品运输过程中对温度的控制非常重要,卵母细胞中有大量脂肪滴,对温度的变化十分敏感,卵巢运送过程中生理盐水温度下降,也会对卵母细胞后期生长发育产生影响。研究发现,卵巢回收温度影响卵母细胞体外成熟率,36~39 ℃时卵裂率为52.3%,25~28 ℃时卵裂率为49.1%,而14~17 ℃时卵裂率仅为28.8%[27]。本实验室获取卵母细胞通过注射器抽吸,操作快速方便,但操作过程中会对COCs 的完整性造成破坏[28]。随着对孤雌胚胎体外培养的深入研究,仍需进一步完善卵母细胞体外成熟的操作方法和培养体系,精确模拟胚胎发育的外环境,以期为辅助生殖技术提供参考。
牦牛卵母细胞在体外培养24 h 诱导成熟之后,用透明质酸酶对其进行消化,使卵丘细胞全部脱落,再进行体外孤雌激活,能够明显提高孤雌胚胎的体外发育能力。研究结果可为牦牛卵母细胞体外培养以及孤雌激活前期处理方式对后续胚胎发育质量提供参考,为优化体外培养模式奠定了基础。

