液相色谱-串联质谱法同时测定鸡蛋中4 种抗病毒药物残留
孙玲玲 霍江莲 陈冬东 呼秀智 霍思宇,4 耿旭浩,4高家政 彭涛* 薛占永*
(1.中国检验检疫科学研究院 北京 100176;2.河北工程大学生命科学与食品工程学院;3.中国合格评定国家认可中心;4.检科院(北京)科学技术有限公司)
0 引言
在动物养殖过程中将抗病毒药用于疾病的防治有着悠久的历史, 如金刚烷胺和金刚乙胺最早发现对禽流感病毒有着较好的治疗效果[1],利巴韦林与金刚烷胺一同使用也可用于治疗流感病毒导致的相关疾病[2],但是将人服用的抗病毒药物用于动物,缺乏安全有效的实验数据[3],无法控制合适的用药量,长期使用会导致药物在身体残留蓄积并产生不同程度的耐药性。2005 年,农业部公告第560 号明令禁止金刚烷胺、金刚乙胺、利巴韦林和吗啉胍等抗病毒药物移植兽药[4],但这类药物因价格低廉,在畜禽生产中仍有滥用现象发生[5],给人类健康带来了安全隐患。
本研究讨论了金刚烷胺、金刚乙胺、利巴韦林和吗啉胍4 种抗病毒药物的残留检测方法。目前,有关抗病毒药物残留测定方法有酶联免疫法[6-8]、液相色谱法[9]和液相色谱串联质谱法(Liquid chromatography-tandem mass spectrometry,LC-MS/MS)[10-14]等,其中酶联免疫法前处理步骤简单,不必采用精密且昂贵的仪器,但易产生假阳性结果,且每次仅能检测一种药品[15];液相色谱法需要衍生化,步骤复杂,因此研究较少[16];LC-MS/MS 法是较为有效的残留检测技术, 对抗病毒药物残留检测有较高的灵敏性和选择性,涉及的动物组织包括禽肉[17-18]、肝脏[19]、蜂蜜[20-21]等。目前,对4 种药物同时检测的报道较少且有关方法前处理复杂,耗时长。GB 31660.5—2019《食品安全国家标准动物性食品中金刚烷胺残留量的测定液相色谱串联质谱法》、SN/T 4519—2016《出口动物源食品中利巴韦林残留量的测定 液相色谱-质谱/质谱法》以及SN/T 2654—2010《进出口动物源性食品中吗啉胍残留量检测方法 液相色谱-质谱/质谱法》都不能实现4 种药物的同时测定。因此,本研究通过对前处理中提取条件优化并采用操作简便、 快速的QuEChERS 方法, 建立了一种同时检测鸡蛋中4 种抗病毒药物残留的LC-MS/MS 方法, 准确性好、灵敏度高, 以期为保障鸡蛋产品质量安全及残留监管提供技术参考。
1 材料与方法
1.1 仪器
LCMS-8050 液相色谱-质谱联用仪 (日本岛津公司);NBL223i 分析天平(精密度0.1 mg,武汉艾德姆衡器有限公司);KQ5200DE 数控超声波清洗器(昆山市超声仪器有限公司);LG-25M 冷冻离心机(四川蜀科仪器有限公司);Vortex-Genie2 涡旋混合器(美国Scientific Industries 公司);Milli-Q 超纯水系统(Milli-QAdvantage,Millipore 公司);24 位防腐型水浴氮吹仪(上海安普实验科技股份有限公司)。
1.2 试剂与药品
乙腈、甲醇、甲酸(色谱纯,美国Fisher 公司);无水MgSO4(分析纯,天津福晨化学试剂有限公司);C18(上海Welch 公司);PSA(primary secondary amine,PSA,安捷伦);GCB(graphitized carbon black,GCB,月旭科技股份有限公司)。
标准品:金刚烷胺、金刚乙胺、利巴韦林、吗啉胍、金刚烷胺-D15、利巴韦林-13C5标准品(100 μg/mL,美国TMstandard 公司)。
1.3 溶液配制
标准储备液配制: 采用经过计量检定合格的移液器,准确移取金刚烷胺、金刚乙胺、利巴韦林、吗啉胍标准溶液, 用甲醇溶解于容量瓶中, 分别定容至10 mL,配制成浓度为10 μg/mL 标准储备液,于-20℃条件下保存备用。
内标储备液:分别取金刚烷胺-D15、利巴韦林-13C5标准溶液适量,用甲醇溶解于10 mL 容量瓶中,分别定容至10 mL,摇匀,配制成浓度为10 μg/mL 内标标准储备液,于-20℃条件下保存备用。
混合标准储备液的制备: 分别精确移取标准储备液各1 mL 至10 mL 容量瓶中, 用甲醇溶解并定容,配制成浓度为1 μg/mL 的混合标准储备液。
混合内标工作液:精确移取金刚烷胺-D15、利巴韦林-13C5标准储备液各1 mL 至10 mL 容量瓶,用甲醇溶解并定容,摇匀,配制成浓度为1 μg/mL 混合内标工作液。
混合标准工作液: 准确移取上述1 μg/mL 混合标准储备液和适量混合内标工作液, 用初始流动相(0.1%甲酸(20 mM 甲酸铵)-乙腈)分别稀释成0.5、2、5、10、20、50、100 ng/mL 的标准工作液, 每一浓度工作液中含各内标质量浓度均为20 ng/mL。
1.4 样品前处理
1.4.1 提取
称取2.0 g 试样于50 mL 聚丙烯离心管内,加入40 μL 1.0 μg/mL 的内标混合工作溶液后涡旋2 min。添加10 mL 1%甲酸乙腈并涡旋将其充分混合,振荡提取15 min 后, 超声5 min,-4℃下,11 000 r/min离心5 min。
1.4.2 净化
将上清液移入含有150mg C18、150mg PSA、15 mg GCB 和900 mg 无水MgSO4的50 mL 离心管中,涡旋2 min,-4℃下,11 000 r/min 离心5 min,将上清液转移至10 mL 容量瓶中,用1%甲酸乙腈定容至刻度,移取上清液5 mL 于离心管内,40℃水浴中氮吹浓缩,用1 mL 乙腈:20 mM 甲酸铵+0.1%甲酸(90∶10,v/v)溶液溶解,超声5 min,涡旋30 s,再加入2 mL乙腈饱和正己烷去脂, 以11 000 r/min 离心3 min,取下层清液过0.22 μm 微孔滤膜,上机测定。
1.5 液相色谱条件
色谱柱:Shim-pack Velox HILIC(2.1×150 mm,2.7 μm),流动相A:乙腈,流动相B:20 mM 甲酸铵+0.1%甲酸溶液,柱温:30℃,流速:0.2 mL/min,进样量:5 μL,梯度洗脱条件见表1。
1.6 质谱条件
质谱条件为: 电喷雾离子源进行正离子模式扫描(electrospray ionization,ESI+);多反应监测(multiple reaction monitoring,MRM);电喷雾电压:4 500 V;离子源温度:300℃;雾化气流量:3 L/min;辅助加热气流量:15 L/min;其他质谱条件详见表2。
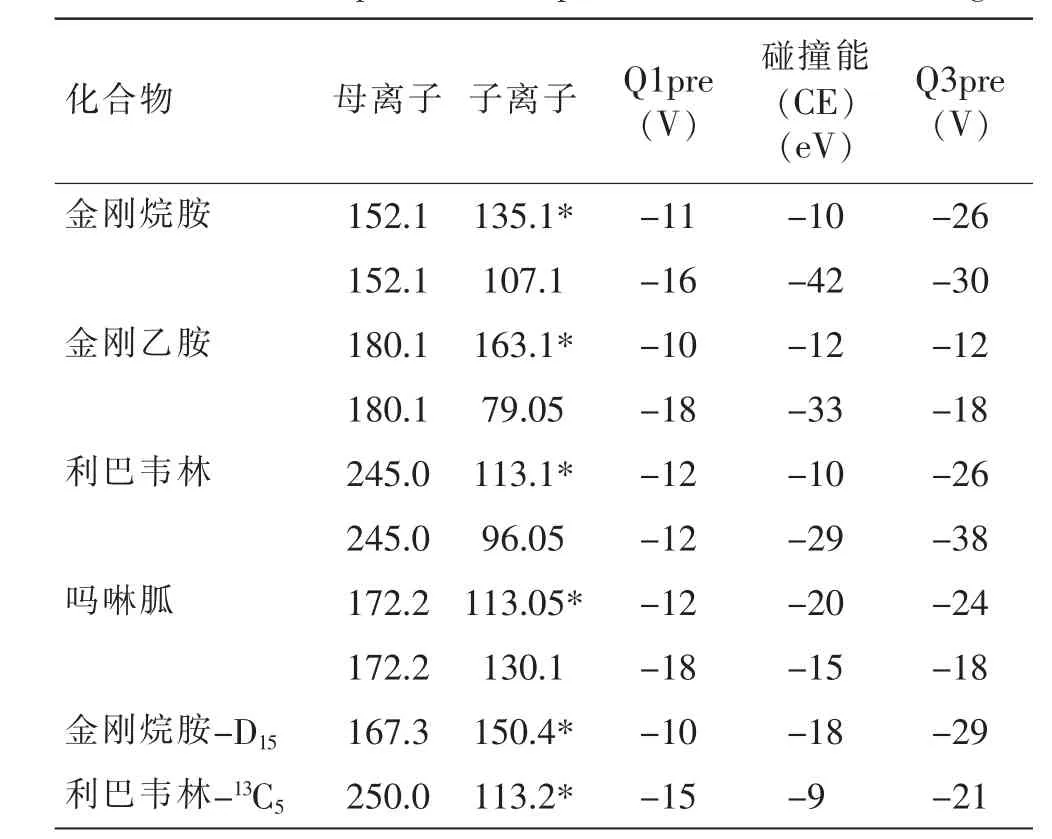
表2 抗病毒药物质谱参数Table 2 Mass spectrometric parameters of antiviral drugs
1.7 数据处理
研究数据通过岛津Labsolutions 5.114 软件进行分析,用Excel 制表,Origin 2019 绘图。
2. 结果与分析
2.1 质谱条件优化
电喷雾离子源是将样品引入离子源中离子化,MRM 对特定离子进行监测,从而达到检测药物残留的目的。 4 种抗病毒药物均可以通过甲酸提供的质子形成稳定的[M+H]+离子,所以采用正离子电离模式。 本研究采用100 ng/mL 混合标准溶液,通过正离子模式进行前体离子扫描, 以确定目标物的准分子[M+H]+离子峰, 二级质谱扫描得到目标物的子离子碎片信息图,筛选出响应高、稳定性好的两个子离子与母离子组成定性和定量离子对, 对各离子对所需的最佳去簇电压、碰撞能量等质谱参数进行了优化,最终优化结果如表2 所示。
2.2 色谱条件优化
试验首先尝试使用经典的C18色谱柱进行目标物分离,发现金刚烷胺和金刚乙胺实现良好分离,但利巴韦林和吗啉胍在1 min 内出峰,保留效果差。 金刚烷胺和金刚乙胺属于低极性化合物, 可在反相色谱柱上保留, 利巴韦林分子中含有羟基和酰胺等极性基团不容易在C18柱中保留。 因此,需要使用亲水性较强或者对极性物质能够保留的色谱柱[15]。HILIC亲水色谱柱采用强极性固定相,并结合高配比有机相/低配比水相组成的流动相,当水相比例较低时,产生较强的分子间作用力对强极性物质实现保留[22-23]。试验经过对比Waters HSS T3、Shim-pack GIST C18-AQ HP 和Shim-pack Velox HILIC 色谱柱可得,使用HSS T3 色谱柱对化合物进行分离时, 利巴韦林和吗啉胍两种药物出峰时间较早,易受杂质峰干扰,且峰后有小峰,影响定性、定量分析。 采用C18-Aq柱对化合物利巴韦林和吗啉胍的保留稍有改进,均在3 min 左右出峰, 但二者色谱峰仍有小峰出现。HILIC 模式下得到图1, 利巴韦林和吗啉胍均实现较好的保留和分离。 因此,本研究选用HILIC 色谱柱进行鸡蛋中4 种抗病毒类药物的分离检测。
图1 标准溶液特征离子色谱图(Shim-pack Velox HILIC 色谱柱,50 μg/L)Fig.1 MRM chromatograms of the standard solution (Shim-pack Velox HILIC column,50 μg/L)
由于4 种抗病毒药物都含有氨基, 呈现一定的碱性,通过酸性流动相提供质子,提高药物的离子化效率,产生稳定的[M+H]+离子,所以采用0.1%甲酸水为流动相。 然后比较了几种不同流动相体系(乙腈-0.1%甲酸、甲醇-0.1%甲酸),流动相用乙腈作为有机相时,各物质分离效果相比甲醇较好,而利巴韦林在两种流动相体系中都出现拖尾, 在流动相中加入一定浓度的甲酸铵,利巴韦林的峰形得到改善。甲酸铵可以抑制目标化合物[M+Na]+峰的形成,从而促进[M+H]+峰的形成以提高电离效率并改善峰形[24]。图2 为4 种药物混合标准溶液(50 ng/mL)在乙腈-0.1%甲酸(20 mM 甲酸铵)流动相体系下的MRM 模式色谱图。
2.3 提取条件的选择
目前, 已有的抗病毒类药物分析方法中常见的提取剂有乙腈、甲醇、酸性溶液与有机溶剂混合、酸化乙腈或酸化甲醇等[25-27]。 鸡蛋中含有大量的脂肪、蛋白质等,影响目标化合物分析,因此,试验首先尝试用纯甲醇和乙腈溶液作为提取剂, 比较二者的提取效果。研究发现对比4 种目标物质的提取回收率,纯乙腈比纯甲醇较高, 甲醇作为提取液在氮吹浓缩时有大量粘稠状物质附着于试管底部, 严重影响目标物质的回收率,这是由于鸡蛋基质复杂,蛋白质含量高,甲醇沉淀蛋白效果不如乙腈,且经净化后溶剂依旧浑浊,因此选用乙腈作为提取剂。 根据张艳、陈鑫等[11,16]研究比较加酸对提取效果的影响,同时本研究也对比了纯乙腈、1%甲酸乙腈、1%乙酸乙腈、乙腈+1%三氯乙酸溶液(90+10)、乙腈+水(90+10)(含0.1%甲酸)的提取效果。结果表明加酸会提高目标物质的回收率,1%甲酸乙腈提取回收率高于其他溶剂。 这是因为酸性环境下提取液中目标组分分配系数大,容易达到较为满意的提取效果[28],但是提取溶剂中含水不利于目标物质尤其是利巴韦林的提取,这是由于利巴韦林亲水性强,且为方便后续氮吹浓缩,需要促使利巴韦林向有机相转移,并对溶剂进行除水,水量越大,无水MgSO4用量越多,目标物质损失就越多。考虑到禽蛋中已经含有大量的水分,为方便净化环节去除提取液中的水分, 故选择1%甲酸乙腈作为最终的提取溶剂。 各溶剂对4 种抗病毒药物的提取回收率见图3。
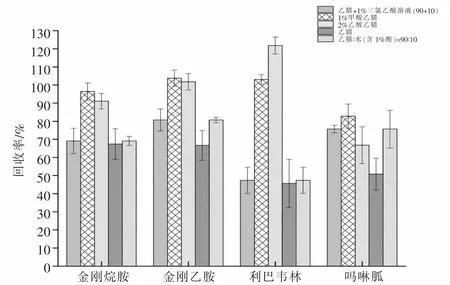
图3 不同提取溶剂对4 种药物提取回收率的影响Fig.3 Effects of different extraction solvents on extraction recoveries of four drugs
2.4 离心机转速的优化
由于鸡蛋样品含有大量蛋白, 在加入提取溶剂后能促使蛋白质的沉淀, 离心机转速的设置也会对蛋白沉淀产生影响,转速过低会影响沉淀效果,转速过高,样品收到的离心力增加,可能会出现样品溢出离心管或离心管破裂现象。试验设置3 个不同转速,测定不同转速下目标物质的回收率,如图4,当转速为11 000 r/min 和15 000 r/min 时,目标物质总体回收率较好, 而15 000 r/min 时的样品离心管稍有变形。 因此,将离心机转速设置为11 000 r/min。
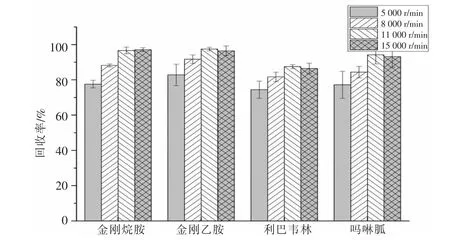
图4 离心机转速对4 种药物回收率的影响Fig.4 Effect of centrifuge speed on the recovery rate of four drugs
2.5 净化条件的选择
鸡蛋中的脂肪、 蛋白和色素等对目标物质的检测有一定的干扰, 且基质中这些共提取物直接上机测定,还会导致色谱峰形变差,数据重现性、准确度差,色谱柱寿命降低,增加仪器的维护频率[14,29]。 因此合适的净化方法对减弱基质对目标物分析和仪器的影响尤其重要。 药物净化方法包括固相萃取柱法和QuEChERS 法, 因为4 种抗病毒药物极性差异大,很难找到合适的固相萃取柱对分析物完成净化,所以本研究采用对药物极性要求较小的QuEChERS方法,无水MgSO4对基质除水,C18吸附脂肪等、PSA去除有机酸、糖类、脂肪酸,GCB 吸附鸡蛋中对极性物质测定干扰大的脂溶性类胡萝卜素。
由于净化材料在去除干扰物同时也会吸附目标化合物,使用量也需要进行控制[30]。本文以鸡蛋为研究对象, 选取900 mg 无水MgSO4, 分别对C18、PSA和GCB 进行单因素试验。以空白基质加标回收率为指标,选取最佳的净化剂用量。净化剂用量设计如表3 中所示。称取空白鸡蛋基质2.0 g,添加一定量的混合标准工作液(1.3),使其质量浓度为20 μg/kg,按照1.4 步骤前处理,以不添加净化剂为空白对照,进行试验。 首先对不同含量C18净化效果进行考察,分别比较50、100、200 和300 mg 对目标物质的影响,结果显示C18用量大小对金刚烷胺、金刚乙胺和吗啉胍回收率影响不大, 而发现随着C18用量从100 mg增加到300 mg,利巴韦林的回收率逐渐减小,为获得最佳结果, 本研究选择添加100 mg 的C18。 固定C18为100 mg 后,通过研究不同PSA 用量的影响,发现随着PSA 添加量的增加,利巴韦林的回收率明显下降。 当PSA 添加150 mg 时,吸附效果显著,因此最佳的PSA 添加量为100 mg。 固定C18为100 mg,PSA 为100 mg 后考察GCB 的最佳加入量, 在GCB添加量为15 mg 时,4 种物质回收率较好。 根据净化后鸡蛋提取液中4 种抗病毒药物的回收率测定结果可知,100 mg PSA、100 mg C18和15 mg GCB 净化方式对4 种药物的回收效果最好。
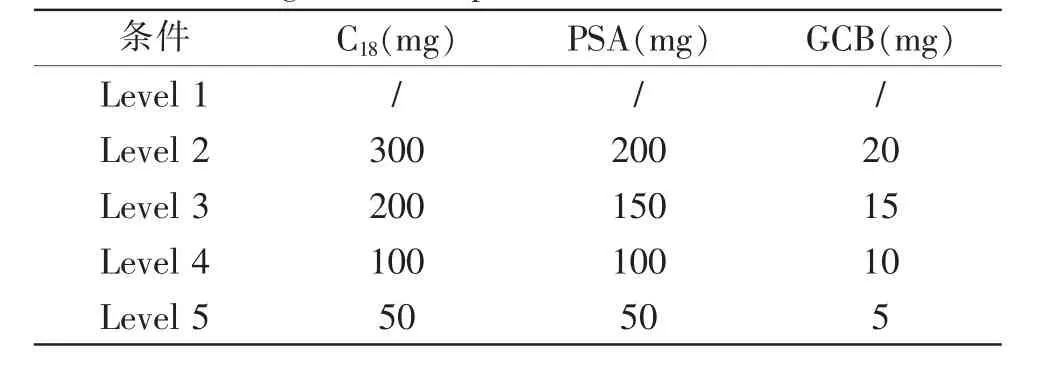
表3 净化材料因素水平设计表Table 3 Design table of purification material factor level
2.6 基质效应
鸡蛋样品经过前处理之后,仍会含有少量磷脂、胆固醇等物质, 这些物质会使待测物的离子化效率增强或降低,即基质抑制或基质增强效应。本研究以经过1.4 前处理的鸡蛋空白溶液配制基质匹配标准曲线和以初始流动相(乙腈-0.1%甲酸+20 mM 甲酸铵(1∶9))溶液配制溶剂标准曲线斜率之比基质效应(matrix effect,ME)评估鸡蛋中4 种化合物的基质效应,结果见表4。 一般认为二者之比在0.85~1.15 之间,基质效应不显著,低于0.85 表明存在基质抑制效应,大于1.15 存在基质增强效应。 金刚烷胺、金刚乙胺、 利巴韦林和吗啉胍均存在基质抑制效应,因此为提高检测分析的准确性和可靠性,应采用基质匹配曲线进行定量分析,同时采用内标法校正回收率。
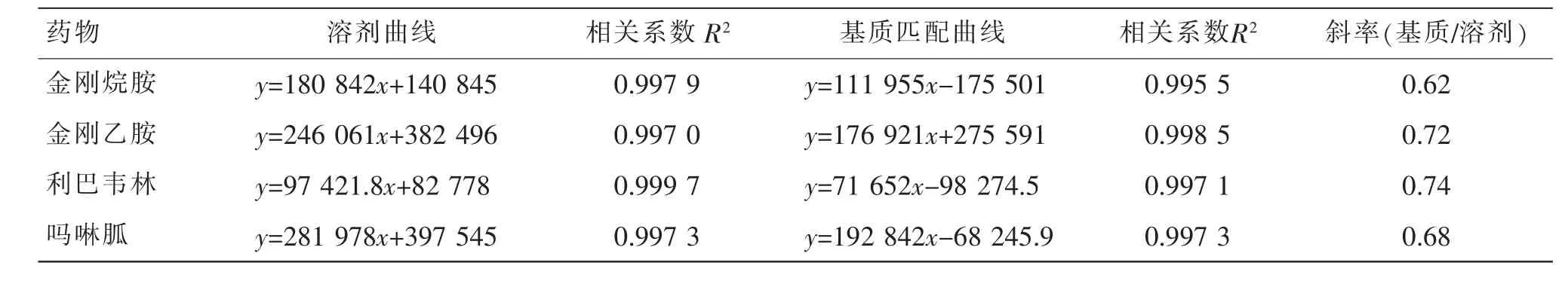
表4 4 种化合物的基质效应Table 4 Matrix effects of four compounds
2.7 线性范围和检出限
取7 份空白鸡蛋样品,按1.4 进行前处理,氮吹浓缩后加入1.3 中配制的混合标准工作液0.5、2、5、10、20、50、100 各1 mL,以及混合内标工作液20 μL,进行涡旋混匀后,配制成浓度为0.5、2、5、10、20、50、100 μg/kg 的基质匹配曲线, 进行LC-MS/MS 测定。以标准溶液浓度为横坐标, 目标物质色谱峰面积与相应的内标色谱峰面积之比作为纵坐标, 绘制标准曲线。 结果见表5,按照1.4 中建立的方法进行添加实验,以目标化合物基线噪声(S/N)3 倍对应的质量浓度确定4 种抗病毒药物的检出限(LOD),以基线噪声(S/N)的10 倍下的质量浓度确定定量限(LOQ),本方法研究的鸡蛋基质中,金刚烷胺、金刚乙胺检出限为0.1 μg/kg,定量限为0.3 μg/kg,利巴韦林检出限为1.5 μg/kg,定量限为4 μg/kg,吗啉胍检出限为0.2 μg/kg,定量限为0.8 μg/kg。
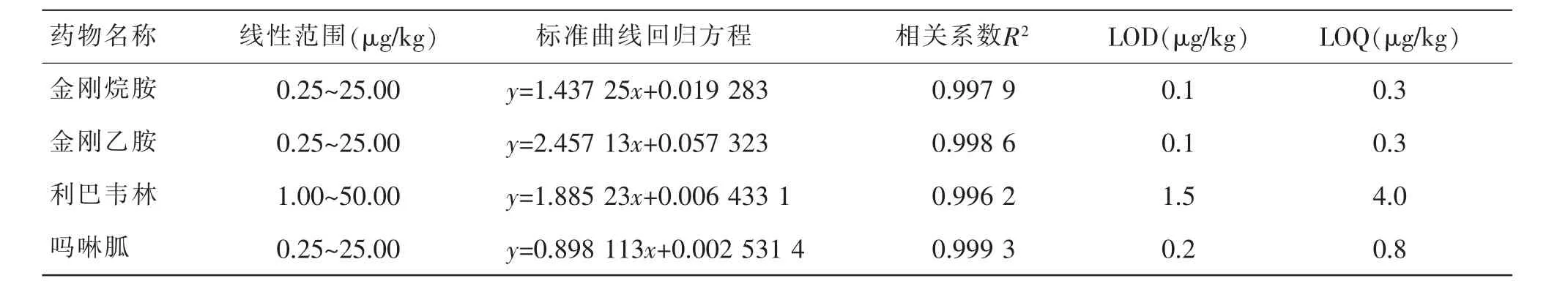
表5 抗病毒药物标准曲线、检出限和定量限Table 5 Standard curve,detection limit and quantitative limit of antiviral drugs
2.8 精密度与回收率
称量鸡蛋空白样品18 份,分成3 组,每组对4种药物定量限的1 倍、1.5 倍、2 倍的浓度添加混合标准工作液,按照1.4 进行前处理,最终根据检测结果计算回收率以及相对标准偏差(RSD,%),通过表6可知, 本方法对4 种抗病毒药物的回收率范围为75.9%~110.1%, 相对标准偏差范围为3.2%~6.9%,《GB/T 27417—2017 合格评定 化学分析方法确认和验证指南》中规定对于基质含量0.1 mg/kg 以下的标准物质,检测方法回收率要求60%~120%,此方法检测的回收率远高于化学分析方法的要求。
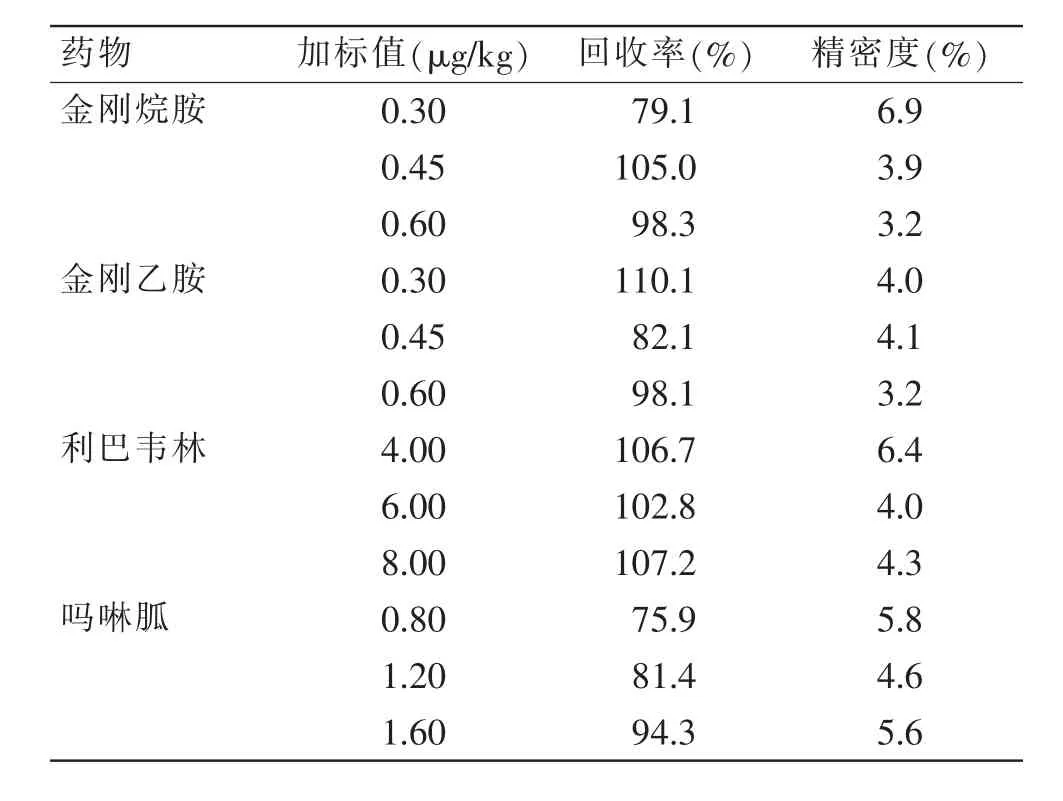
表6 鸡蛋中抗病毒药物检测的精密度和回收率Table 6 Precision and recovery of antiviral drugs in eggs
3 结论
本研究建立了一种用于鸡蛋中同时测定金刚烷胺、金刚乙胺、利巴韦林和吗啉胍4 种抗病毒药物残留的方法。 通过1%甲酸乙腈进行目标物的提取,再采用QuEChERS 法对基质杂质进行净化处理,并通过内标法结合LC-MS/MS 完成目标物的定性定量分析,可达到较低的检测水平。 与现有方法相比,该方法操作简单、回收率高、精密度好,能够为日常鸡蛋中抗病毒药物残留的检测提供技术参考。

