盐酸浸出铈基稀土抛光粉废料的反应热力学分析
董硕 ,张邦文 ,赵瑞超 ,布林朝克 ,刘芳
(1.内蒙古科技大学分析测试中心,内蒙古 包头 014010;2.内蒙古科技大学材料与冶金学院,内蒙古 包头 014010;3.内蒙古金彩矿业有限公司,内蒙古 呼和浩特 010010)
CeO2基轻稀土抛光粉由于其抛光效率高,抛光产品精度高,使用寿命长,用量少,工作环境清洁等优点[1-2]。目前它是最重要的高端抛光产品之一,尤其随着近年来高端电子信息产业的迅猛发展,国内外对CeO2基稀土拋光粉的需求量大幅增加,每年的消耗量以30%的速度增长[3]。随之稀土抛光粉用量的不断增长,大量失效的抛光粉废料被填埋和堆积,同时也造成土地和稀土资源的浪费。废弃的稀土抛光粉是主要组分:稀土元素主要为Ce和微量的La,非稀土杂质元素主要为Si、Al、Ca、Mg、Fe、C等(杂质主要来源是抛光产品、沉淀剂或凝絮剂及抛光垫的抛出物等)[3-4]。众所周知,稀土是不可再生资源,废弃稀土抛光粉含有大量的稀土资源,所以综合回收废弃抛光粉中稀土资源和有价元素,对保障稀土资源可持续健康绿色发展,弥补稀土资源暂缺具有现实意义[4-5]。
近年来,国内外许多学者对稀土抛光粉废料的综合回收和利用进行了积极的探索研究,并取得了一些有参考价值的研究成果[5-7]。研究发现[6-7],盐酸的浸出效果好于硫酸和硝酸,所以常用盐酸作为浸出剂,但在酸直接浸出稀土氧化物时(CeO2和少量的La2O3)溶解度有限,导致浸出率低的问题,同时浸出液中会引入杂质元素离子(Al3+、Fe3+、Mg2+、Ca2+等),增加后续分离提纯稀土元素的难度。在酸处理中一定要考虑到环境污染和经济成本等优化问题[8]。
前期调研的相关文献发现[9-10],综合回收稀土抛光粉废料研究主要集中在探索工艺路线及反应条件方面,采用热力学方法对该体系化学浸出反应的基础理论研究方面鲜有报道。本文旨在构建盐酸浸出稀土抛光粉废液过程中平衡热力学模型,计算反应Gibbs自由能,并通过理论计算与分析,逐一揭示了浸出温度、盐酸浓度等因素对盐酸浸出稀土抛光粉废料热力学的影响规律,并通过盐酸浸出实验进行验证,为进一步优化酸浸出稀土抛光废料工艺技术方法提供理论指导。
1 实验部分
1.1 原料及试剂
抛光粉废料粉:包头本地区某企业提供。土黄色粉末,含水量13%,100 ℃烘干过0.425 mm筛备用。盐酸为分析纯。抛光粉废料的化学成分分析结果见表1,其X射线衍射仪(XRD)见图1。
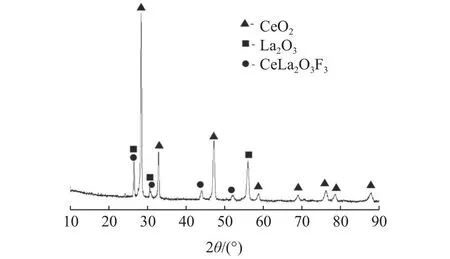
图1 抛光粉废料的XRDFig.1 XRD pattern of waste polishing power
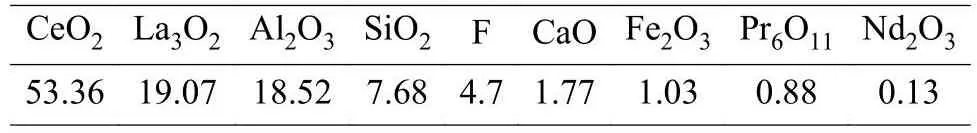
表1 抛光粉废料的化学成分/%Table 1 Chemical compositions of waste polishing power
由表1和图1可以看出,该稀土抛光粉废料的主要成分含量CeO2为53.3%,La2O3为19.07%,Al2O3为18.52%和SiO2为7.68%。从图2中可发现,SiO2和Al2O3为晶体结构,SiO2来自玻璃废渣是非晶态物质,Al2O3来自絮凝剂或沉淀剂中,烘干后获得非晶态Al2O3,该Al2O3活性较高,与通常稳定的Al2O3(刚玉)有很大的区别,遇酸或碱很容易发生化学反应。

图2 浸出温度对 CeO2浸出率和反应自由能的影响Fig.2 Effect of leaching temperature on the leaching rate of CeO2 and the free energy of reaction
1.2 实验方法
盐酸浸出实验:反应在容积为500 mL的反应器中进行,取定量的0.5~3 mol /L盐酸溶液,反应温度室温95 ℃,搅拌下缓慢加入一定量废抛光粉(10 g),搅拌均匀,保温一定时间,冷却到室温后过滤,得到浸出液,分析其中的稀土浓度,计算稀土的浸出率。
稀土浸出率(%) =浸出液中各物质的质量/废抛光粉中对应各物质的质量×100%。
2 盐酸浸出稀土抛光粉废料热力学模型构建
通过热力学条件来推断物质的反应趋势,当反应系统中的自由能变化为负值且负值越大,该反应的可能性也就越大。由于盐酸直接浸出CeO2浸出存在溶解度有限、浸出率低的问题,通常需要加入还原剂(如H2O2,铁粉、硫脲、高锰酸钾等)使Ce4+还原成Ce3+,进一步提高铈盐的溶出率。盐酸浸出稀土抛光粉废料的反应方程式见式(1)~(3)
其中,s–固态,aq–溶液态,l–液态,g–气态。化学式(1)~ (3)反应的总Gibbs自由能ΔrGm表达式如下:
式(4)中:R–气体常数,8.314 J·mol-1·K-1;T–温度,单位K;K–反应熵。各反应式(1)~(3)的总反应Gibbs标准自由能(ΔrGθ)通过各组
m分摩尔分数(ni)加权标准Gibbs自由能ΔGθf获得式(5):
式中:vi、uj分别表示产物和反应物的化学计量系数;反应式(1)~(3)中反应熵K依次分比为:
式(6)~(8)中:[H2O]、[CeO2]、[HCl]、[O2]、[CeCl3]、[La2O3]、[LaCl3]、[Al2O3]、[AlCl3]分别为各物种的活度(mol/kg),在传统化学热力学里,纯固体、纯液体的活度均为1,即[CeO2]、[H2O2]、[La2O3]、[Al2O3]和[H2O]取值为1,反应在一个开放环境中进行,压力为标准大气压,即[O2]的逸度为1,其他物质活度可以以溶液浓度来获取。本文中所涉及的各物质热力学参数见表2[11]。
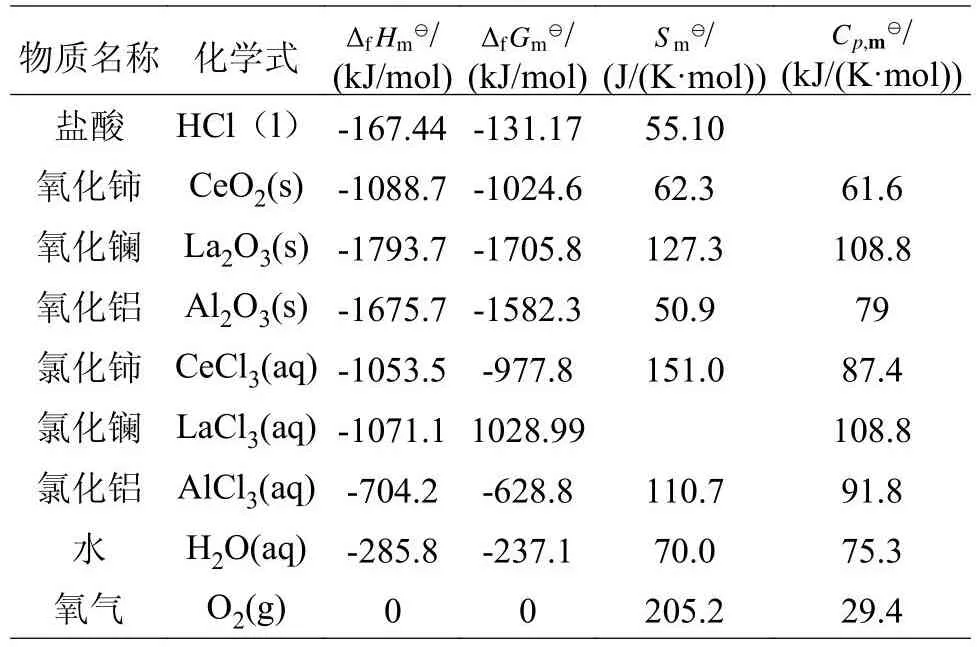
表2 物质的热力学数据[11]Table 2 Thermodynamic parameters of substance
3 结果与讨论
3.1 温度对浸出反应各产物的影响
模拟盐酸浸出抛光粉废料的反应式(1)~(3)过程中,浸出过程中体积为0.5 L保持不变,抛光粉废料用0.01 kg,盐酸浓度为1 mol/L,且盐酸用量过量,选定反应温区为20 ~ 115 ℃,实验结果,设定CeO2浸出率为近乎为0,热力学计算取1×10-8,La2O3浸出率为20%~95%,热力学计算取50%;Al2O3浸出率为91%~97%,热力学计算取95%。
按上述假设,不同温度条件下,其他相关参数均已获得,总反应Gibbs标准自由能(ΔrGm)由表1数据和式(5)计算获得,由式(6)~(8)分别代入式(4)得式(9)~(11):
实验结果和计算结果见图2~4。
由图2可知,浸出温度在20~ 115 ℃区间,1 mol/L盐酸浸出抛光粉废料中CeO2结果发现,CeO2难于溶解浸出,浸出率为0;化学反应方程式(1)反应Gibbs自由能ΔrGm计算结果表明,温度在20~ 115 ℃区间,随着温度的升高,反应Gibbs自由能ΔrGm随之降低,但反应Gibbs自由能ΔrGm仍大于零,在温度20~ 115 ℃,浓度为1 mol/L的盐酸与CeO2的反应无法自发进行,上述计算结果与该实验结论一致。
由图3可知,抛光粉废料中La2O3浸出率随着温度的升高而提高,当浸出温度升高到95 ℃时,La2O3的浸出率达83.6%;化学反应方程式(2)的反应Gibbs自由能ΔrGm计算结果表明,温度在20~ 115 ℃区间,反应Gibbs自由能ΔrGm<0,且随着温度的升高,反应Gibbs自由能ΔrGm随之进一步降低,在温度为20 ℃,该反应的ΔrGm=-300.12kJ/mol,浓度为1 mol/L的盐酸很容易和La2O3固体粉末发生反应,理论计算与该实验结果基本一致。
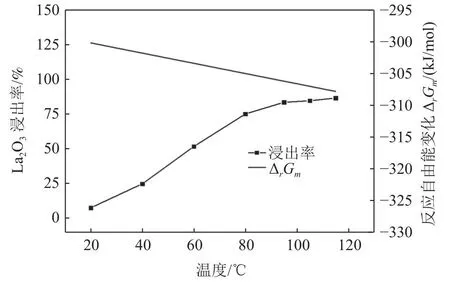
图3 浸出温度对 La2O3浸出率和反应自由能的影响Fig.3 Effect of leaching temperature on the leaching rate of La2O3 and the free energy of reaction
由图4可知,盐酸浸出抛光粉废料中Al2O3实验结果看出,当浸出温度由20 ℃升高到95 ℃时,La2O3的浸出率达91%以上,随着温度升高,浸出率也随着缓慢升高,当浸出温度升到95℃时,La2O3的浸出率达95.2%;但理论计算结果表明,该反应Gibbs自由能ΔrGm>0,随着温度的升高,反应Gibbs自由能ΔrGm随之降低,在温度为115 ℃,该反应的ΔrGm>300 kJ/mol,理论计算盐酸浸出Al2O3根本无法实现,理论计算与该实验结果完全相反。由图1和表1分析抛光粉废料成分分析发现,该抛光粉废料中的非晶态Al2O3,活性极高,而理论计算所用Al2O3是非常稳定晶体结构(刚玉)的热力学参数,导致实验结果与理论计算结论完全相反。
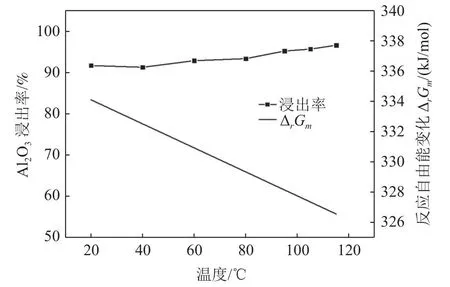
图4 浸出温度对 Al2O3浸出率和反应自由能的影响Fig.4 Effect of leaching temperature on the leaching rate of Al2O3 and the free energy of reaction
3.2 酸浓度对浸出反应各产物(物质)的影响
模拟盐酸浸出抛光粉废料的反应式(1)~(3)过程中,假定浸出体积为0.5 L保持不变,抛光粉废料质量为0.01 kg,选定反应温区为50 ℃,且盐酸用量过量,选定盐酸浓度为0.5~5 mol/L,根据实验结果,设定CeO2浸出率近乎为0,热力学计算取10-10,La2O3浸出率为20%~35%,热力学计算取浸出率为27.5%;Al2O3浸出率为93%~96%,热力学计算仍取95%。
按上述假设,不同盐酸浓度条件下,其他相关参数均已获得,总反应Gibbs标准自由能(ΔrGm)由表1数据和式(5)计算获得,由式(9)~(11)获得结算结果。实验结果和计算结果见图5~ 7。
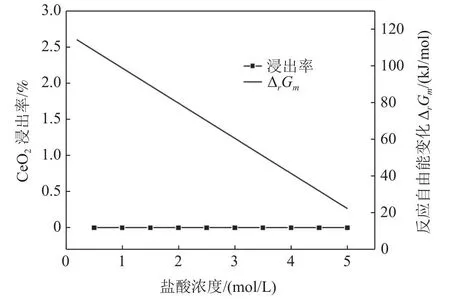
图5 盐酸浓度对 CeO2浸出率和反应自由能的影响Fig.5 Effect of concentration of HCl on the leaching rate of CeO2 and the free energy of reaction
由图5可知,浓度为0.5~5 mol/L 盐酸浸出抛光粉废料中CeO2结果发现,CeO2没有浸出溶解,浸出率为0;图5中的反应Gibbs自由能ΔrGm计算结果表明,随着盐酸浓度的增加,反应Gibbs自由能ΔrGm随之降低,但反应Gibbs自由能ΔrGm仍大于零,盐酸浓度为5 mol/L时,该反应的ΔrGm=22.27 kJ/mol,该盐酸浓度范围内,CeO2无法浸出溶解,上述计算结果与实验结论一致。
由图6可知,抛光粉废料中La2O3浸出率随着盐酸浓度的增加而随着缓慢升高,当浸出盐酸浓度为4 mol/L时,La2O3的浸出率达39.7%,浓度进一步增加,La2O3的浸出率变化不大;该反应式(2)的反应Gibbs自由能ΔrGm计算结果表明,且随着盐酸浓度的增加,该反应Gibbs自由能ΔrGm随之进一步降低,且反应Gibbs自由能ΔrGm<0,在盐酸浓度为0.5 mol/L,该反应的ΔrGm=-285.58 kJ/mol,说明盐酸很容易与La2O3固体粉末发生反应,理论计算与该实验结果基本一致,图6与图3相比可以看出,盐酸与La2O3发生反应时,温度的影响要大于盐酸浓度的影响。
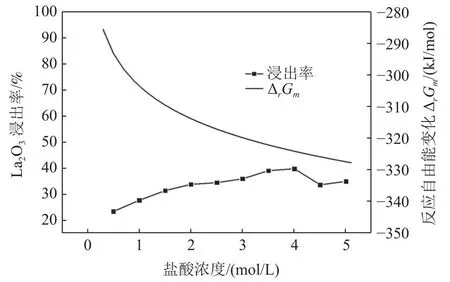
图6 盐酸浓度对La2O3 浸出率和反应自由能的影响Fig.6 Effect of concentration of HCl on the leaching rate of La2O3 and the free energy of reaction
由图7可知,盐酸浓度对Al2O3浸出率影响不大,浸出率都高于91%,但理论计算结果表明,随着盐酸浓度的增加,反应Gibbs自由能ΔrGm随之降低,但该反应的Gibbs自由能ΔrGm仍大于0,当浓度为5 mol/L,该反应的ΔrGm>305 kJ/mol,理论计算无论盐酸浓度怎么改变,Al2O3根本无法浸出溶解,理论计算与该实验结果完全相反。该实验与理论计算结果与图4相似,主要是因为抛光粉废料中的非晶态Al2O3,活性极高,所以采用稳定Al2O3晶体结构(刚玉)的热力学参数理论计算,导致实验结果与理论计算结论完全相反。

图7 盐酸浓度对Al2O3浸出率和反应自由能的影响Fig.7 Effect of concentration of HCl on the leaching rate of Al2O3 and the free energy of reaction
4 结 论
(1)由盐酸浸出抛光粉废料中CeO2的实验结果和热力学计算结果可知,改变浸出温度和盐酸浓度,抛光粉废料中CeO2固体粉末完全不能浸出溶解,实验结论和热力学计算结果一致。
(2)由盐酸浸出抛光粉废料中La2O3实验结果和热力学计算分析可知,随着浸出温度和盐酸浓度升高,抛光粉废料中La2O3浸出率都随之升高,反应Gibbs自由能ΔrGm<0,实验结果表明,浸出温度影响较大,当温度为95 ℃时,La2O3的浸出率达91%,实验结论与热力学计算结果一致。
(3)由盐酸浸出抛光粉废料中Al2O3实验结果可知,浸出温度和盐酸浓度对抛光粉废料中Al2O3浸出率影响不大,在该盐酸浸出体系中,抛光粉废料中Al2O3的浸出率都高达90%。但热力学计算结果表明,反应Gibbs自由能ΔrGm>0,理论计算与该实验结果完全相反。原因分析:抛光粉废料中的Al2O3为非晶态,活性极高,所以采用稳定Al2O3晶体结构(刚玉)的热力学参数理论计算,导致实验结果与理论计算结论不一致。该抛光粉废料中的非晶态Al2O3浸出机理需进一步进行分析和研究。

