右下肺静脉肉瘤一例并文献复习
杨青梅 施云飞 刘寅强
1 病例资料
患者女性,46岁,因“胸部CT发现右肺下叶肿块半年,肿块增大伴呼吸困难10 d”于2020年4月23日转入我院。2019年9月患者无明显诱因出现晕厥、意识丧失、抽搐,半小时后苏醒,外院急诊考虑癫痫,胸部CT发现右肺下叶肿块,建议3个月后复查,但患者未按时复查。此次入院前10 d患者无明显诱因出现气短,活动时明显,休息后可自行缓解,无其余不适。外院就诊查胸部CT示右肺下叶肿块较前明显增大(大小约3.6 cm×5.4 cm),与左心房关系紧密,怀疑静脉血栓形成。远程会诊考虑诊断心房静脉病变(1、血栓;2、静脉平滑肌瘤);又请心脏大血管外科、胸外科远程会诊,考虑肺静脉血栓或肿瘤不能鉴别,建议先行抗凝治疗,再进一步确定治疗方案。2020年4月14日给予抗凝治疗,1周后复查胸部CT示右肺静脉增粗,密度减低,与右肺下叶肿块样病变关系紧密,右肺下叶渗出病变、部分肺实变,较1周前渗出增多。因治疗效果不明显,转入我院治疗。既往史及个人史无特殊。查体:生命体征平稳,一般情况可,神清,查体合作,活动无受限。全身皮肤及巩膜无黄染,浅表淋巴结未触及肿大,气管居中。胸廓对称无畸形,双肺呼吸音清,未闻及干湿性啰音,无胸膜摩擦音。心率68次/min,节律齐,各瓣膜听诊区未闻及杂音。腹平软,无压痛及反跳痛,未触及包块,肝脾肋下未触及,肠鸣音4 次/min,无移动性浊音。生理反射存在,病理反射未引出。无颈面部、上肢水肿,无静脉曲张。实验室检查:血常规及血生化未见异常,D-二聚体0.5 μg/ml,纤维蛋白原4.19 g/L,CA125 83.69 IU/ml(参考值<35.0 IU/ml),CA724 7.05 IU/ml(参考值<6.0 IU/ml),胃蛋白酶原Ⅰ 35.55 ng/ml,胃蛋白酶原Ⅰ/Ⅱ 4.18(参考值>7.50)。入院行超声心动图示主动脉瓣轻度关闭不全,二尖瓣轻度关闭不全,三尖瓣轻度反流,肺动脉收缩压轻度增高,左室舒张功能减退。各房、室内径正常,左心房内未见明显异常,左室射血分数59%。胸部增强CT示右肺下叶多发软组织影,考虑周围型肺癌可能,右肺门淋巴结肿大;右肺下叶肺静脉及左心房内充盈缺损,考虑癌栓。经食管超声心动图示左心房近右肺静脉开口处有不规则回声团,多考虑转移灶。头颅磁共振成像、全身骨扫描、腹部超声未见异常。患者入院后主诉间断出现头晕不适。结合既往晕厥病史、影像学检查提示左心房近右肺静脉开口处占位,肿瘤及静脉血栓待鉴别。请神经内科会诊认为患者头晕不适与原发病相关,但因肺静脉占位性质不明,血栓性疾病可予抗凝治疗;但若为癌栓,在使用抗凝治疗期间有肿瘤进展及播散的可能。患者在外院已进行过抗凝治疗,会诊考虑心房近右肺静脉开口处占位,肿瘤或静脉血栓待鉴别,未发现远处转移,存在手术指征。于2020年5月11日在体外循环辅助下行右肺下叶切除+左心房部分切除+心房修补+淋巴结清扫术。术中见左心房近右肺静脉开口处不规则肿块,沿右下肺静脉生长,近心端突入左心房,与心房未见明显粘连及浸润性生长,远端沿右下肺静脉管腔生长,与肺组织关系紧密,无法分离(图1)。术后病理结果提示,(右肺下叶组织)间叶源性肿瘤,倾向肺静脉肉瘤。肿瘤大小:11.0 cm×3.5 cm×3.8 cm;脉管侵犯(+),神经侵犯(-),支气管淋巴结、7组、9组、11组淋巴结未见肿瘤转移。免疫组化:Desmin(-),SMA(-),CD34(血管+),CD31(-),STAT-6(-),CK广(-),MyoD1(-),AKL(-),VIM(+),TTF-1(-),Syn(-),CgA(-),EMA(-),ER(+),PR(-),CD10(-),Caldesmon(+),Ki-67(+,约16%)(图2)。省内病理会诊与我院结果一致。基因检测:未检测到临床有效的靶向及免疫治疗相关的有效的基因变化。患者术后恢复良好,顺利出院。建议患者术后3周返院复查及化疗,但患者因自身原因未进行化疗。于2020年9月7日返院复查胸部CT示左心房内多发软组织密度影,增强后中度强化。考虑癌栓形成或肿瘤局部复发,完善检查未发现其他部位转移,遂患者接受放疗联合化疗治疗。目前随访近3年,2023年2月返院复查未见复发,继续随访中。

A:左心房近右肺静脉开口处不规则肿块,沿右下肺静脉生长(箭头所示);B:肿块近心端突入左心房,与心房未见明显粘连及浸润性生长,远端沿右下肺静脉管腔生长,与肺组织关系紧密,无法分离(箭头所示)图1 患者术中大体所见
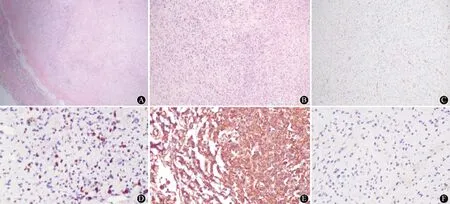
A:HE染色(低倍镜带正常);B:HE染色(高倍镜);C:CD34(+);D:Ki-67细胞核阳性约16%(×40);E:Vimentin细胞质弥漫强阳性(×40);F:Desmin细胞质阴性(×40)图2 肿块病理及免疫组化结果
2 讨论
肺静脉肉瘤是一种非常罕见的肿瘤,1961年由Kidd等[1]在文献中首次报道。在1999年Oliai等[2]综述报道的大静脉原发性肉瘤中,肺静脉肉瘤与肺动脉肉瘤的比例为1∶20。肺静脉肉瘤发生率约为0.25%,且预后不佳[3]。绝大多数肺静脉肉瘤显示平滑肌分化特征,表现为平滑肌肉瘤,镜下呈梭形细胞,异型明显,病理核分裂象多见,高增殖活性伴坏死;免疫组化显示波形蛋白、平滑肌肌动蛋白和肌间蛋白阳性,可异常表达角蛋白,部分病例有雌孕激素受体表达[2,4]。
Serati等[5]对24例病例报道进行了Kaplan-Meier生存分析,肺静脉肉瘤平均发病年龄为(47±15)岁(23~74岁)。女性患者比男性更常见,约为2∶1[6]。大多数患者(75%)在诊断过程中有症状,呼吸困难是最常见的症状,约占70%。中位生存期为13个月,提示预后不良[5]。在未手术的患者中,生存时间约6~12个月[3];即使在积极手术后的患者中,转移也很常见,局部复发时间约为6个月[7]。Hong等[8]对当时报道的24例患者进行分析,肺静脉肉瘤好发于右肺静脉,左/右比约为7∶12,最多见于右上肺静脉(约占29.2%),易顺血流方向侵犯左心房,有15例侵犯左心房,仅1例侵入右心房。
患者临床表现是非特异性的,这使得早期诊断困难,大多数病例是在组织学标本和尸检中诊断出来的[9],常见除呼吸困难外,也会有气短、咳嗽、胸痛、咯血,易误诊为原发性左心房肿瘤或肺癌。在报道的病例中也有出现神经系统症状的,包括精神异常、眩晕、肢体麻木或无力[10-11]。部分病例因心肺症状严重而需急诊手术治疗,部分患者无症状。本例患者以晕厥起病伴呼吸困难,影像学表现最初以右下肺占位体现,无特异性症状,给诊断带来了困难。
肺静脉肉瘤的诊断主要依靠术中对肿瘤生长部位的确认和病理组织学检查。因其易顺血流方向突入左心房,表现为左心房肿瘤,常被误诊为左心房黏液瘤,且二者在临床和影像学表现上均极为相似,鉴别困难[12]。组织学检查在所有左心房肿块的鉴别诊断中至关重要,其对切除边缘距离、使用辅助化疗和(或)放疗方案、预后和管理有重要意义。本例患者临床上首先表现为呼吸困难,超声心动图及胸部CT等影像学表现为右下肺静脉占位、左心房占位,术中所见及术后病理组织学检查支持肺静脉肉瘤诊断。
肺静脉肉瘤的理想治疗仍有争议。与我们的病例相似,Ogimoto等[13]研究显示其进展非常迅速。辅助放疗和(或)化疗的作用也存在争议。一项荟萃分析显示,辅助化疗未改善整体生存率[14]。但也有研究发现,在部分病例中辅助放化疗被证实可延长生存和加强疾病控制[15]。Kounami等[16]对1例18岁肺静脉肉瘤患者进行以紫杉醇为基础的联合化疗2个疗程后原发肿瘤几乎消退,4个疗程后结合自体外周血干细胞移植肿瘤完全消退,达到了2年的持续完全缓解,但最终仍然出现了骨和肺转移,无局部复发,于确诊后4年死亡。辅助放疗可能会对局部复发有效,但不会导致整体生存率的改善[17]。平滑肌肉瘤放疗敏感性低,高剂量辐射可引起心肌炎和心包炎[3]。故如有放疗指征,须仔细权衡利弊。有学者认为,完全切除肿瘤提高了生存期和辅助治疗的有效性[18-19]。建议术中切片引导切除边缘1 cm的所有左心房肿瘤,以获得更长的生存期[15]。已知平滑肌肉瘤可表达雌激素和孕酮受体,提示激素可能在肿瘤发展中有一定作用[1]。据报道,子宫和非宫腔平滑肌肉瘤患者对激素治疗有积极的反应[20],是否可作为肺静脉肉瘤辅助治疗有待于进一步探索。
关于预后因素,Hong等[8]曾对肺静脉肉瘤病例进行统计分析,未发现有显著影响生存的预测因子。Malyshev等[3]认为,决定存活的因素包括肿瘤有丝分裂指数、转移的存在、肿瘤切片的坏死区域和肿瘤向左心房局部侵犯的情况。本例患者术后未继续辅助治疗,术后3个月出现局部复发,进行了放疗和化疗,目前已随访3年余,尚未发现复发及转移。
充分切除肺静脉肿瘤可能需要肺切除术,从肺叶切除到肺切除术。本例患者影像学检查最初表现为右下肺占位,术中见沿肺静脉管腔内生长的黄色肿瘤,一端突入心房,另一端突入右下肺静脉周围组织,为达到尽可能的完全性切除,给予右肺下叶切除+左心房部分切除+心房修补术。但手术切除通常是姑息性的,转移被认为是平滑肌肉瘤的自然过程,即使在根治性手术切除后,平均局部复发时间约6个月[7],本例患者在术后3个月出现局部复发,未发现其余部位转移。关于肺静脉肉瘤的转移,由于发病率低、病例数少,转移部位在以往报道中各有不同。可转移至头皮、脑、口腔牙龈、肺、卵巢、腹膜、肝脏、肾上腺、骨、椎体和肠系膜淋巴结、腋窝淋巴结[1,10,16,21-26]。
尽管肺静脉肉瘤罕见,病例的积累和更长时间的随访是必要的,以评估明确其治疗方法。尽管理想治疗仍有争议,但手术联合放化疗等综合治疗、联合多学科诊疗可提供更个体化的有效治疗方案。
利益冲突:无

