款冬花散对COPD大鼠巨噬细胞极化的影响及其作用机制研究*
宋光玉 钟云青 吴思沁 宋坤珊 黄沛鑫 滕松杏
(1.广西中医药大学,广西南宁 530200;2.广西中医药大学附属国际壮医医院,广西南宁 530201)
慢性阻塞性肺疾病(COPD)是一种常见的气道炎症性疾病[1]。在炎症因子激活下,巨噬细胞极化参与了COPD 炎症的全过程。通过靶向干预巨噬细胞极化,使其从促炎的M1 型转化为抗炎的M2 型,可能成为COPD 治疗的新策略[2]。本实验建立COPD(痰热壅肺证)大鼠模型,以款冬花散进行干预,通过对肺泡灌洗液(BALF)炎症指标的检测及肺组织HE 病理改变,研究款冬花散对NLRP3 下游因子白细胞介素-1β(IL-1β)和白细胞介素-18(IL-18)水平的影响,并对诱导型一氧化氮合酶(iNOS)、CD10 水平进行定量检测,研究款冬花散对肺巨噬细胞极化的影响。此外,探讨TLR4/NF-κB/NLRP3 通路在COPD 大鼠肺巨噬细胞极化过程中的作用,以阐明款冬花散的作用机制。现报告如下。
1 材料与方法
1.1 实验动物
SPF 级SD 大鼠48 只,雄性,体质量180~200 g,购买于湖南斯莱克景达实验动物有限公司,许可证号:SCXK(湘)2019-0004。
1.2 实验药物
款冬花散:款冬花15 g,紫菀10 g,白术10 g,浙贝母10 g,蜜麻黄10 g,生石膏30 g(先煎代水),前胡12 g,桑白皮10 g,旋覆花10 g(包煎),甘草6 g。购自北京同仁堂医药药材有限公司,由中药房煎煮,在-70 ℃下制成冻干粉,使用前生药与0.9%氯化钠注射液按1 g∶1 mL 配制。罗红霉素胶囊,江苏扬子江药业集团有限公司,国药准字H10970291。
1.3 试剂与仪器
大鼠IL-1β ELISA 试剂盒、大鼠IL-18 ELISA 试剂盒、大鼠iNOS ELISA 试剂盒、大鼠CD10 ELISA 试剂盒均购自江苏酶免。TLR4 小鼠单克隆抗体(Santa Cruz公司),NF-κB 小鼠单克隆抗体(Santa Cruz 公司),NLRP3 兔单克隆抗体(Abcam 公司)。5515R 冷冻离心机(德国OHAUS 公司),NANo DROP 8000 紫外分光光度计(美国Thermo公司),DYY-6C凝胶电泳仪(北京六一生物科技公司),凝胶成像分析系统(美国Bio-RAD公司),GeneAmp 9700PCR 扩增仪(美国ABI 公司),StepOnePlus实时荧光定量PCR仪(美国ABI公司)。
1.4 模型制备
大鼠随机分为空白组、模型组、罗红霉素组和款冬花散低、中、高剂量组,每组8 只,共6 组。运用LPS 加烟熏联合制备建立痰热壅肺证大鼠模型[3],大鼠造模第1 天、第14 天配制LPS 2 g/mL,无菌操作下将200 μg LPS(055:B5,Sigma 公司)注射进大鼠气管,摇晃大鼠使LPS 均匀进入肺部。造模第2 天至造模第30 天(第14 天除外)将大鼠置于烟熏染毒环境中(硫黄10 g,烟叶50 g,锯末适量点燃),每天上、下午各1 h,每周休息1 d。痰热壅肺证模型:第26天气管滴LPS 1次[4]。
1.5 给药方法
建模成功后按照人与动物等效剂量换算灌胃[5]。罗红霉素组给予罗红霉素5 mg/(kg·d),款冬花散低、中、高剂量组分别予款冬花散5.57、11.14、22.28 mL/(kg·d),模型组、空白组予等量0.9%氯化钠注射液,持续14 d。
1.6 标本采集与检测
1.6.1 肺组织病理形态改变 4%多聚甲醛缓冲液固定肺组织24 h 后,进行脱蜡、染色、脱水、透明和封固,在光学显微镜下观察。
1.6.2 BALF中IL-1β、IL-18含量 ELISA法检测大鼠BALF中IL-1β、IL-18含量,按说明书操作。
1.6.3 肺组织iNOS、CD10 含量 称取右肺中叶组织200 mg,加4 ℃0.9%氯化钠注射液1 mL,匀浆后冰上静置15 min,转入离心管中4 ℃下4 000 r/min离心15 min,采用ELISA按说明书对上清液作iNOS、CD10测定。
1.6.4 肺组织Toll 样受体4(TLR4)、核转录因子-κB(NF-κB)、NOD 样受体热蛋白结构域相关蛋白3(NLRP3)mRNA 表达 取50 mg 肺组织于EP 管中,加入1 mL Trizol 剪碎,震荡混匀,4 ℃12 000 r/min 离心10 min,取上层无色水相移入另一EP管中,加入等体积异丙醇,震荡后插入冰中20~30 min,4 ℃12 000 r/min离心10 min,弃上清,加75%乙醇1 mL 震荡,4 ℃12 000 r/min 离心10 min,弃上清液,挥发完酒精,加入15~20 μL DEPC 水溶解RNA,震荡混匀后测定RNA 纯度和浓度,将RNA 逆转录成cDNA,再以cDNA 为模板进行PCR 扩增,获得检测基因表达。引物由天一辉远生物科技有限公司合成,引物信息如下。TLR4 上游:5'-TGAAACATCAGAGGAAGAACAA-3' ,下游:5'-GTCCACAGCAGAAACCCAG-3',产物大小124 bp。NF-κB 上游:5'-GCTATAACTCGCCTGGTGACA-3',下游:5'-CCGCAATGGAGGAGAAGT CTT-3',产物大小118 bp。NLRP3 上游:5'-GACCTCCAAGACCACGACTG-3',下游:5'-ATCCGCAGCCAA TGAACAGA-3',产物大小124 bp。GAPDH 上游:5'-GCAAGTTCA ACGGCACAG-3',下游:5'-CGCCAGTA GACTCCACGAC-3',产物大小141 bp。提取循环结束后的ΔCt值,采用2-ΔΔCt法计算基因相对表达量。
1.6.5 肺组织TLR4、NF-κB、NLRP3 蛋白表达 肺组织石蜡切片置于烤箱烘片,常规二甲苯脱蜡,梯度乙醇脱水,用3%H2O2去除灭活内源性过氧化酶的活性,微波抗原修复,羊血清工作液封闭,一抗4 ℃冰箱孵育过夜,PBS 冲洗,二抗37 ℃孵育1 h,PBS 冲洗,滴加辣根酶标记链霉卵白素工作液,37 ℃孵育30 min,PBS 冲洗,切片DAB 显色,自来水冲洗,苏木素复染,脱水、透明、中性树胶封片、镜检。采图后使用Image-Pro Plus 5.0 软件进行半定量分析,计算阳染的积分光密度值(IOD)。
1.7 统计学处理
应用SPSS22.0统计软件。计量资料以()表示,组间比较采用单因素方差分析,多重组间比较采用LSD法。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠一般情况及生物学特征
空白组大鼠一般情况良好,活动反应可,呼吸顺畅,摄入正常,毛发柔顺有光泽。模型组大鼠活动减少,急躁易激惹,毛发枯槁,进食减少,呼吸喘促,闻及间歇性咳喘或气道痰鸣音,气道中见黄色分泌物;经罗红霉素和款冬花散干预后,大鼠一般情况及生物学特征均有所好转。
2.2 各组大鼠肺组织病理形态改变
空白组大鼠支气管壁结构完整,肺组织少许炎性细胞浸润,无明显肺泡破坏及黏膜水肿。相对空白组,模型组大鼠支气管壁明显增厚,肺组织炎性细胞浸润加重,黏膜充血水肿,肺泡壁变薄,部分肺大泡形成。罗红霉素组与款冬花散组大鼠肺组织病理形态均较模型组改善。见图1。

图1 大鼠肺组织病理形态改变(HE染色,100倍)
2.3 各组大鼠BALF中IL-1β、IL-18含量比较
见表1。与空白组比较,模型组大鼠BALF 中IL-1β 和IL-18 的含量升高(P<0.01);与模型组比较,各治疗组BALF 中IL-1β 和IL-18 的含量均下降(P<0.01)。
表1 各组大鼠BALF中IL-1β、IL-18含量比较(ng/L,±s)

表1 各组大鼠BALF中IL-1β、IL-18含量比较(ng/L,±s)
注:与空白组比较,*P <0.05,* *P <0.01;与模型组比较,#P <0.05,##P <0.01;与罗红霉素组比较,△P <0.05,△△P <0.01;与款冬花散低剂量组比较,▲P <0.05,▲▲P <0.01;与款冬花散中剂量组比较,◆P <0.05,◆◆P <0.01。下同。
IL-18 156.38±7.15 195.93±6.52**163.40±5.31*##180.93±5.67**##△△176.36±5.86**##△△171.61±5.79**##△△▲▲组 别空白组模型组罗红霉素组款冬花散低剂量组款冬花散中剂量组款冬花散高剂量组n8 8 8 8 8 8 IL-1β 42.85±1.50 52.98±1.96**46.82±16.1**##49.92±2.85**##△△49.57±1.73**##△△48.27±1.04**##
2.4 各组大鼠肺组织iNOS、CD10含量比较
见表2。与空白组比较,模型组大鼠肺组织iNOS含量升高(P<0.01);与模型组比较,罗红霉素组及款冬花散中、高剂量组大鼠肺组织iNOS 含量下降(P<0.05 或P<0.01)。与空白组比较,模型组大鼠肺组织CD10 含量下降(P<0.01);与模型组比较,罗红霉素组及款冬花散低、中、高剂量组大鼠肺组织CD10 含量升高(P<0.05或P<0.01)。
表2 各组大鼠肺组织iNOS、CD10含量比较(±s)
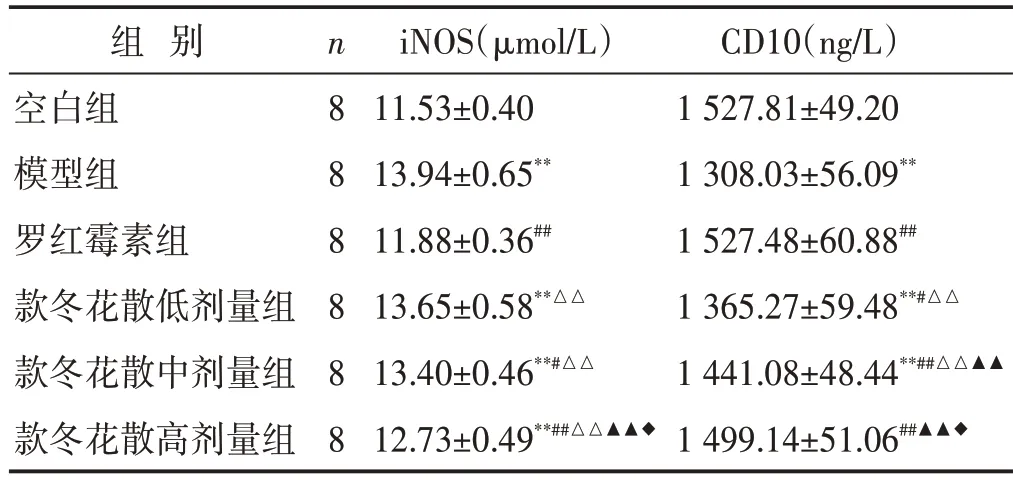
表2 各组大鼠肺组织iNOS、CD10含量比较(±s)
组 别空白组模型组罗红霉素组款冬花散低剂量组款冬花散中剂量组款冬花散高剂量组n8 8 8 8 8 8 iNOS(μmol/L)11.53±0.40 13.94±0.65**11.88±0.36##13.65±0.58**△△13.40±0.46**#△△12.73±0.49**##△△▲▲◆CD10(ng/L)1 527.81±49.20 1 308.03±56.09**1 527.48±60.88##1 365.27±59.48**#△△1 441.08±48.44**##△△▲▲1 499.14±51.06##▲▲◆
2.5 各组大鼠肺组织TLR4、NF-κB、NLRP3 mRNA 表达比较
见表3。与空白组比较,模型组TLR4 mRNA 表达升高(P<0.01);与模型组比较,罗红霉素组及款冬花散中、高剂量组TLR4 mRNA 表达下降(P<0.05 或P<0.01)。与空白组比较,模型组NF-κB mRNA 表达升高(P<0.01);与模型组比较,罗红霉素组及款冬花散各剂量组NF-κB mRNA 表达降低(P<0.01)。与空白组比较,模型组NLRP3 mRNA 表达升高(P<0.01);与模型组比较,罗红霉素组及款冬花散中、高剂量组NLRP3 mRNA表达降低(P<0.01)。
表3 各组大鼠肺组织TLR4、NF-κB、NLRP3 mRNA表达比较(±s)

表3 各组大鼠肺组织TLR4、NF-κB、NLRP3 mRNA表达比较(±s)
组 别空白组模型组罗红霉素组款冬花散低剂量组款冬花散中剂量组款冬花散高剂量组n8 8 8 8 8 8 TLR4 1.00±0.07 2.85±0.33**1.47±0.35##2.63±0.22**△△2.36±0.10**#△△2.07±0.34**##△▲NF-κB 1.03±0.37 8.52±0.94**4.10±0.87**##6.63±0.73**##△△6.41±0.65**##△△5.24±0.18**##NLRP3 1.03±0.32 1.86±0.11**1.14±0.20##1.65±0.28*△△1.25±0.26##1.22±0.27##
2.6 各组大鼠肺组织TLR4、NF-κB、NLRP3 蛋白表达比较
见表4,图2~图4。与空白组比较,模型组TLR4蛋白表达升高(P<0.01);与模型组比较,罗红霉素组和款冬花散中、高剂量组TLR4 蛋白表达下降(P<0.05,P<0.01)。与空白组比较,模型组NF-κB 蛋白表达升高(P<0.01);与模型组比较,罗红霉素组和款冬花散中、高剂量组NF-κB蛋白表达降低(P<0.01)。与空白组比较,模型组NLRP3 蛋白表达升高(P<0.01);与模型组比较,罗红霉素组和款冬花散高剂量组NLRP3 蛋白表达降低(P<0.01)。
表4 各组大鼠肺组织TLR4、NF-κB、NLRP3蛋白表达的比较(±s)
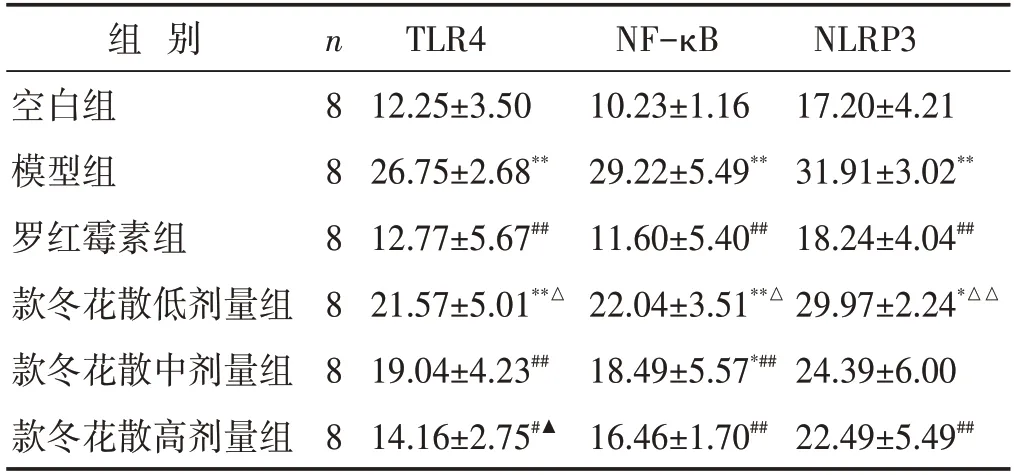
表4 各组大鼠肺组织TLR4、NF-κB、NLRP3蛋白表达的比较(±s)
组 别空白组模型组罗红霉素组款冬花散低剂量组款冬花散中剂量组款冬花散高剂量组n8 8 8 8 8 8 TLR4 12.25±3.50 26.75±2.68**12.77±5.67##21.57±5.01**△19.04±4.23##14.16±2.75#▲NF-κB 10.23±1.16 29.22±5.49**11.60±5.40##22.04±3.51**△18.49±5.57*##16.46±1.70##NLRP3 17.20±4.21 31.91±3.02**18.24±4.04##29.97±2.24*△△24.39±6.00 22.49±5.49##

图2 各组大鼠肺组织TLR4蛋白表达(免疫组化,400倍)

图3 各组大鼠肺组织NF-κB蛋白表达(免疫组化,400倍)

图4 各组大鼠肺组织NLRP3蛋白表达(免疫组化,400倍)
3 讨 论
有研究表明,我国COPD 患病率高达13.7%(40 岁及以上),至2060年预估将导致540万人死亡[6]。中医学将COPD 归入“肺胀”范畴,其最常见中医证型为痰热壅肺证,治疗应清热化痰[7]。本研究所用款冬花散源于《妇人大全良方》,具有清热化痰、平喘止咳之功效[8]。在实验前期通过临床研究和基础实验,均验证了款冬花散对支气管扩张症等气道炎症性疾病有一定的干预作用[9-11]。
炎症机制是COPD的关键机制,吸烟是COPD重要的发病因素。香烟的烟雾会激活巨噬细胞、中性粒细胞等炎症细胞,使其释放IL-1β、IL-18 等炎性介质[12-13]。巨噬细胞在微环境刺激下会极化为M1 型和M2 型,且两种巨噬细胞在特定条件下可以相互转化。M1 型巨噬细胞表面有特征性标志物iNOS,M2 型巨噬细胞有标志性蛋白CD10[14]。研究表明,M1 型巨噬细胞可以促进抗原呈递和肺部炎症反应的强化,M2型巨噬细胞能参与炎症反应的抑制、肺组织的修复及重建,通过调控巨噬细胞极化方向,使巨噬细胞由促炎的M1型转化为抗炎的M2 型,以改善肺部炎症反应[2]。因此,本研究通过测定COPD 大鼠BALF 中IL-1β、IL-18 含量和肺组织iNOS、CD10 水平来评估肺部炎症水平及巨噬细胞极化情况。
最近研究表明,TLR4可调节M1型巨噬细胞极化、促进炎症反应,NF-κB 是调控促炎反应的关键信号通路,NLRP3 与巨噬细胞促炎因子的分泌有关,通过抑制TLR4/NF-κB/NLRP3通路的表达,从而抑制M1型巨噬细胞极化,可能成为调节炎症反应的关键策略[15]。故本研究通过TLR4/NF-κB/NLRP3通路探讨款冬花散对COPD(痰热壅肺证)巨噬细胞极化的影响,以阐明款冬花散的作用靶点。
本实验结果表明,款冬花散对COPD 模型大鼠的生物学特征有一定改善作用,在一定程度上能改善肺组织的炎性改变。与空白组相比,模型组大鼠BALF中IL-1β、IL-18 含量升高,而款冬花散组其含量降低,提示款冬花散能在一定程度上抑制BALF 中炎性介质的表达,改善肺部炎症反应程度;模型组大鼠肺组织iNOS 含量增加、CD10 含量降低,而款冬花散组肺组织iNOS 含量降低、CD10 含量升高,提示款冬花散抑制了肺巨噬细胞M1 型转化,并促进向M2 型巨噬细胞极化;模型组大鼠肺组织TLR4、NF-κB、NLRP3蛋白表达增加,而款冬花散组其表达下降,且以高剂量组更明显,考虑肺部炎症反应的抑制及巨噬细胞极化过程与TLR4、NF-κB、NLRP3 蛋白表达降低有关。综上,款冬花散能改善COPD 模型大鼠肺部炎症反应,考虑与款冬花散下调肺组织TLR4/NF-κB/NLRP3通路的表达有关,通过促进巨噬细胞由促炎的M1 型向抗炎的M2 型转化,调控巨噬细胞极化方向,从而缓解炎症反应程度。国内学者通过麻杏石甘汤治疗肺上皮细胞损伤-巨噬细胞极化的级联损伤效应的机制研究,发现麻杏石甘汤能降低巨噬细胞IL-1β 的表达,通过外泌体抑制NF-κB 表达,抑制巨噬细胞M1 型极化,进而缓解因炎症细胞浸润所致的急性肺损伤[16]。此研究结果与本实验结果相似,提示清热化痰类中药能抑制COPD模型大鼠肺巨噬细胞极化,从而减轻肺部炎症反应。
综上所述,款冬花散能通过TLR4/NF-κB/NLRP3通路靶向干预巨噬细胞极化,进而达到治疗作用。本研究为款冬花散治疗COPD(痰热壅肺证)提供了客观依据。但目前巨噬细胞向M1 型或M2 型极化的重要分子信息对话尚不明确,有待进一步研究。

