补元汤通过HIF-1/NOR-1途径改善低氧性肺血管重构的机制研究*
宋文龙 李 瑾
(浙江省建德市中西医结合医院,浙江建德 311600)
缺氧性肺血管疾病是一类由缺氧引起的,以肺部中小动脉管壁增厚,血管阻力增加为特点,囊括慢性肺动脉高压、肺源性心脏病、慢性阻塞性肺疾病(COPD)等在内的疾病统称,患者可出现诸如呼吸困难、缺氧发绀、杵状指(趾)、活动耐量下降以及直立性缺氧等慢性呼吸系统典型症状体征[1-2]。这一类疾病在疾病早期症状多不典型,病情发展亦相对缓慢,诊治存在困难,加之其病理改变难以逆转,逐渐成为世界性难题。随着国内外研究的不断深入,主流研究认为机体缺血缺氧、低氧激活后遗传修饰以及肺血管重构是该病重要病理学基础[3-5]。与此同时,我们观察到缺氧环境和香烟烟雾暴露可以促进大鼠肺动脉平滑肌的异常增殖,参与肺血管重构过程,而补元汤能减轻COPD 大鼠气道炎症,改善COPD 大鼠气道及肺血管重塑的程度[6]。大量研究指出肺血管重塑主要与肺动脉平滑肌细胞(PASMC)的过度增生、迁移和程序性细胞死亡受到抑制有关[4]。低氧诱导因子(HIF-1)被广泛认为是对缺氧(低氧水平)应答的主要调节因子,参与控制机体多种过程(血管生成、代谢、增殖及凋亡)等。孤儿核受体-1(NOR-1)是一种进化上高度保守的转录因子,隶属于配体非依赖型NR4A 核受体家族,作为早期反应基因,被认为可调控人体细胞的基本功能,如炎症、增殖等生物过程[7-8]。但HIF-1/NOR-1 在缺氧性肺血管重塑(HPVR)中的具体机制仍不清楚。因此,本研究对PASMCs 采用补元汤辅助治疗,以期了解该治疗方法对低氧状态下HIF-1/NOR-1 及肺动脉血管重构的影响。现报告如下。
1 材料与方法
1.1 细胞株及实验动物
大鼠肺动脉平滑肌细胞:杭州赫贝提供。SD 大鼠,10周龄,体质量300~330 g,均购自上海斯莱克实验动物中心,许可证号:SCXK(沪)2017-0012。合格证号:2017005012875。
1.2 实验药物
补元汤:党参30 g,麸炒白术15 g,生黄芪30 g,陈皮10 g,当归10 g,锁阳15 g,山茱萸肉15 g,补骨脂10 g,升麻10 g,北柴胡10 g,炙甘草5 g。饮片均由本院药剂科提供,根据《中药药理研究方法学》计算出人鼠等效剂量为16 g/kg,并由煎药室制成100%煎剂[9],经加热到70 ℃后旋转蒸发,将药剂浓缩成每毫升含生药量4.8 g。
1.3 试剂与仪器
逆转录试剂盒:HiScript ⅡQ RT SuperMix for qPCR(货号R222-01)、定量PCR 试剂盒:ChamQ TM SYBR Color Qpcr Master Mix(货号Q411-02),南京诺唯赞生物提供。RNA 提取试剂盒(离心柱型):上海捷瑞生物工程,货号GK3016;低糖DMEM 细胞培养基:索莱宝,货号31600;胎牛血清FBS,货号10099141(美国GIBCO 公司)。WB 试剂盒,购自联科生物;青霉素钠,货号69-57-8(大连美仑生物);硫酸链霉素,货号3810-74-0(大连美仑生物),0.45 μm PVDF 膜,Millipore 公司;脱脂奶粉,伊利;SDS-PAGE 蛋白上样缓冲液(5×)、膜蛋白提取细胞裂解液、PMSF、BCA蛋白浓度测定试剂盒购自碧云天公司;Tris-Hcl/SDS(1.5 mM,pH8.8)、Tris-Hcl/SDS(0.5 mM,pH6.8)购自上海生工生物工程;Tris 碱、SDS、过硫酸铵购自Biosharp 公司。涡旋振荡仪:QL-861 型,海门市其林贝尔仪器提供。电泳系统,Mini-Proten Tetra System,Bio-RAD 公司。凝胶成像仪,ChemiDoc XRS+System,Bio-RAD 公司。倒置显微镜:南京江南永新光学有限公司,型号XD202;定量PCR 仪,美国BIO-RAD 公司,型号CFX Connect Real-Time System(96)。
1.4 含药血清制备
依照临床用药习惯,分早晚2 次对SD 大鼠进行补元汤灌胃,每次1 mL,连续1 周,结束后休息1 h,采用乙醚麻醉后腹主动脉采血,静置2 h,离心过滤除菌,水浴0.5 h灭活,-20 ℃保存备用。
1.5 标本采集与检测
1.5.1 大鼠肺动脉平滑肌细胞培养 采用10%FBS的低糖DMEM 培养基,平滑肌细胞放入37 ℃、5%CO2、饱和湿度培养箱中培养。取正常培养的处于对数期的大鼠PASMC,用0.25% Typsin 消化,1 000 r/min 离心5 min,计数板下计数,铺3 块6 孔板,每板2 孔,每孔均加入3×105个细胞,分为:常氧对照组、常氧含药组、10%氧气对照组、10%氧气含药组、1%氧气对照组、1%氧气含药组。每组设9 个复孔。放入培养箱中静置过夜。每孔分别加250 μL 对照血清和含药血清,并用培养基补充至1 500 μL,继续培养2 h,将各组细胞在低氧培养箱中于不同氧浓度下(21%,10%,1%)继续培养48 h后。48 h后收取细胞做检测。经上述步骤处理后的大鼠动脉平滑肌细胞先经过浓度为3%戊二醛固定,再予10 mg/mL 锇酸固定,逐级酒精脱水,氧化丙烯浸透,树脂包埋、切片后在电镜下观察并摄像。
1.5.2 CCK8检测细胞活力 取大鼠PASMC,经0.25%Typsin消化,1 000 r/min离心5 min,计数板下计数,铺9块6孔板,每板12孔,每孔均加入2×103个细胞,培养箱中静置过夜。每孔分别加25 μL 对照血清和含药血清,并用培养基补充至150 μL,继续培养2 h,将各组细胞在低氧培养箱中于不同氧浓度下(21%、10%、1%)继续培养。加药处理24 h 后,去掉上清,加入10%CCK8工作液,37 ℃避光反应1 h,450 nm、650 nm 处读取各孔OD 值,最终OD 值为450~650 nm。按下式计算:细胞存活率(%)=实验组(OD450-OD650)÷CK 组(OD450-OD650)×100%,以CK组为存活率100%。
1.5.3 qPCR 检测大鼠肺上皮Ⅱ细胞中B 细胞淋巴因子2(Bcl-2)、细胞周期蛋白D1(Cyclin D1)、细胞抗凋亡蛋白2(cIAP2)、HIF-1、NOR-1、Rb1 mRNA 相对表达量 将样本从-80 ℃中取出化冻,Trizol 一步法提取细胞中总RNA,分光光度计检测总RNA 浓度,按反转录试剂盒要求逆转录成cDNA。取适量CDNA,加入相应引物后PCR 扩增(各组引物序列详见表1),最终反应体系为20 μL。扩增条件为85 ℃预变性2 min,95 ℃变性30 s(56.8 ℃、64.8 ℃)退火30 s,融化曲线从70 ℃延伸95℃1 min,0.5 ℃/min,电泳后凝胶成像,行扫描定量分析,以各组净光密度与β-actin 间比值代表半定量值。

表1 引物序列
1.5.4 WB 检测HIF-1、Cyclin D1、NOR-1、Rb1、Bcl-2及cIAP2 蛋白表达水平 将各组细胞样品收集到1.5 EP 管中,每管中加入200 μL 蛋白提取试剂(使用前加入PMSF),混匀后4 ℃静置30 min,超声1 min后4 ℃离心机、14 000g离心处理10 min。取20 μg 样品,加入样品量2倍体积的上样缓冲液Buffer,再加入上述总体积1/10的β-巯基乙醇,电泳分离蛋白质,湿法转膜,加入合适浓度一抗溶液,4 ℃下完成转膜,取出已封闭的PVDF 膜,加入一抗,4 ℃孵育过夜(Bcl-2、Cyclin D1、NOR-1、cIAP2、Rb1、HIF-1 稀释比为1∶1 000,β-Actin,1∶5 000)。浸于1×TBST 缓冲液中10 min,于摇床上洗涤,该步骤重复3次。加入二抗(Goat anti-Mouse IgG、Goat anti-Rabbit IgG,1∶5 000),于室温摇床上孵育1 h。洗膜后将PVDF 膜置于保鲜膜上,取适量ECL试剂盒中等体积的A 液和B 液混合,移入凝胶成像分析仪中,曝光显影。上述实验重复3 次。时间为48 h,以对照血清为对照。
1.5.5 流式细胞检测各组细胞凋亡情况 用无EDTA的胰酶消化离心收集细胞,1×PBS 洗涤细胞两次(1 000 r/min,5 min),用500 μL Binding Buffer 悬浮细胞,在细胞悬浮液中加入5 μL Annexin V-FITC和10 μL PI,并设置单染管,摇匀后于4 ℃避光下孵育5 min,上机检测。
1.6 统计学处理
应用SPSS22.0统计软件。计量资料以()表示,组间均数比较采用方差分析。若方差齐,则两两比较用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 常氧与低氧组大鼠PASMCs电镜下形态变化
大鼠PASMCs 分别于常氧和低氧下培养,根据CCK-8 所示结果,我们分别对常氧及1%氧浓度下培养72 h后的PASMCs进行摄片。如图1所示,常氧下条件下,大鼠PASMCs 正常传代生长,细胞呈梭形或多角形,外形相对圆润;低氧下环境下(1%氧浓度)PASMCs数量减少,密度下降,细胞变细变长,细胞间隙增宽。

图1 PASMCs在常氧和低氧条件下细胞形态特征(100倍)
2.2 各组CCK8活力检测结果比较
见表2。经10%氧浓度处理24 h 后,PASMC 细胞活力较常氧组下降(P<0.01),随着培养时间的延长,PASMC 细胞活力逐渐回升,并在48 h 后超过常氧组,72 h后,与常氧组有显著差异(P<0.05);而在1%氧浓度下,PASMC 细胞活力随着暴露时间的延长,细胞活力较常氧组显著下降(P<0.01);经补元汤含药血清处理后,各组PASMC细胞活力均较各对照组下降(P<0.05)。
表2 各组细胞存活率比较(%,±s)
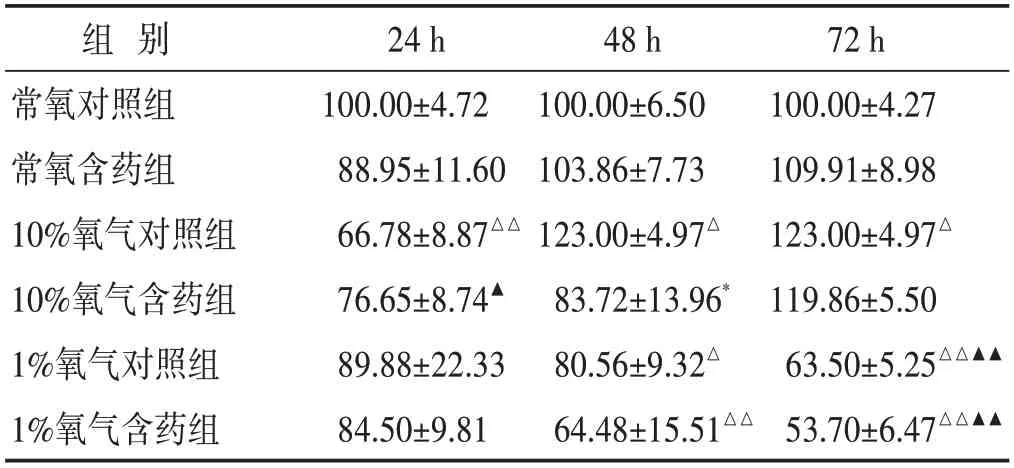
表2 各组细胞存活率比较(%,±s)
注:与常氧组对照组比较,△P<0.05,△△P<0.01;与10%氧气对照组比较,▲P<0.05,▲▲P<0.01;与同种条件的对照血清组比较,*P<0.05。下同。
组 别常氧对照组常氧含药组10%氧气对照组10%氧气含药组1%氧气对照组1%氧气含药组24 h 100.00±4.72 88.95±11.60 66.78±8.87△△76.65±8.74▲89.88±22.33 84.50±9.81 48 h 100.00±6.50 103.86±7.73 123.00±4.97△83.72±13.96*80.56±9.32△64.48±15.51△△72 h 100.00±4.27 109.91±8.98 123.00±4.97△119.86±5.50 63.50±5.25△△▲▲53.70±6.47△△▲▲
2.3 各组PASMC 细胞Bcl-2、Cyclin D1、cIAP2、HIF-1、NOR-1、Rb1 mRNA表达比较
见表3。和常氧对照组相比,随着氧气浓度降低,Bcl-2、Cyclin D1、cIAP2、HIF-1 mRNA 水平升高,NOR-1、Rb1 mRNA 水平降低;与对照血清组相比,含药血清组在1%氧气浓度下Bcl-2、Cyclin D1、cIAP2、HIF-1 mRNA水平降低比较明显,NOR-1、Rb1、蛋白水平升高比较明显(均P<0.05)。
表3 各组Bcl-2、Cyclin D1、cIAP2、HIF-1、NOR-1、Rb1 mRNA比较(±s)

表3 各组Bcl-2、Cyclin D1、cIAP2、HIF-1、NOR-1、Rb1 mRNA比较(±s)
组别常氧对照组常氧含药组10%氧气对照组10%氧气含药组1%氧气对照组1%氧气含药组HIF-1 0.98±0.06 0.83±0.07 1.00±0.00 0.67±0.25 1.46±0.13**▲▲1.25±0.10*▲NOR-1 1.51±0.55 0.80±0.29 0.25±0.08*0.56±0.27 0.10±0.03*▲0.43±0.13*Cyclin D1 0.81±0.11 0.92±0.17 1.09±0.34 1.60±0.43*1.26±0.53 0.65±0.08▲Bcl-2 0.35±0.09 0.58±0.15 1.28±0.17**0.51±0.12##1.79±0.35**1.33±0.50*Rb1 1.29±0.29 1.32±0.17 0.85±0.18 0.62±0.22*0.56±0.13*0.67±0.12*cIAP2 0.58±0.37 0.74±0.49 0.49±0.35 0.43±0.27 2.27±1.69 0.61±0.47
2.4 各组PASMC 细胞Bcl-2、Cyclin D1、cIAP2、HIF-1、NOR-1、Rb1蛋白表达比较
见图2、表4。和常氧对照组相比,随着氧气浓度降低,Bcl-2、Cyclin D1、cIAP2、HIF-1 蛋白水平升高,NOR-1、Rb1、蛋白水平降低,且1%氧气对照组均具有显著性差异(P<0.05);与对照血清组相比,含药血清组在1%氧气浓度下Bcl-2、Cyclin D1、cIAP2、HIF-1 蛋白水平显著降低,NOR-1、Rb1、蛋白水平显著升高(P<0.05)。

图2 各组Bcl-2、Cyclin D1、cIAP2、HIF-1、NOR-1、Rb1蛋白条带

图3 各组细胞凋亡率
表4 各组Bcl-2、Cyclin D1、cIAP2、HIF-1、NOR-1、Rb1蛋白灰度值比值比较(±s)

表4 各组Bcl-2、Cyclin D1、cIAP2、HIF-1、NOR-1、Rb1蛋白灰度值比值比较(±s)
组别常氧对照组常氧含药组10%氧气对照组10%氧气含药组1%氧气对照组1%氧气含药组Bcl-2 0.66±0.10 0.61±0.04 0.77±0.03 1.07±0.04##1.37±0.12**▲▲0.97±0.06##Cyclin D1 0.93±0.16 0.90±0.12 1.20±0.16 1.08±0.11 1.57±0.18**1.10±0.14#NOR-1 1.19±0.07 1.29±0.04 0.92±0.08*1.08±0.01#0.81±0.17*1.14±0.06#▲cIAP2 0.67±0.10 0.53±0.06 0.75±0.03 0.70±0.05 1.31±0.09**▲▲1.09±0.00#▲Rb1 0.92±0.16 1.01±0.06 0.74±0.11 0.87±0.11 0.49±0.05**▲▲0.75±0.15#HIF-1 0.32±0.05 0.30±0.01 0.50±0.07*0.40±0.04 0.76±0.06**▲▲0.59±0.05#
2.5 各组PASMC细胞凋亡率比较
流式凋亡测定不同氧气浓度下补元汤含药血清对大鼠PASMC 细胞凋亡的影响。结果示常氧对照组细胞凋亡率为(9.43±0.12)%,常氧含药组为(5.70±0.42)%,10%氧气对照组为(15.98±1.25)%,10%氧气含药组为(12.32±0.61)%,1%氧气对照组为(28.62±1.54)%,1%氧气含药组为(4.06±0.28)%。随着氧气含量的下降,细胞凋亡程度增加(P<0.01);与同条件对照血清组相比,含药血清的细胞凋亡程度减弱(P<0.05)。
3 讨 论
低氧可引起肺动脉压生理性升高,机体发生低氧性肺血管收缩,若低氧持续存在时,则会导致不可逆性的肺血管重构,肺循环阻力逐渐升高,出现不同程度的右心衰竭,甚至导致死亡。这也是低氧性肺动脉高压(HPH)发病的重要病理学基础。肺血管重构包括血管内皮细胞的损伤、平滑肌细胞的增殖以及外膜纤维组织的增多等多种解剖性改变,其中肺动脉平滑肌细胞(PASMCs)的增殖和凋亡失衡是导致肺血管重塑的主要原因[5,10]。调节低氧导致的PASMCs 增殖和凋亡机制,对低氧性肺血管重构治疗干预非常重要。在该阶段中,许多细胞因子和生长因子触发了调节细胞周期起始的复杂而又交错的信号转导途径。但是,控制这些过程的基因尚未明确。亦有多项研究运用基因表达分析技术,使此机制中新的转录因子不断得到确认,其间就有HIF-1、核受体NR4A 亚家族(NR4A3 为主,即NOR-1,属于孤儿NR 类固醇/甲状腺受体超家族,是早期反应基因)及多种细胞周期蛋白。在HPVR 发生、炎症反应的复杂蛋白网络中,是潜在的相关参与者。
本病可由多种肺系疾病反复发作,迁延而来。中医学根据其临床表现及疾病演变过程的认识,可归属于“肺胀”“短气”“喘促”的范畴[11-13]。该类患者大多体虚病久,损伤正气,脏气虚损,血行不畅,故痰凝血瘀,阻滞经络,主要责之于肺、心、肾,涉及肝脾,痰浊、血瘀、水饮为标,气虚为主。又因肺主气、朝百脉,故将气虚血瘀认为是低氧性肺血管重构中医发病基础,这也同时与HPVR时肺的微循环病理改变相对应。
基于对HPVR 中医病机的认识,我们在国医大师洪广祥补元汤[14]的基础上进行加减,取得一定临床疗效,并通过前期动物实验发现长期的香烟烟雾及低氧环境暴露可以促进肺动脉平滑肌的异常增殖,参与肺血管重构,而补元汤能减轻大鼠肺部充血和炎症细胞浸润,改善COPD 大鼠气道及肺血管重塑的程度。为了深入研究补元汤对低氧所致肺动脉重构的保护作用及机制,我们将大鼠肺动脉平滑肌细胞置于不同氧浓度下培养,模拟PASMC 所受低氧环境,镜下大鼠PASMCs 在低氧环境下,数量变少、细胞间隙变大,细胞呈现细长型改变。
有研究[15]将肺动脉平滑肌细胞暴露于缺氧环境下,发现与常氧组相比,缺氧条件下,肺动脉平滑肌细胞凋亡指数并无明显差异,指出缺氧性肺血管改变与肺动脉平滑肌细胞凋亡指数无相关性,认为肺动脉平滑肌细胞在增殖过程中或不伴有凋亡水平的明显改变。本实验结果发现,当置于中度缺氧环境下(10%氧浓度),PASMC 细胞Bcl-2、cIAP2 上升,凋亡率较常氧组上升,随着培养时间延长,HIF-1 表达上升,信号进入到细胞核内,使NOR-1 水平下调,Cyclin D1 上升,通过结合并激活G1 时期特有的周期蛋白依赖性激酶CDK4,G1 期周期抑制蛋白(Rb1)被磷酸化,推动细胞周期由G1 时期进入到S 时期,细胞增殖活力增加,可在一定程度上平衡甚至超过凋亡水平,从而促进血管新生,造成肺动脉的新生和重塑。当氧浓度下降至1%后,随着暴露时间的增加,PASMC 细胞活力较常氧及中度低氧环境明显下降,表明长期暴露于过度缺氧环境可使PASMC 细胞活力明显下降,凋亡率亦上升,导致肺血管的萎缩、闭塞。经补元汤含药血清干预后,HIF-1、Cyclin D1 表达水平下调,NOR-1、Rb1 表达上调,使细胞周期停滞于G1 期,而Bcl-2、cIAP2 表达下调后,PASMC 细胞活力较常氧下降,但凋亡亦处于较低水平,这有可能延缓肺动脉的重构,维持肺部血管功能[16-20]。
综上所述,本研究通过建立PASMC 低氧模型验证了补元汤抑制HIF-1、Cyclin D1 表达,上调NOR-1、Rb1,抑制Bcl-2 及cIAP2 表达水平,降低PASMC 细胞增殖活力,并使其凋亡亦处于较低水平,从而发挥对HPVR 的治疗作用。由于HPVR 发病因素复杂,病情发展过程受众多因素调控,补元汤对于HPVR 是否有其他作用机制尚有待深入研究。

