对比三年高考命题 深入研究锰元素的性质
孙 晶
(山东省日照市莒县第四中学)
锰是高考题中的明星元素,纵览近三年的全国各地高考命题,出现频次高达20多次,概括起来主要的考查热点有以下三点:1)酸性高锰酸钾溶液的强氧化性.考查其在制备氯气、除杂、检验有机物官能团性质、定量滴定等方面的应用.2)二氧化锰在酸性条件下的强氧化性.考查其在物质转化、反应速率和反应机理中的应用.3)锰元素化合物不同价态间的转化.考查其在化工流程、综合实验、电化学中的应用.中学教材中没有单独介绍锰的相关性质,下面结合高考命题热点,将锰及其化合物的知识整理成如下几点,供大家体会.
1 从“价—类”二维图角度认识锰
锰的“价—类”二维图如图1所示.

图1
2 从高频考点解读锰
2.1 Mn(Ⅳ):最重要的化合物是MnO2
1)强氧化性:
在酸性介质中,MnO2是较强的氧化剂,本身被还原为Mn2+:
2)氧化H2O2:
3)碱熔条件下MnO2可被强氧化剂氧化为(绿色):
4)锌锰干电池(Zn-MnO2-KOH):
正极:MnO2+e—+H2O=MnOOH+OH—.
2.2 Mn(Ⅵ)
2.3 Mn(Ⅶ)
2)受热或光照会分解:
这是一个“自催化”反应,因此KMnO4应置于阴凉避光处保存,常用棕色瓶存放.
3)强氧化性:
①在酸性介质中,KMnO4氧化性很强,还原产物为Mn2+:
3 从高考题中体会锰的命题趋向
3.1 融合微流程和气体制备考查
例1(双选)(2021年山东卷13)实验室中利用固体KMnO4进行如图2 实验,下列说法错误的是( ).

图2
A.G 与H 均为氧化产物
B.实验中KMnO4只作氧化剂
C.Mn元素至少参与了3个氧化还原反应
D.G 与H 的物质的量之和可能为0.25mol

图3
【真题品读】本题以KMnO4发生的系列反应考查物质的制备设计评价,涉及氧化还原反应原理的应用,明确发生的反应原理及元素化合价变化是解题的关键.
3.2 融合氧化还原理论和定量计算考查
例2(2022年山东卷8)实验室制备KMnO4的过程:①高温下在熔融强碱性介质中用KClO3氧化MnO2制备K2MnO4;②水溶后冷却,调溶液pH 至弱碱性,K2MnO4歧化生成KMnO4和MnO2;③减压过滤,将滤液蒸发浓缩、冷却结晶,再减压过滤得KMnO4.下列说法正确的是( ).
A.①中用瓷坩埚作反应器
B.①中用NaOH 作强碱性介质
C.②中K2MnO4只体现氧化性
D.MnO2转化为KMnO4的理论转化率约为66.7%
【真题品读】本题考查物质的制备实验和定量计算,属于高频考点,抓住氧化还原反应的特征、谙熟物质的成分与彼此之间的反应,是突破本题的关键之所在.
3.3 从图像分析和催化角度考查
例3(2023 年辽宁卷12)一定条件下,酸性KMnO4溶液与H2C2O4发生反应,Mn(Ⅱ)起催化作用,过程中不同价态含Mn粒子的浓度随时间变化如图4所示.下列说法正确的是( ).
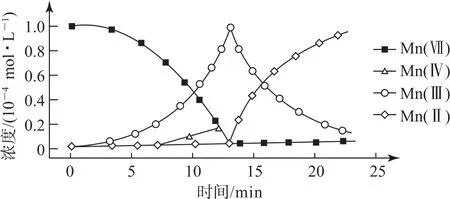
图4
A.Mn(Ⅲ)不能氧化H2C2O4
B.随着反应物浓度的减小,反应速率逐渐减小
C.该条件下,Mn(Ⅱ)和Mn(Ⅶ)不能大量共存
D.总反应为
【真题品读】本题考查了氧化还原反应过程的分析判断,主要是对离子反应和离子性质的理解、对反应速率影响因素的判断、离子方程式的书写和对图像变化的理解应用等,解答时要注意弱酸在书写离子方程式时的拆分原则和Mn(Ⅱ)的催化作用.
3.4 从工艺流程角度考查物质制备
例4(2023年全国乙卷27)LiMn2O4作为一种新型锂电池正极材料受到广泛关注.由菱锰矿(MnCO3,含有少量Si、Fe、Ni、Al 等元素)制备LiMn2O4的流程如图5所示.

图5
已知:Ksp[Fe(OH)3]=2.8×10—39,
Ksp[Al(OH)3]=1.3×10—33,
Ksp[Ni(OH)2]=5.5×10—16.
回答下列问题:
(1)硫酸溶矿主要反应的化学方程式为_________,为提高溶矿速率,可采取的措施_________(举1例).
(2)加入少量MnO2的作用是_________.不宜使用H2O2替代MnO2,原因是_________.
(3)溶矿反应完成后,反应器中溶液pH=4,此时c(Fe3+)=_________mol·L—1;用石灰乳调节至pH≈7,除去的金属离子是_________.
(4)加入少量BaS 溶液除去Ni2+,生成的沉淀有________.
(5)在电解槽中,发生电解反应的离子方程式为________.随着电解反应进行,为保持电解液成分稳定,应不断加入_________.电解废液可在反应器中循环利用.
(6)煅烧窑中,生成LiMn2O4反应的化学方程式是________.
(1)菱锰矿中主要含有MnCO3,加入硫酸后可以与其反应,硫酸溶矿主要反应的化学方程式为MnCO3+H2SO4=MnSO4+H2O+CO2↑;为提高溶矿速率,可以将菱锰矿粉碎.
(2)根据分析,加入MnO2的作用是将酸溶后溶液中含有的Fe2+氧化为Fe3+,但不宜使用H2O2氧化Fe2+,因为氧化后生成的Fe3+可以催化H2O2分解,不能使溶液中的Fe2+全部氧化为Fe3+.
(3)溶矿完成以后,反应器中溶液的pH=4,此时溶液中c(OH—)=1.0×10—10mol·L—1,此时体系中
c(Fe3+)<1.0×10—5,故认为Fe3+已经沉淀完全;用石灰乳调节至pH≈7,这时溶液中
c(Al3+)<1.0×10—5,Al3+沉淀完全,故这一阶段除去的金属离子是Al3+.
(4)加入少量BaS溶液除去Ni2+,此时溶液中发生的离子方程式为BaS+Ni2++=BaSO4↓+NiS↓,生成的沉淀有BaSO4、NiS.
(5)在电解槽中,Mn2+发生反应生成MnO2,反应的离子方程式为 Mn2++2H2OH2↑+MnO2↓+2H+;电解时电解液中Mn2+大量减少,需要加入MnSO4以保持电解液成分的稳定.
(6)煅烧窑中MnO2与Li2CO3发生反应生成LiMn2O4,反应的化学方程式为
答案(1)MnCO3+H2SO4=MnSO4+H2O+CO2↑;粉碎菱锰矿.
(2)将Fe2+氧化为Fe3+;Fe3+可以催化H2O2分解.
(3)2.8×10—9;Al3+.
(4)BaSO4、NiS.
(5)Mn2++2H2OH2↑+MnO2↓+2H+;加入MnSO4.
(6)2Li2CO3+8MnO24LiMn2O4+2CO2↑+O2↑.
【真题品读】本题主要考查由菱锰矿制备LiMn2O4,涉及物质的除杂、分离、提纯和制备,利用化学反应原理结合元素化合物知识综合考查学生分析问题、解决问题的能力,综合性较强,难度较大.
3.5 从实验探究和实验设计角度呈现
例5(2022年北京卷19)某小组同学探究不同条件下氯气与二价锰化合物的反应.
资料:ⅰ.Mn2+在一定条件下可被Cl2或ClO—氧化成 MnO2(棕黑色)、(绿色)、(紫色).
ⅲ.Cl2的氧化性与溶液的酸碱性无关;NaClO 的氧化性随碱性增强而减弱.
实验装置如图6所示(夹持装置略).
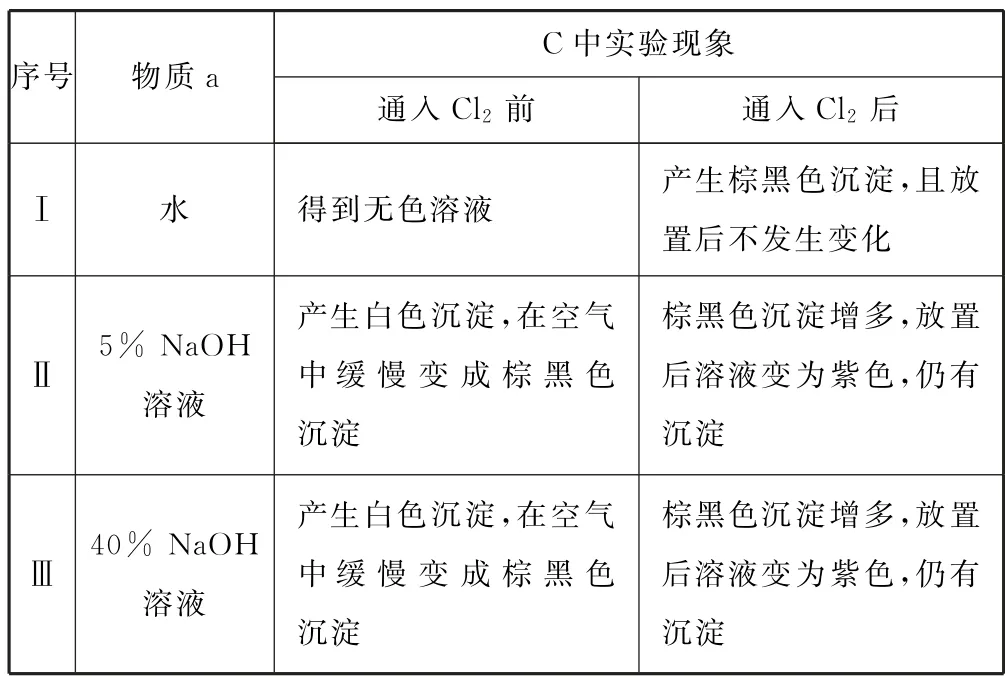
表1

图6
(1)B中试剂是_________.
(2)通入Cl2前,Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为_________.
(3)对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是_________.
(4)根据资料ⅱ,Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱.
①用化学方程式表示可能导致溶液碱性减弱的原因,但通过实验测定,溶液的碱性变化很小.
②取Ⅲ中放置后的1 mL 悬浊液,加入4 mL 40% NaOH 溶液,溶液紫色迅速变为绿色,且绿色缓慢加深.溶液紫色迅速变为绿色的离子方程式为_________;溶液绿色缓慢加深,原因是 MnO2被________(填“化学式”)氧化,可证明Ⅲ的悬浊液中氧化剂过量.
③取Ⅲ中放置后的1mL悬浊液,加入4mL水,溶液紫色缓慢加深,发生的反应是________.
④从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:_______.
(1)B中试剂是饱和NaCl溶液,作用是吸收Cl2中的杂质HCl气体.
(2)通入Cl2前,Ⅱ、Ⅲ中Mn2+与碱性溶液中NaOH 电离产生的OH—反应生成Mn(OH)2白色沉淀,该沉淀不稳定,会被溶解在溶液中的氧气氧化为棕黑色MnO2,则沉淀由白色变为黑色的化学方程式为2Mn(OH)2+O2=2MnO2+2H2O.
(3)对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是:二价锰化合物在中性或弱酸性条件下只能被氧化到MnO2,在碱性条件下可以被氧化到更高价态,Mn2+的还原性随溶液碱性的增强而增强.
(4)①Cl2与NaOH 反应产生NaCl、NaClO、H2O,使溶液碱性减弱,反应方程式为
②取Ⅲ中放置后的1mL悬浊液,加入4 mL 40% NaOH 溶液,溶液紫色迅速变为绿色,且绿色缓慢加深;溶液紫色变为绿色是由于在浓碱条件下,可被OH—还原为,根据电子守恒、电荷守恒及原子守恒可知该反应的离子方程式为
溶液绿色缓慢加深,原因是MnO2被NaClO 氧化,可证明Ⅲ的悬浊液中氧化剂过量.
③取Ⅲ中放置后的1mL悬浊液,加入4mL水,溶液碱性减弱,溶液紫色缓慢加深,说明ClO—将MnO2氧化为,发生的反应为
答案(1)饱和NaCl溶液.
(2)2Mn(OH)2+O2=2MnO2+2H2O.
(3)二价锰化合物在中性或弱酸性条件下只能被氧化到MnO2,在碱性条件下可以被氧化到更高价态,Mn2+的还原性随溶液碱性的增强而增强.
【真题品读】本题考查性质实验方案的设计,侧重考查阅读、分析、判断及实验探究能力.该类题目属于高考热点题型,明确元素化合物的性质、正确理解题给信息并灵活运用信息解答问题是解答本题的关键,第(4)问为本题解答难点.
结合以上三年高考命题的考查形式来看,对于Mn2+的催化作用和高锰酸钾、锰酸钾的强氧化性的考查居高不下,属于高频考点.预计在2024年的高考中,融合氧化还原反应、工艺流程、图像分析和探究性实验方案设计等形式考查锰及其化合物,将有很大的命题空间与前景.仔细研析上述高考题对锰及其化合物的考查呈现形式与解答的思维架设过程,用心揣摩锰及其化合物的“价—类”二维图及其转化原理,抓好落实与突破,方可驾轻就熟,考出水平,考出好成绩.
(完)

