低白蛋白血症与白蛋白的临床应用
杨纯福,唐阿梅
(1.贵州中医药大学,贵州 贵阳 550000 ;2.贵州中医药大学第一附属医院,贵州 贵阳 550001)
血清白蛋白作为疾病预后标志物和治疗药物在临床中起着重要作用。然而,由于临床中关于白蛋白制剂使用的研究结论存在差异且偶尔相互矛盾,缺乏明确的使用指导,因此白蛋白制剂的使用方法逐渐发生着变化。笔者根据现有证据为临床中白蛋白补充的适应证提供一些明确的建议,期望进一步的研究能阐明白蛋白的具体作用。
1 白蛋白的生理、生化特点
1.1 白蛋白的结构
白蛋白(albumin,Alb)又称清蛋白,是由585个氨基酸依靠17 个二硫键链接而成的环状结构物,分子量约为69 000 道尔顿。白蛋白具有弹性结构,生理条件下很容易恢复形状,由于二硫化物桥破裂后,分子可以重新建立这些桥,并恢复其结构,因此其仅在温度、pH 值和离子或化学环境发生剧烈的非生理变化时才会发生变性[1]。在人体生理环境中,白蛋白为负离子,每个分子可以带有200 个以上负电荷。在人体内,白蛋白是含量最大的血浆蛋白,作为主要载体,许多水溶性差的物质都可以通过与其结合而被运输。另外,白蛋白作为构成血浆胶体渗透压最主要的成分,对维持体液平衡有着至关重要的作用。
1.2 白蛋白的合成及代谢
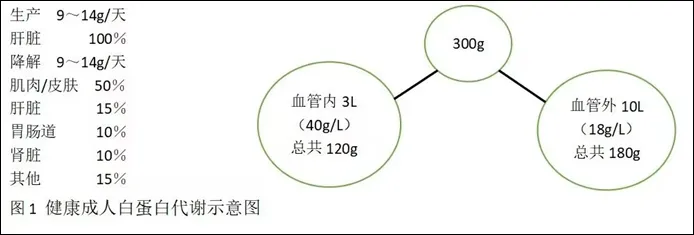
白蛋白由肝实质细胞合成,其合成速度约为9 ~14 g/d,60% ~70% 分 布 于 血 管 外,主 要 储存于瘦体组织内,分布于皮肤、肌肉、内脏中;30% ~40% 分布于血管内(见图1)。白蛋白的合成受多种因素的影响,包括个体的营养状况、氨基酸和能量的供应、激素水平、内环境等[2]。胰岛素、皮质激素可促进其合成;当出现肝脏实质性病变、生理应激、甲状腺功能低下、血浆皮质醇过高时,其合成量往往会下降。正常情况下,白蛋白的代谢半衰期约2 ~3 周,中位时间约18 ~19 天,每日代谢率(分解)约为总量的6% ~10%。
1.3 血清白蛋白浓度降低的原因
血清白蛋白浓度由血管内白蛋白质量与血浆容量决定,这两者又由其他因素进一步决定。生理条件下,血浆白蛋白的浓度与其合成速度及分解代谢率有关。液体输注的稀释将导致白蛋白浓度在短时间内快速降低,但变化程度一般较小,除非同时存在白蛋白丢失,例如烧伤、大量失血、经肠道或肾脏丢失,全身白蛋白浓度才会严重下降[3]。危重疾病会改变血管内和血管外腔室之间白蛋白的分布,白蛋白的合成和分解速率也会发生变化;特别是脓毒症患者,其体液分布状态会显著改变,而胶体渗透压和白蛋白浓度之间的关系是复杂的,受血管通透性改变的影响,白蛋白会重新分布。它涉及内皮屏障的功能障碍,导致毛细血管渗漏,蛋白质、炎症细胞和大量液体流失到组织间隙内。相关介质包括:革兰氏阴性菌的内毒素、细胞因子(TNF.α 和IL.6)、花生四烯酸代谢物(白三烯和前列腺素)、补体(C3、C5)、其他血管活性肽(缓激肽、组胺)、趋化因子等[1],淋巴液清除率的下降可能同样起到重要的作用。继发于血管通透性改变的白蛋白再分布可导致血清白蛋白浓度在数小时至数天内降低,其降低的速度较慢,但变化幅度会更大。上述机制中的每一种都能够以不同的速率影响血清白蛋白浓度的变化。
2 白蛋白的临床应用
2.1 白蛋白变化的意义
人血白蛋白制剂是由健康人体血浆经低温乙醇蛋白分离法提取,并经病毒灭活处理制成(浓度为4%、5% 或20%)。临床上对人血白蛋白是否能作为营养制剂来补充,特别是在存在低白蛋白血症的危重症患者群体中的应用进行了大量研究。2018 年的ESPEN 临床营养指南提出:血清白蛋白水平并不是营养状况的良好标志物,其低值是机体对炎症的一种反应,炎症通常与低白蛋白血症有关[4]。人体内白蛋白的分布位置包括血管内及血管外,血浆中每小时有多达5% 的白蛋白从血管内渗漏到血管外间隙(即经毛细血管逃逸),间质白蛋白大部分通过淋巴回流再次进入血管内。英国生理学家Ernest Henry Starling 在1896 年提出的Starling 原理认为,微血管液体的交换是由相对于血管壁的静水压和渗透压的平衡决定的,并且这种水的运动由细胞间隙调节[5]。很长时间内,血管内皮一直被认为是维持血管壁通透性的物理屏障。有学者在显微镜下发现内皮腔表面被一层保护性的“果冻状”层覆盖,临床上将其称为糖萼。糖萼层和内皮细胞均有助于维持完整的血管屏障,TER 取决于血管内皮上糖萼的完好和内皮细胞功能。实验证据显示,糖萼在炎症存在下很容易降解,它的病变可引发血管屏障的破坏,在全身炎症反应、脓毒症、创伤发生后和手术后,糖萼及血管内皮的损伤更为明显。有研究表明,脓毒性休克患者的白蛋白经毛细血管逃逸率增加了约300% 以上,心脏手术后7 小时内的白蛋白经毛细血管逃逸率平均增加约100%,癌症患者的TER 远高于健康个体。这些大幅度的白蛋白逃逸速率增加表明血管通透性增加是急慢性疾病中常见白蛋白浓度降低的重要原因。理论上,随着白蛋白经毛细血管膜渗漏的增加,相关淋巴回流也应该增加,但实际上并没有,这可能与白蛋白的重新分布有关。有研究指出,危重症患者的白蛋白合成速率可能会显著改变,炎症介质可以直接抑制白蛋白基因的表达[6],急性期反应可导致许多其他血浆蛋白(如CRP、纤维蛋白原、α1.抗胰蛋白酶、补体等)合成的显著增加,但白蛋白的合成却没有增加;同时,可导致出血、胃肠道白蛋白丢失的增加[7];在一些患者(尤其是老年患者)中,由于营养状况不佳或肝功能受损,基线白蛋白水平可能已经较低[8.9],而静脉输液稀释会导致血浆白蛋白水平进一步下降。在应激状态下,白蛋白的分解代谢可能会发生改变。
2.2 白蛋白补充的适应证
2.2.1 纠正低血浆渗透压 ESPEN 重症监护病房营养指南指出,长期以来,低白蛋白血症被错误地认为是营养不良的标志。危重症患者出现的低白蛋白血症主要是由于白蛋白再分配及大量丢失所致[10.11],低白蛋白血症并不是启动外源性白蛋白补充的一个必然指标。当血清白蛋白<20 g/L 时,会导致低血浆渗透压,而纠正低血浆渗透压才是输注白蛋白的唯一指征(除肝衰竭伴腹水外)。但有Meta 分析表明:为危重症患者补充白蛋白并不会降低病死率,与晶体液相比,白蛋白可能会增加病死率。一项针对6997 例ICU 患者的临床试验比较了使用4% 白蛋白和生理盐水进行液体复苏对死亡率的影响,结果显示两组的28 天病死率无差异,但白蛋白组第4 天达到血流动力学目标的患者其接受的液体量相对更少,这表明白蛋白在危重症患者中具有潜在的应用优势。2014 年的ALBIOS试验表明:在重度脓毒症患者中,与单独使用晶体液相比,20% 白蛋白联合晶体液治疗并未提高患者28天和90 天的生存率,但研究提示在治疗的前28 天内补充白蛋白维持血清白蛋白≥30 g/L 是安全的,亚组分析也显示患者死亡率较低,这可能与白蛋白的给药能改善血流动力学,降低器官功能障碍的严重程度有关。但为危重症患者补充白蛋白以增加血浆容量是有争议的,因为毛细血管不仅会渗漏晶体液,也会渗漏胶体液,补充白蛋白可能会加重间质性水肿。有研究表明,为脓毒症患者补充白蛋白溶液时,合理控制液体输注可纠正低渗状态,增加有效循环血容量。
2.2.2 预防急性肾损伤 ALBIOS 研究显示,补充白蛋白并未明显降低脓毒症患者的肾脏替代治疗(RRT)需求和急性肾损伤(AKI)的发生率。欧洲肝病协会指南中指出,对于肝硬化合并细菌性腹膜炎患者,早期应用白蛋白可降低其肝肾综合征的发生率和死亡率;对于合并腹水的患者,推荐使用腹腔穿刺联合白蛋白来保护肾功能。白蛋白可能通过影响肾脏血流的自动调节机制来改善肾功能[12.13]。研究表明,针对血清白蛋白低于40 g/L 的心脏外科手术患者,术前给予
20%白蛋白可使术中尿量增加,降低术后AKI 发生率。白蛋白可以通过促进间质液体的重吸收来增加血管内容量,从而增加肾脏灌注,预防AKI。最近的一项RCT 显示,在伴有脓毒症相关低血压的肝硬化患者中,5% 白蛋白可以改善血流动力学指标及7 天生存率。这提示在某些疾病中或者疾病某些阶段,补充白蛋白是有益的。
2.2.3 液体管理 液体过负荷在危重症患者中常见,与死亡率增加有关,还会导致多种并发症,袢利尿剂呋塞米常用于其初始治疗,而低白蛋白血症常出现利尿剂抵抗。呋塞米+ 白蛋白已成为临床实践中常用的联合疗法,以增强利尿效应,达到管理和优化体液平衡的目的。一项纳入40 例机械通气急性肺损伤合并低白蛋白血症患者的RCT 显示,呋塞米联合白蛋白可以提高血清白蛋白水平,显著改善氧合,获得液体负平衡,且血流动力学稳定性更好。最近一项针对13个RCT 的Meta 分析显示:与单用呋塞米治疗相比,呋塞米联合白蛋白治疗可使尿量和钠排泄增加,在对低白蛋白血症(血清白蛋白<25 g/L)或者白蛋白补充剂量大于30 g 的危重症患者的利尿和利钠治疗方面其均更有优势。这为临床中选择适应患者和治疗剂量提供了参考依据。
3 总结
白蛋白具有许多重要的生理特征,血清白蛋白作为疾病的非特异性标志物,其相关临床诊断价值有限。其水平的变化是疾病发展的结果,而并不是诱因。有研究指出,血清白蛋白浓度降低与疾病严重程度和不良结局密切相关。补充白蛋白可能只是对某些疾病的治疗有益,相比其他复苏液体,白蛋白更加昂贵,临床上可将其用于特定的患者群体。

