探讨经腹胃充盈超声应用于胃癌诊断及临床分期的价值
李悦扬 方 圆 刁雪红 姚明华 李 鑫 陈惠莉 刘 阳 王庆国 李康安 吴 蓉 黄 陈
胃癌是一种发病率和死亡率均较高的恶性肿瘤,其发病率位于全球第5位[1]。在我国,胃癌发病率和死亡率分列恶性肿瘤的第2、3位[2]。胃癌的治疗及预后与诊治时机和术前评估密切相关,由于胃癌发病多较为隐匿,大部分胃癌患者至进展期才被确诊。因此,胃癌的早期发现可显著提高患者生存率[3]。国际抗癌联盟-美国癌症联合委员会(International Union Against Cancer-American Joint Committee on Cancer, UICC-AJCC)指南指出,胃癌的临床肿瘤原发灶-淋巴结-远处转移(TNM)分期是指导临床诊断及选择根治性或姑息性治疗方案的主要依据[4]。胃癌的临床诊断和术前分期评估通常应用消化道内镜、消化道内镜超声检查术、发射单光子CT等方法。消化道内镜下活组织检查(简称活检)是目前诊断胃癌的金标准,可进行组织学诊断。然而,消化道内镜下活检是有创检查,不适用于疾病筛查。消化道内镜超声检查术目前也已广泛应用于胃癌的诊断,但其诊断T3期及以上胃癌和淋巴结转移的灵敏度较低。增强计算机断层扫描(enhanced computed tomography, ECT)虽被广泛应用于胃癌的检出与术前分期的评估,但其费用较高。近年来,随着胃充盈造影剂的推广、胃超声检查技术的进步和医师经验的不断积累,经腹胃充盈超声(transabdominal gastric filling ultrasound, TGFUS)检查成为诊断和评估胃癌的另一种有效方法,因其具有无创性、无辐射性、便捷性、可动态观察等优势,适于在基层医院开展,故其在胃癌诊断和术前分期中的应用逐渐受到重视[5]。TGFUS的原理是利用胃肠助显造影剂作为透声窗,排除气体干扰,充盈胃腔,清晰显示胃壁的结构及层次。目前,TGFUS在鉴别胃良、恶性病变中具有一定优势。但相较ECT,临床对TGFUS诊断胃癌及评估胃癌分期的价值等仍未形成共识。因此,本研究通过对比ECT,探讨TGFUS在胃癌诊断和临床分期评估中的价值,以期为该技术在临床的进一步应用提供一定的理论基础。
1 对象与方法
1.1 研究对象 回顾性分析2021年1月1日—2022年7月31日在上海交通大学医学院附属第一人民医院因胃癌接受肿瘤切除手术的109例患者资料,其中男65例、女44例。所有患者在手术后1周内均行病理学检查。纳入标准:①经消化道内镜下切除或腹腔镜下D2胃癌根治术的早期及进展期胃癌;②治疗前均行ECT和TGFUS检查。排除标准:①对碘造影剂过敏;②无法手术的晚期胃癌,包括远处转移;③病史资料不完全;④无法耐受ECT和TGFUS检查。本研究经医院伦理委员会审核、批准(审批号:2021KY091)。
1.2 研究方法 以病理学检查结果为金标准(即阳性对照),分析TGFUS和ECT检查的诊断准确性。
1.2.1 TGFUS检查 使用频率为2.0~5.0 MHz C6-1凸阵探头的aplio900彩色超声诊断仪(日本佳能医疗公司)进行TGFUS检查。患者检查前一晚禁食、禁水,将速溶胃肠超声助显造影剂(浙江湖州东亚医药用品有限公司)在100 ℃沸水中速溶,形成均匀的稀糊状物,冷却至适宜温度后嘱患者口服500~600 mL,随后进行检查。在检查过程中,患者取站立位,按由上到下、由左到右顺序扫查胃底、胃体、胃角、胃窦、幽门,取俯卧位扫查贲门[6]。将上述检查中获得的影像学资料交由2名具有5年及以上临床经验的超声科医师进行独立分析和评价。
1.2.2 ECT检查 使用西门子64层螺旋CT扫描仪进行ECT检查,具体参数:探测器配置0.50~0.75 mm,管电压120 kV,管电流150 mA,层厚度2~5 mm,重建间隔2~3 mm。患者在检查前禁食8 h,检查前20 min饮用800~1 000 mL温水,并肌内注射20 mg山莨菪碱。在ECT检查期间,患者取30°左后斜位以检查胃的中下2/3,随后立即改为右卧位以检查胃的上1/3。静脉注射1.5 mL/kg(速率为3~5 mL/s)碘造影剂后获得ECT图像,并将ECT数据传输至工作站进行分析。将上述检查中所获得的影像学资料交由2名具有5年及以上临床经验的放射科医师进行独立分析和评价。
1.3 观察指标 记录纳入患者的年龄、性别,不同检查方法下肿瘤的位置、大小、浸润深度、分型、分期,分析2种检查对各分期肿瘤的诊断效能,并应用观察者间测量一致性(interobserver consistency, ICC)分析2种检查诊断的稳定性。将临床T分期(clinical stage, cT)分为cT1~T2期和cT3~T4期,将临床N分期(clinical lymph node, cN)分为cN0期和cN1~N3期。
1.3.1 TGFUS检查相关指标定义 肿瘤浸润深度评估基于胃壁在超声上显示的5层结构[6](第1层呈高回声,代表胃腔与黏膜之间的界面;第2层呈低回声,代表黏膜层;第3层呈高回声,代表黏膜下层;第4层呈低回声,代表固有肌层;第5层呈高回声,代表浆膜层)。记录TGFUS下评估肿瘤浸润的层次(ultrasound-stage, uT)和淋巴结转移(ultrasound-lymph node, uN)。胃癌临床分期标准依据UICC-AJCC指南(第八版)的TNM分期系统定义[4]。TGFUS评估胃癌T分期标准:T定义为原发性肿瘤浸润至胃壁的深度;T0期为切除的样本中没有肿瘤;T1期表现为肿瘤侵袭固有层、黏膜肌层或黏膜下层;T2期表现为肿瘤侵袭固有肌层;T3期表现为肿瘤穿透浆膜下结缔组织,但未侵及内脏腹膜或邻近结构;T4期表现为突出浆膜层或邻近结构的肿瘤浸润。TGFUS评估胃癌N分期标准:胃周或胃外淋巴结的短轴直径>5 mm时,被认为是淋巴结阳性,其他征象包括呈圆形。
1.3.2 ECT检查相关指标定义 肿瘤浸润深度基于ECT上显示胃壁的3层结构评估,即黏膜层高增强,黏膜下层低增强,肌层及浆膜层高增强。记录ECT下评估肿瘤浸润的层次(enhanced CT-stage, ECT-T)和淋巴结转移(enhanced CT-lymph node, ECT-N)。ECT评估胃癌T分期标准[4,7]:T1期显示黏膜增厚伴强化,并在对应于黏膜下层的病变底部保留了低增强条纹;T2期表现为胃壁增厚,低密度条纹缺失或破坏,但病变周围胃壁外层表面清晰光滑;T3期显示透壁全层增强伴管壁增厚;T4a期表现为病变周围的胃周脂肪增强;T4b期表现为邻近器官或结构增强。ECT评估胃癌N分期标准:胃周淋巴结的短轴直径>6 mm和胃外淋巴结的短轴直径>8 mm时,被认为是淋巴结阳性,其他征象包括圆形及明显或不均匀强化[4,8]。
1.3.3 病理学分析 根据UICC-AJCC(第八版)指南[4],依据病理学检查结果对胃癌患者进行T分期。T定义为原发性肿瘤浸润至胃壁的深度。T0期为切除的样本中没有肿瘤;T1期表现为肿瘤侵袭固有层、黏膜肌层或黏膜下层;T2期表现为肿瘤侵袭固有肌层;T3期表现为肿瘤穿透浆膜下结缔组织,但未侵及内脏腹膜或邻近结构;T4期表现为突出浆膜层或邻近结构的肿瘤浸润[9]。从不同分期患者中各抽取1例,分别汇总、分析各分期患者TGFUS和ECT检查下的特征性征象。

2 结 果
2.1 一般资料 纳入的109例患者年龄为(66.50±11.31)岁(范围为32~90岁)。肿瘤大小为(1.91±0.92) cm(范围1~5 cm)。肿瘤部位:贲门胃底部20例(18.3%)、胃角部28例(25.7%)、胃体部22例(20.2%)、胃窦部36例(33.0%)、幽门部3例(2.8%)。肿瘤大体分型:凹陷型12例(11.0%)、浅表型38例(34.9%)、溃疡型59例(54.1%)。肿瘤分化程度:低分化85例(78.0%)、高分化24例(22.0%)。经消化道内镜下活检获得的病理学分期为T1期20.18%(22/109)、T2期21.10%(23/109)、T3期39.45%(43/109)、T4期19.27%(21/109)。各病理学分期的胃癌在TGFUS上的大部分体表现为低回声区,边界清晰或不清晰,胃壁层次连续性中断,内见或未见点状血流信号,周围见或未见低回声淋巴结,见图1。各病理学分期的胃癌在ECT上大部分表现为胃壁增厚,可见明显强化,边界清晰或不清晰,周围见或未见淋巴结,见图2。

A 女性,63岁,T1期,胃体的凹陷型早期胃癌,低分化腺癌,肿瘤大小为1.3 cm×1.2 cm×0.6 cm,浸润至黏膜下层B 男性,77岁,T2期,胃窦大弯侧腺癌,隆起浸润性,肿瘤大小为2.0 cm×1.5 cm×1.0 cm,浸润至肌层 C 男性,84岁,T3期,贲门胃底低分化腺癌,溃疡型,肿瘤大小为5.5 cm×3.0 cm×0.7 cm,浸润至浆膜下层 D 男性,73岁,T4期胃窦小弯低分化腺癌,溃疡型,肿瘤大小为4.5 cm×4.0 cm×2.5 cm,浸润胃壁全层并突破浆膜

A 女性,63岁,T1期,胃体的凹陷型早期胃癌,低分化腺癌,肿瘤大小为1.3 cm×1.2 cm×0.6 cm,浸润至黏膜下层 B 男性,77岁,T2期,胃窦大弯侧腺癌,隆起浸润性,肿瘤大小为2.0 cm×1.5 cm×1.0 cm,浸润至肌层 C 男性,84岁,T3期,贲门胃底,低分化腺癌,溃疡型,肿瘤大小为5.5 cm×3.0 cm×0.7 cm,浸润至浆膜下层 D 男性,73岁,T4期胃窦小弯低分化腺癌,溃疡型,肿瘤大小为4.5 cm×4.0 cm×2.5 cm,浸润胃壁全层并突破浆膜


表1 TGFUS和ECT评估肿瘤T、N分期准确性的四格表资料
2.3 ECT和TGFUS的胃癌检出率和T、N分期评估准确性 对比病理学结果,ECT和TGFUS在肿瘤手术前对胃癌的检出率分别为86.2%(94/109)、95.4%(104/109),其中22例早期胃癌患者中,TGFUS检测出15例,ECT检测出4例。ECT和TGFUS对术前T分期评估的准确率分别为61.7%(58/94)和70.2%(73/104),其对T1、T2、T3、T4期胃癌评估的准确率分别为18.2%(4/22)和68.2%(15/22),43.5%(10/23)和34.8%(8/23),67.4%(29/43)和81.4%(35/43),71.4%(15/21)和71.4%(15/21)。见表2。

表2 与病理T分期对照的TGFUS和ECT胃癌检出率和T分期评估准确率
对比病理学结果,ECT和TGFUS对术前N分期评估的准确率分别为89.0%(97/109)和77.1%(84/109),ECT对N0、N1、N3期胃癌评估的准确率分别为97.5%(77/79)、11/14和9/10,TGFUS对N0、N2、N3期胃癌评估的准确率分别为97.5%(77/79)、4/6和3/10。见表3。

表3 与病理N分期对照的TGFUS和ECT胃癌检出率和N分期评估准确率
2.4 ECT和TGFUS对pT1~T2期和pT3~T4期胃癌的诊断效能分析 ROC曲线分析显示,ECT和TGFUS在鉴别诊断pT1~T2期和pT3~T4期的准确率、灵敏度、特异度分别为71.24%、87.30%、55.20%和76.37%、87.30%、65.50%,两者的AUC分别为0.771、0.822。见图3。

图3 TGFUS和ECT对鉴别诊断pT1~T2期和pT3~T4期ROC曲线
2.5 ECT和TGFUS对pN0期和pN1~N3期胃癌的诊断效能分析 ROC曲线分析显示,ECT和TGFUS在鉴别诊断pN0期和pN1~N3期的准确率、灵敏度、特异度分别为93.18%、86.20%、96.80%和83.88%、48.30%、96.80%,AUC分别为0.915和0.726。见图4。
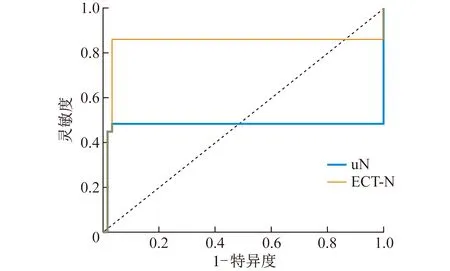
图4 TGFUS和ECT对鉴别诊断pN0期和pN1~N3期的ROC曲线
2.6 ICC分析结果 应用TGFUS的uT评估肿瘤分期的ICC的Kappa值为0.977(95%CI为0.967~0.984)。应用ECT的ECT-T评估肿瘤分期的ICC的Kappa值为0.974(95%CI为0.963~0.982)。应用TGFUS的uN评估肿瘤分期的ICC的Kappa值为0.950(95%CI为0.927~0.965)。应用ECT的ECT-N分期的ICC的Kappa值为0.995(95%CI为0.993~0.997)。
3 讨 论
TGFUS能清晰地显示胃壁5层结构,提供与胃壁的组织学特征和邻近器官有关的超声图像信息,判断肿瘤病变的性质和浸润深度,具有操作简单、便捷、价格低廉、无痛、无放射,以及可动态监测等优势,目前已逐步广泛应用于临床[9]。当患者拒绝或无法耐受消化道内镜检查时,TGFUS亦可作为胃癌的筛查方法。张显迪等[10]的研究结果表明,TGFUS的肿瘤检出率与消化道内镜相近(100.0%比99.2%)。本研究结果表明,TGFUS对肿瘤的总检出率高于ECT(95.4%比86.2%),尤其是对早期胃癌的检出,22例早期胃癌患者中TGFUS检出15例,而ECT仅发现4例。分析其原因可能为超声对胃壁显示分辨率较ECT更高。
本研究首先分析了在不同年龄、性别、肿瘤位置、大小、浸润深度、分型、分期的患者中,分别应用TGFUS和ECT的诊断准确率和误诊率,结果显示当依据TGFUS的uN评估肿瘤分期时,诊断的准确率和误诊率在不同肿瘤分型、不同大小肿瘤间的差异分别具有统计学意义;当依据ECT-N评估肿瘤分期时,诊断的准确率和误诊率在不同患者年龄、不同大小肿瘤间的差异具有统计学意义。但当依据TGFUS的uT和ECT-T评估肿瘤分期时,诊断的准确率和误诊率在上述变量亚组间的差异均无统计学意义。提示患者年龄、肿瘤位置、大小、大体分型和肿瘤病理分型可能对TGFUS和ECT评估患者的胃癌T分期无显著影响。有研究[11]结果表明,浆膜浸润程度等因素对胃癌T分期评估具有重要意义。对于N分期,TGFUS和ECT的诊断准确率和误诊率可能与患者的年龄、肿瘤大小和大体分型相关。分析其原因,肿瘤大小是反映疾病进展的因素,也是评估胃病变良、恶性的关键参数,并且与肿瘤的淋巴结转移相关[12-14]。因此,在评估肿瘤分期时,应重视肿瘤大小对分期的影响。谈及分型时,溃疡型胃癌是胃癌组织学中常见的类型之一,肿瘤表面溃疡可遮挡下方病灶导致超声不易识别,分期不准确。
本研究进一步对TGFUS和ECT评估胃癌分期的效能进行了探讨。在T分期方面,TGFUS评估T分期的准确率高于ECT(AUC为0.822比0.771)。目前,鲜有研究应用TGFUS评估胃癌的浸润层次,因胃腔内含有较多的气体,是超声检查的盲区,但当患者口服足够量的胃充盈造影剂时(500~600 mL),胃腔内的气体被造影剂填充,胃壁被充分扩张,可清晰地显示5层结构。当胃癌浸润胃壁时,胃壁的5层结构被破坏,超声检出的大部分胃癌表现为低回声肿物致胃壁层次结构中断,故TGFUS有助于提高胃癌T分期的准确率。本研究结果表明,TGFUS评估胃癌T1、T2、T3、T4期的准确率分别为68.2%、34.8%、81.4%、71.4%。ECT评估胃癌T1、T2、T3、T4期的准确率分别为18.2%、43.5%、67.4%、71.4%,提示TGFUS评估T1、T3期肿瘤的准确率高于ECT。究其原因,可能是胃癌浸润至胃壁浆膜层和胃周脂肪层时诱发炎症反应,超声上可表现为浆膜层及胃周脂肪层呈高回声,当肿瘤浸润后,回声减低,浆膜层连续性中断[15]。而应用ECT检查时,患者常无法长时间屏住呼吸,图像受到呼吸和胃肠道轻微蠕动的影响,导致胃壁层次显示不清晰,密度差异较小。同时,胃癌可引起胃壁浆膜层及周围脂肪的炎症反应,在ECT中均表现为高密度,因此可能导致过度分期[16-17]。同时,ECT软组织分辨率不如TGFUS,应用的碘造影剂辐射较高[18]。因此,当对胃癌进行T分期时,建议首选TGFUS。TGFUS提高了初诊胃癌和微小病变检测的准确性,为胃癌的诊断提供了较为全面的影像学参考。对于T2期胃癌,虽然TGFUS评估的准确率不如ECT,但当患者无法进行ECT检查时,TGFUS也不失为术前胃癌T分期检查的有效补充手段。
在N分期方面,既往研究[19]发现,由于ECT对直径<5 mm的小病变或转移性病变检出的灵敏度较低,因此误诊率和漏诊率较高,其还可能将淋巴结的炎性肿胀误诊为肿瘤转移灶,继而可能导致成像结果与病理诊断间产生偏差。但本研究结果表明,ECT在诊断胃癌淋巴结转移方面优于TGFUS(AUC为0.915比0.726),这可能与行TGFUS时胃周被周围肠气干扰,致使超声无法探查,导致检查深度有限有关。因此,本研究认为TGFUS和ECT均能够检出胃癌,并对其进行分期。这对于提高术前胃癌临床分期的准确性具有重要意义。TGFUS对于评估和确定胃癌的术前临床分期具有一定的参考价值,且在胃癌的检出和T分期评估中优于ECT,而ECT在评估胃癌N分期中优于TGFUS。两种检查互为补充,为临床医师制订合理的治疗计划提供选择。故ECT和TGFUS可被认为是术前诊断胃癌的有价值的影像学检查方法。但本研究尚存在一定局限,患者群体在不同T分期中分布不均,可能导致结果出现一定的偏倚,在后续研究中本团队将继续扩大样本量,提升结论的可靠性。
综上所述,与ECT比较,TGFUS在胃癌患者病灶检出及术前分期评估中具有一定的优势,尤其是在早期胃癌的检出中,两种影像学检查在胃癌术前诊断中可相互补充。

