烟草镰刀菌根腐病(Fusarium spp.)拮抗菌L210 的鉴定及生防潜力评价
贾方方,许跃奇,阎海涛,何晓冰,李俊营,刘冬梅,王亚月,常 栋*
1. 商丘师范学院生物与食品学院 植物与微生物互作河南省高校重点实验室,河南省商丘市睢阳区文化路298 号 476000
2. 河南省烟草公司平顶山市公司,河南省平顶山市建设路263 号 467000
烟草根腐病在我国烟区普遍发生,危害严重。近年来,随着我国土地集约化程度不断提高,烟田连作更加普遍,根腐病的发生日益严重,甚至呈蔓延趋势[1]。其中,镰刀菌根腐病(Fusarium spp.)是河南烟区的主要根茎类病害,其病原菌检出率52.60%[2]。据报道,其病原菌主要有尖孢镰刀菌(F.oxysporum)、茄病镰刀菌(F. solani)、半裸镰刀菌(F.semitectum)和共享镰刀菌(F. commune)[3],不同地域引起该病害的致病菌存在差异[4-5]。平顶山烟区是河南的传统烟区,该病害在重病烟田的发病率达30%以上,严重影响了烟叶产质量,降低了其工业可用性[4,6]。同时,根腐病的发生会加重黑胫病的发生,进一步扩大损失[7]。当前针对烟草根茎类病害的防治措施主要有采用抗病品种[8-9]、生物防治[10-11]、农业防治[12-13]和化学药剂防治[14-15]等,其中生物防治以其安全、高效、绿色环保等优点,已成为国内外作物病害防治的重要措施。微生物菌株筛选是生物防治的关键环节。赵娟等[16]筛选到可产纤维素酶和几丁质酶的生防链霉菌T22,可有效抑制番茄灰霉病病原真菌菌丝的生长。郝金辉等[17]报道多黏类芽孢杆菌(Paenibacillus polymyxa)JE53 和枯草芽孢杆菌(Bacillus subtilis)JE56 均可产生4 种胞外酶(纤维素酶、几丁质酶、葡聚糖酶和蛋白酶),扫描电镜发现这2 株拮抗菌均可导致病原菌互隔交链孢(Alternaria alternata)菌丝表面粗糙,扭曲变形。罗云艳等[18]从烟草根际土壤中分离的解淀粉芽孢杆菌LY79 对烟草根黑腐病的盆栽防效达71.54%。张蒙蒙等[19]从烟草根际土壤中分离的嗜麦芽寡养单胞菌和贝莱斯芽孢杆菌可抑制烟草疫霉菌生长,对烟草黑胫病的防效分别达50.5%和61.5%。原晨虹等[20]研究发现地衣芽孢杆菌BL-24 可有效防治烟草炭疽病,其发酵液对烟草炭疽病的田间防效达56.28%,与药剂50%多菌灵WP的防效相当。我国首次报道烟草镰刀菌根腐病是在20 世纪90 年代末[21],相比烟草黑胫病、根黑腐病和青枯病等根茎类病害[22-23],该病的研究历史短,化学特效药剂和抗性烟草品种较为缺乏,针对以Fusarium spp.为病原的镰刀菌根腐病拮抗微生物的研究也鲜见报道。为此,以平顶山烟区烟草根腐病的发病烟株及根际土壤为材料,从中分离出烟草根腐病的病原菌并鉴定,确定引起平顶山烟草根腐病的致病菌;从发病烟田的健康烟株根际土壤中筛选烟草镰刀菌根腐病的拮抗菌,测定其生防潜力,并探讨其拮抗机理及传代培养稳定性,旨在为丰富烟草镰刀菌根腐病的生防菌种资源,开发镰刀菌根腐病生防菌剂提供依据。
1 材料与方法
1.1 病原菌的分离鉴定
烟草镰刀菌根腐病(Fusarium spp.)病原菌尖孢镰刀菌(Fusarium oxysporum)于2021 年分离自河南省平顶山市烟草根腐病发生烟田,由商丘师范学院植物与微生物互作河南省高校重点实验室分离、纯化、保存、鉴定并提供。
1.2 拮抗菌株的分离、筛选和鉴定
菌株分离:分别选取平顶山烟区镰刀菌根腐病发病较重地块的健康烟株,采集5~10 cm深的根际土壤10份,每份1 000 g。参照Niemann的稀释涂布平板法,将待测土壤除杂过筛(0.420 mm)后,称取5 g加到100 mL 三角瓶中,用无菌水定容至50 mL,于28 ℃恒温振荡培养箱中,200 r/min振荡1 h,使待测土样充分稀释均匀。静止沉淀后,取上清液1 mL梯度稀释至10-1~10-6倍,吸取各梯度溶液200 μL,用灭菌的涂布器均匀涂布在NA 培养基上,37 ℃恒温培养48 h,以无菌水为空白对照,3 次重复。挑取生长性状不同的单菌落,多次平板培养和纯化,直到获得纯化的单菌落,甘油保存。
菌株筛选:采用平板对峙法,用直径1 cm 的打孔器将病原菌接种到培养基的中间,采用三点法在距平板中央2 cm等距离接种不同的土壤分离菌,以不接种分离菌为对照,于30 ℃恒温培养箱中培养5 d,每处理3 次重复,待对照菌落长至接近培养皿边缘时,测量烟草镰刀菌根腐病病原菌菌落直径和抑菌圈直径。计算公式:
菌株鉴定:将分离纯化菌株L210 置于LB 培养基上,于25 ℃培养,待分离菌丝长成菌落,用解剖针挑取少量菌丝置于载玻片上,加入几滴无菌水,盖上盖玻片制成临时装片,于显微镜(DM2500,德国徕卡显微系统有限公司)下观察菌丝及分生孢子形态;参照文献[24-25]的方法对菌株进行生理生化测定,16S rDNA序列分析[26],对L210菌株进行种属鉴定。
1.3 扫描电镜样品的制备
制备L210 细胞悬液(1×105cfu/mL),将粗提物溶于磷酸缓冲液(pH值7.2)配制质量浓度为50 μg/mL的粗提液。取5 μL细胞悬浮液置于载玻片,用5 μL的50 μg/mL 的粗提液处理,对照用磷酸缓冲液(pH值7.2)处理,均为24 h。将载玻片用2.5%戊二醛4 ℃固定过夜,磷酸缓冲液漂洗3 次,然后用30%、50%、70%、90%的乙醇逐级脱水1次,100%乙醇脱水2 次,每次20 min,再用乙酸异戊酯置换100%乙醇2次,每次20 min,临界点干燥后喷金,用扫描电子显微镜(SU8010,日本日立公司)观察菌体细胞[27]。
1.4 L210菌株代谢产物的测定
分别收集L210 菌株发酵液的上清液(全菌液经12 000 r/min离心5 min,取上清液过滤)与菌体细胞破碎液T3(收集100 mL全菌液,4 ℃,6 500 r/min,离心10 min,弃上清液,加5 mL 50 mmol/L pH 值7.5 KH2PO4-K2HPO4缓冲溶液,超声破碎)。再分别使用纤维素酶活性检测试剂盒(YX-SH-TQ22025,上海原鑫生物科技有限公司)测定纤维素酶含量,几丁质酶活性检测试剂盒(YX-W-B917,上海原鑫生物科技有限公司)检测几丁质酶含量。
1.5 L210菌株发酵液对烟叶防御酶活性诱导试验
采用盆栽试验,在烟苗移栽后30 d 分别接种L210 发酵液原液(1.0×108cfu/mL)、10 倍(1.0×109cfu/mL)、100 倍(1.0×1010cfu/mL)发酵液10 mL,以清水处理为对照(CK),各处理设置10次重复。接种后第0、3、6、9天取第3片叶,采用邻苯二酚法测定多酚氧化酶(PPO)活性[28],愈创木酚法测定过氧化物酶(POD)活性[29],苯丙氨酸解氨酶(PAL)活性测定参考文献[30]的方法。
1.6 拮抗菌株对盆栽和田间烟草尖孢镰刀菌根腐病的防效测定
盆栽试验共设5 个处理。空白对照(CK):只接种病原菌。旺泰宝处理:旺泰宝(上海大井生物工程有限公司,有效菌种哈茨木霉菌,生防菌剂对照)药液浓度为1%,每株烟浇灌65 mL。碧苗处理:碧苗(山东鲁抗海柏尔生物技术有限公司,有效菌种枯草芽孢杆菌,生防菌剂对照)稀释1 000倍后,每株烟灌根65 mL。甲霜锰锌处理:使用58%甲霜·代锰锌可湿性粉剂(江苏宝灵化工股份有限公司,甲霜灵含量10%,代森锰锌含量48%,化学药剂对照)稀释600倍,每株灌根20 mL。L210处理:将扩繁培养的L210菌株稀释,制成发酵液(细胞浓度1.0×108cfu/mL),采用灌根法每盆灌根20 mL。各烟株首次施用菌剂或农药7 d后灌根接种尖孢镰刀菌发酵液20 mL,此后每7 d灌根1次,共灌根3次。每处理8株,各处理重复3 次,接种烟草尖孢镰刀菌发酵液14 d 后开始调查发病情况。供试烟草品种为中烟100。
大田复筛试验在平顶山市白龙庙村进行,设置除CK为自然发病外,其余处理同盆栽一致。每处理50 株,重复3 次。烟株于2021 年5 月1 日移栽,还苗后按照盆栽试验的10倍体积用量施用各处理,每隔15 d 灌根施用,共灌根3 次,于最后一次灌根后15 d开始调查发病情况。按照优质烟叶生产技术规范进行田间管理。参照标准GB/T 23222—2008[31]和GB/T 23224—2008[32]方法进行烟草根腐病病情指数分级,并略做修改。计算公式:
1.7 数据处理
采用SPSS 13.0 软件对数据进行方差分析,采用Duncan’s法进行数据间差异的显著性检验。
2 结果与分析
2.1 拮抗菌株的分离与筛选
从烟草的根际土壤中共分离土壤微生物512株,对尖孢镰刀菌(Fusarium oxysporum)具有拮抗作用的共33 株,筛出率为6.44%。其中,以L210 对镰刀菌根腐病抑制效果最好,菌株在平板对峙培养中产生了清晰的抑菌圈,抑菌直径达71.4 mm,病原菌的菌丝稀疏,边缘受到抑制和溶解,抑菌率为68.2%,见图1。
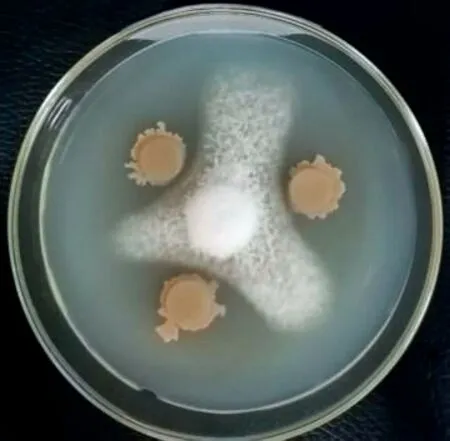
图1 菌株L210对尖孢镰刀菌的平板对峙培养Fig.1 Plate confrontation culture of strain L210 against Fusarium oxysporum
2.2 菌株的种类鉴定
2.2.1 菌株的形态与生理生化特征
菌株L210经72 h培养后,进行显微观察和扫描电镜观察,结果显示该菌菌体呈直杆状,菌落丝状,呈不透明的乳白色,表面干燥、褶皱、小而突起,边缘呈锯齿状,菌体直径0.5~0.8 μm,长0.9~2.0 μm,端圆,无芽孢,有荚膜和鞭毛,能运动(图2)。其生理生化特征见表1。该菌株为革兰氏阴性菌,甲基红试验、V-P试验、赖氨酸脱羧酶试验、葡萄糖产气试验等结果均为阳性;发酵葡萄糖产酸,可利用柠檬酸盐和苹果酸;苯丙氨酸脱氨酶试验、过氧化氢酶活性试验、尿素酶活性试验、氧化酶活性试验、精氨酸双水解酶活性试验、卫矛醇产酸试验、乳糖产酸试验、D-阿东醇产酸试验、L-阿拉伯糖试验等结果均为阴性,不可利用丙二酸。与参考文献[24-25]进行比对,其生理生化特性与液化沙雷氏菌一致,可初步鉴定为液化沙雷氏菌(Serratia liquefaciens)。

表1 L210菌株的生理生化特性①Tab.1 Physiological and biochemical characteristics of strain L210

图2 菌株L210电镜下的孢子形态Fig.2 Spore morphology of strain L210 under electron microscope
2.2.2 菌株的16S rDNA扩增及序列分析
以菌株L210 的基因组DNA 为模板(引物序列:27f:5'-AGAG TTTG ATCC TGGC TCAG-3';1492r:5'-GGTT ACCT TGTT ACGA CTT-3'),PCR 扩增后经电泳检测,得到1条约为1 kb的特异性条带。PCR产物经测序显示:扩增序列长度为993 bp。同源性分析结果表明,L210 为肠杆菌科、沙雷氏菌属(Serratia)(图3)。

图3 菌株L210的16S rDNA系统进化树Fig.3 16S rDNA phylogenetic tree of strain L210
2.3 菌株的拮抗机理分析
2.3.1 病原菌的扫描电镜观察
利用扫描电镜分别对病原菌尖孢镰刀菌和经L210 拮抗菌发酵液处理过的病原菌进行观察,从图4中可见,对照组的菌丝表面致密光滑,形状饱满、均匀。经L210菌株发酵液处理后,烟草镰刀菌根腐病病原菌菌丝的生长发育明显受到抑制,菌丝表面萎缩凹陷干瘪、粗糙不平整,菌丝扭曲变形,细胞质浓缩,部分菌丝壁溃解,最终失去侵染能力。
2.3.2 拮抗菌株的代谢产物分析
在L210 菌株的发酵上清液以及细胞粗提物中均检测到了几丁质酶和纤维素酶(表2),且均表现为上清液中的含量显著高于细胞粗提物中的含量,表明该菌株能产生几丁质酶和纤维素酶,具有分解几丁质和纤维素的能力。

表2 菌株L210的几丁质酶和纤维素酶含量①②Tab.2 Contents of chitinase and cellulose in strain L210(U·mL-1)
2.3.3 拮抗菌发酵液对烟苗防御酶活性的诱导
PPO、POD 和PAL 是3 种极为重要的防御酶,与植物的抗(耐)病性密切相关[33]。由图5可见,不同处理间烟叶内几种防御酶活性变化规律整体上一致。随着处理时间的延长,PAL 和POD 表现为先升后降的趋势,在接种后第6 天达到活性高峰,然后下降;PPO则表现为接种后0 d至3 d波动下降,而后明显升高,同样在第6 天达到活性高峰后再下降。同对照相比,接种了L210菌株发酵液原液、10 倍浓度发酵液(1.0×109cfu/mL)、和100倍浓度发酵液(1.0×1010cfu/mL)均可提高3种防御酶活性,在接种后6 d和9 d,3种酶活性均显著提高。其中,CK 的PAL 活性在第9天达到酶活高峰,接种发酵液后使酶活高峰提前。不同浓度发酵液对烟草3种防御酶活性的影响除了接种后第9 天PAL 和POD 活性以100 倍浓度最高外,其余整体表现为10倍浓度发酵液诱导下烟叶内防御酶活性最高。
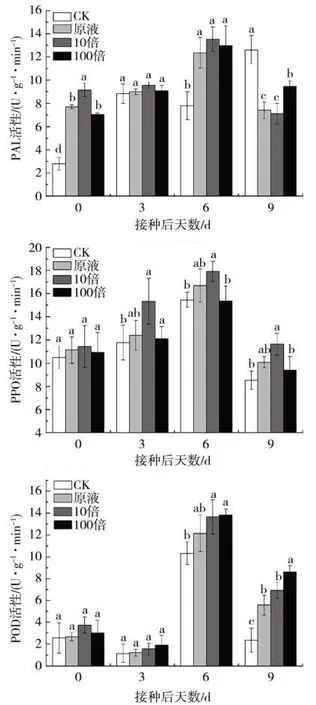
图5 L210菌株不同浓度发酵液对烟叶PPO、POD和PAL酶活性的影响Fig.5 Effect of L210 strain fermentation at different concentrations on activities of PPO, POD and PAL in tobacco leaves
2.4 菌株对盆栽与大田病害的防效
由表3可见,CK处理发病率为100%,旺泰宝、碧苗、甲霜锰锌和L210处理烟草镰刀菌根腐病的发病率分别为85.7%、100%、71.4%和0;盆栽试验病情指数仍以CK 最高(89.3),碧苗、旺泰宝、甲霜锰锌和L210 各处理病情指数分别为75.0、78.6、42.9 和0;各处理盆栽试验相对防效分别为16.0%、11.9%、51.9%和100%。以L210 处理的相对防效最高(100%),无发病烟株。
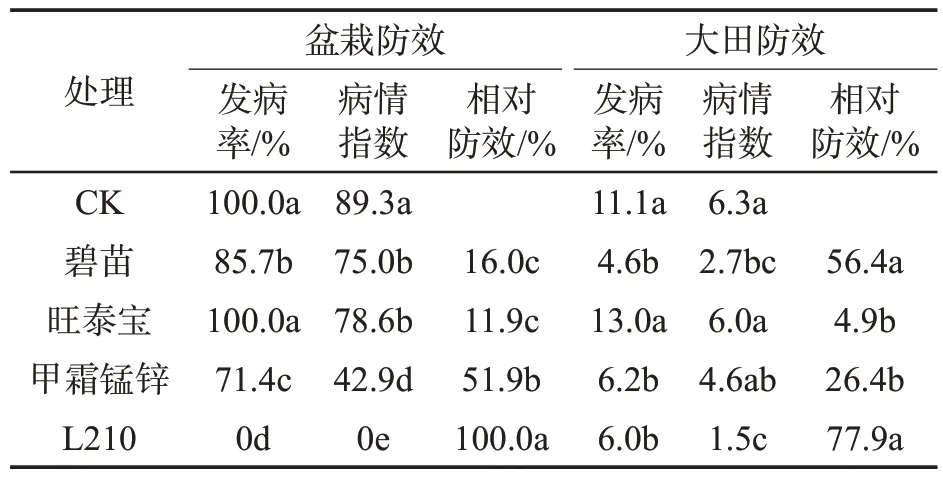
表3 菌株L210对盆栽及大田病害的防效①Tab.3 Control effects of strain L210 in pot and field experiments
大田复筛试验中以自然发病的处理CK 的发病率最高(11.1%),碧苗、旺泰宝、甲霜锰锌和L210 各处理的发病率分别为4.6%、13.0%、6.2%和6.0%;病情指数分别达6.3、2.7、6.0、4.6 和1.5;各处理均有一定的防治效果,相对防效以L210最佳(77.9%),其次为微生物菌剂碧苗处理(56.4%)。
3 讨论
镰刀菌根腐病的主要致病菌为尖孢镰刀菌(Fusarium oxysporum)和茄病镰刀菌(Fusarium solani)[8],各生态区域的主要致病菌种类型不同[4-5]。本研究中明确了平顶山市烟草根腐病的病原菌为尖孢镰刀菌(Fusarium oxysporum),该致病菌寄主范围广,能侵染多种作物,既可单独侵染,亦可与烟草疫霉菌、根结线虫混合侵染,造成烟株死亡[34]。
本研究中从烟株根际土壤中分离了1 株对尖孢镰刀菌拮抗作用较好的菌株L210,经鉴定为液化沙雷氏菌(Serratia liquefaciens)。沙雷氏菌属菌株广泛分布于自然界,是土壤、植物中的常居菌群,其次生代谢产物灵菌红素(Prodigiosin,PG)可穿过细胞膜,直接抑制靶酶,诱导细胞产生自溶素,使细胞发生程序性死亡,在植物病虫害防治方面具有巨大的应用前景和研发价值[35-36]。
诱导抗性被认为是生物防治作物病害的主要机制之一,植物抗性相关防御酶如PPO、POD和PAL活性均可用来衡量和鉴定植物的抗病性,其主导着生物的新陈代谢、能量转换等催化过程,与生命活动密切相关。PPO和PAL是苯丙烷类代谢途径中的关键酶和限速酶,可直接调控酚酸形成,抑制磷酸化酶、转氨酶、果胶酶等的合成,进而防止病原菌繁殖扩散;POD 是植物体内主要的活性氧清除剂,还能通过保护酶蛋白和木质素的合成来抵抗病原菌的入侵[37]。前人研究表明,这3 种酶与玉米对大斑病的抗性关系非常密切[38]。本研究中接种生防菌株L210的烟苗,其PPO、POD和PAL等防御酶活性的变化幅度均高于只浇灌清水的处理,尤其以接种10倍发酵液的活性最高,且在接种后6 d提前达到防御酶活性高峰,表明接种拮抗菌可诱导烟株抗性相关酶的表达,从而有效提高烟株对烟草根腐病的抗性。
病原真菌尖孢镰刀菌的细胞壁以几丁质、纤维素为骨架,故生防细菌可通过产生几丁质酶、纤维素酶等胞外水解酶溶解病原真菌细胞壁,造成其菌丝崩解[39]。本研究中筛选的液化沙雷氏菌(Serratia liquefaciens)L210,其发酵液和细胞粗提物中均含有几丁质酶和纤维素酶,推测拮抗菌株L210通过产生几丁质酶和纤维素酶等抗菌物质,改变或降解致病菌细胞壁,使细胞发生应激反应,细胞的渗透压平衡遭到破坏,从而达到抑菌目的。扫描电镜观察显示,经与L210共培养后,尖孢镰刀菌(Fusarium oxysporum)菌丝畸变,细胞质浓缩,部分菌丝壁溃解,进一步说明拮抗菌L210可作用于真菌细胞壁,通过产生几丁质酶、纤维素酶等活性物质来破坏细胞壁结构,然而其抑菌作用机理还需进一步的研究。
4 结论
①从平顶山烟区烟草根腐病发病地块儿采集成熟期发病烟株,经分离、纯化和分子鉴定,确定平顶山市烟草根腐病的病原菌为尖孢镰刀菌(Fusarium oxysporum)。②从烟草根际土壤中分离、筛选出尖孢镰刀菌的高效拮抗菌L210,通过形态学、生理生化特征、16S rRNA 初步将其鉴定为肠杆菌科,沙雷氏菌属的液化沙雷氏菌(Serratia liquefaciens)。③盆栽和大田复筛试验表明,该菌株L210可有效降低烟草尖孢镰刀菌根腐病的发病率和病情指数,相对防效较好(100%和77.9%)。④在L210 的发酵液和组织破碎液中均检测到了几丁质酶和纤维素酶,以发酵液中含量相对较高。L210菌株发酵液可溶解病原真菌的细胞壁,抑制菌丝的生长发育,使其干瘪扭曲,进而失去侵染能力;同时,L210菌株的发酵液可显著诱导提高烟苗中PPO、POD和PAL等防御酶的活性,在接种后第6 天达到活性高峰,其中以孢子浓度1.0×109cfu/mL的效果最佳。因此,该菌株可以提高烟苗抗病能力,具有较好的生防潜力。

