不同悬钩子属植物ITS序列的多态性分析
高 柱,郭芙蓉,杨静远,汪 琪
(1.安徽国科检测科技有限公司,安徽合肥 230041;2.安徽农业大学生命科学学院,安徽合肥 230036)
悬钩子属(Rubus)为蔷薇科(Rosaceae)蔷薇亚科(Rosoideae)中的一个属,落叶稀常绿灌木、半灌木或匍匐草本,多年生宿根植物。据统计,该属植物目前已发现700余种,分布于全世界,主要产地在北半球温带,少数分布到热带和南半球,我国有204种104变种[1]。悬钩子植物在我国西南地区,特别是四川、广东、广西、福建及云南等[2]地区有较多分布,占目前全国总悬钩子属植物种数的60%以上。多数悬钩子属植物的果实、种子、根及叶可入药,具有驱寒祛湿、止血止痛、清热解毒、活血化瘀及固肾涩精等功效[3];有些种类的果实多浆,味甜酸,可供食用[4]。
悬钩子属植物种类繁多[5],植物分类学家对其分类进行了大量研究工作,但不同学者在悬钩子属植物的范围划分和亚属的分类方面有不同见解。1979年刘金[6]将悬钩子属植物分为实心莓亚属、刺毛莓亚属、空心莓亚属、大花莓亚属和软枝莓亚属5个亚属。俞德浚等[7-9]以悬钩子属植物主要器官性状特征及细胞学资料为依据,将已发现的194种悬钩子属植物分为8组24亚组,其中,空心莓组(Sect.Idaeobatus)和木莓组(Sect.Malachobatu)植物包含种类较多。空心莓组(Sect.Idaeobatus)植物又分为11个亚组,共83种50个变种;木莓组(Sect.Malachobatu)植物又分为13个亚组,85种35个变种。亚组之间的分类主要依据该植物的叶型、花序及叶片性状等生物学特征[10]。近年来,我国植物学工作者在各国家和地区又陆续发现许多新种,如腺果悬钩子(R.glandulosocarpus)、武夷悬钩子(R.jiangxiensis)、铅山悬钩子(R.yanshanensis)、少花悬钩子(R.spananthus)和九仙莓(R.yanyunii),补充并完善了我国悬钩子属植物的分类系统[11-14]。
悬钩子属植物因其种类繁多,变异性大,类型复杂,而且存在无融合生殖现象,并伴有多倍体出现,仅依据外部形态特征进行分类比较困难。笔者利用DNA条形码技术,探索悬钩子属植物ITS序列的特征,揭示其系统进化关系,为悬钩子属植物的分类鉴定提供科学依据。
1 材料与方法
1.1 材料用于ITS分析的13份悬钩子属核心种质资源分别采集自安徽、贵州、浙江、广西、江西和湖南,定植于安徽农业大学国家高新技术农业园,种质信息见表1。

表1 不同悬钩子属种质资源所属种类与产地
1.2 悬钩子属植物DNA的提取研钵、枪头、离心管等器材均经高温灭菌处理,利用植物DNA提取试剂盒(艾德莱生物公司,北京)提取悬钩子属植物的基因组DNA,具体操作参照试剂盒说明书。检测合成DNA样品于-20 ℃保存备用。
1.3 悬钩子属植物ITS序列的克隆克隆ITS序列所用的PCR引物分别为ITS-F:GGAAGGAGAAGTCGTAACAAGG、ITS-R:CTTTTCCTCCGCTTATTGATATG,引物委托公司合成。PCR反应体系参照2×TaqMaster Mix说明书(擎科生物科技有限公司,南京)。反应程序为98 ℃预变性3 min,变性10 s;55 ℃复性10 s;72 ℃延伸10 s,35个循环;72 ℃延伸2 min。胶回收采用MiniBEST Agarose Gel DNA Extraction Kit试剂盒(宝生物工程有限公司,大连),胶回收产物委托公司测序。
1.4 悬钩子属植物ITS序列的生物信息学分析采用基于隐马尔科夫模型的注释方法(http://its2.bioapps.biozentrum.uni-wuerzburg.de/),去除测序序列的5.8S和ITS1序列,获得ITS2间隔区序列。利用NCBI网站BLAST工具,对ITS2序列进行比对检验。
利用DNAMAN软件对5.8S、ITS1和ITS2序列进行比对;利用BioEdit 7.0软件对ITS2序列单个碱基进行分析;利用MEGA7软件对ITS2序列进行分析,利用邻接法(Neighbor Jioning,NJ)构建系统发育树。构建ITS2系统进化树的近缘植物的相关序列见表2。

表2 蔷薇科近缘植物的ITS2序列
2 结果与分析
2.1 悬钩子属植物基因组DNA的ITS序列克隆及鉴定选取不同悬钩子属种质资源13份,开展基因组DNA的ITS克隆和分析。以不同供试材料DNA为模板,进行了ITS序列的PCR扩增,将克隆的产物进行琼脂糖凝胶回收检测,结果见图1。由图1可知,核心种质资源均获得单一的PCR条带,条带大小约500 bp。

注:1~13.A9、A29、S、GH14、JF9、HH2、GB3、TW1、GA1、W5、B1-1、B2-1、B3-1。图1 13份悬钩子属种质资源ITS序列的琼脂糖凝胶电泳图Fig.1 Agarose gel electrophoresis of ITS sequences of thirteen germplasm resources in the genus Rubus
对供试材料PCR产物进行纯化回收,对测序结果进行5.8S、ITS1和ITS2序列分析(表3)。结果显示,13份悬钩子属种质资源ITS区域的长度在462~464 bp。ITS1的序列长度在208~210 bp,GC含量为55.29%~58.17%;ITS2的序列长度在254~255 bp,GC含量为53.73%~55.12%;13份悬钩子属种质资源的5.8S序列相对保守,长度均为164 bp,GC含量为54.27%或54.88%。
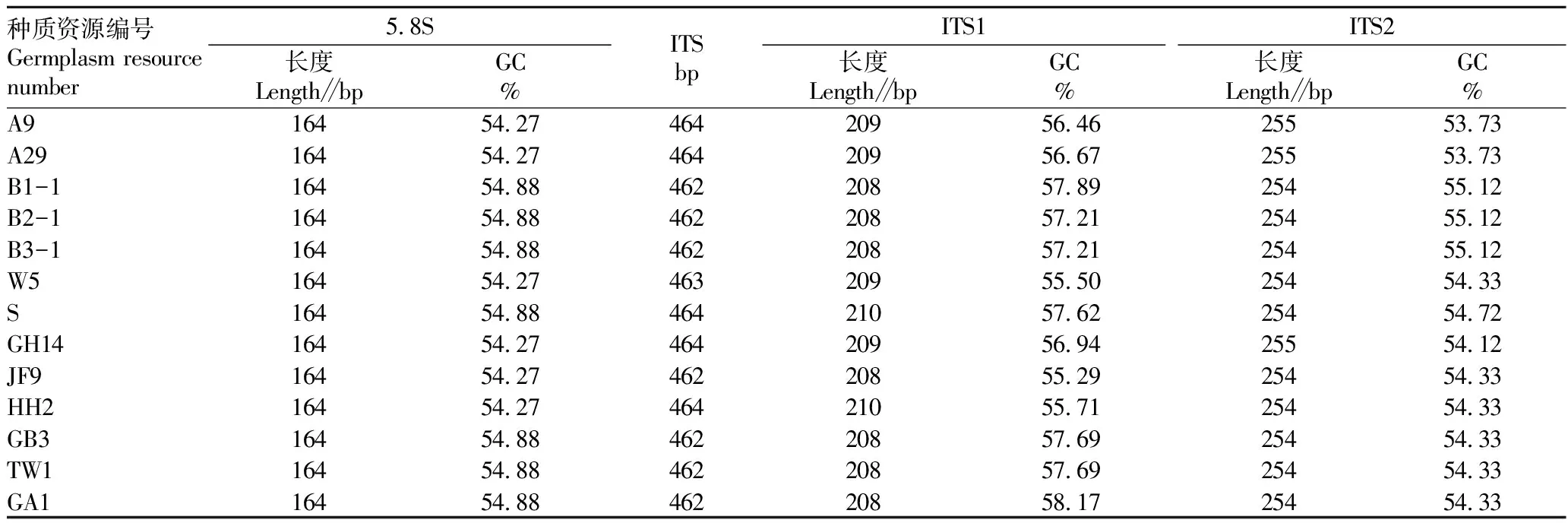
表3 13份悬钩子属种质资源ITS序列的长度及GC含量
2.2 悬钩子属植物5.8S序列用DNAMAN软件对ITS序列的5.8S区域进行分析,结果表明,悬钩子属植物的5.8S序列是高度保守的一个变异位点(124位的碱基A变成G)。其中,A9、A29、W5、GH14、JF9、HH2的5.8S区域序列一致为TAAACGACTCTCGGCAACGGATATCTCGGCTCTCGCATCGA-TGAAGAACGTAGCGAAATGCGATACTTGGTGTGAATTGCAG-AATCCCGTGAACCATCGAGTCTTTGAACGCAAGTTGCGCCC-AAAGCCATTAGGCCGAGGGCACGCCTGCCTGGGCGTCACAC;B1-1、B2-1、B3-1、S、GB3、TW1、GA1的序列一致为TAAACGACTCTCGGCAACGGATATCTCGGCTCTCGCATCGATGAAG-AACGTAGCGAAATGCGATACTTGGTGTGAATTGCAGAATCC-CGTGAACCATCGAGTCTTTGAACGCAAGTTGCGCCCGAAG-CCATTAGGCCGAGGGCACGCCTGCCTGGGCGTCACAC。
2.3 悬钩子属植物ITS2序列利用BioEdit 7.0和DNAMAN软件对悬钩子属植物的ITS2序列进行比对和差异分析(图2)。结果显示,13份悬钩子属种质资源的ITS2序列变异较大,存在碱基缺失的现象。其中JF9、GB3和TW1在+14 bp处存在1个碱基缺失,B1-1、B2-1和B3-1在+86 bp处存在1个碱基缺失。另外,除了A29、B1-1、S和HH2之外,其余种质资源在+123 bp处均存在1个碱基缺失。ITS2含有223个保守位点,32个信息位点,其中变异位点18个,单个核苷酸差异位点14个。

图2 13份悬钩子属种质资源ITS2序列比对Fig.2 Comparison of ITS2 sequences among thirteen germplasm resources in Rubus
2.4 悬钩子属植物ITS2序列系统发育用MEGA7对13份悬钩子属种质资源的ITS2序列进行Kimura 2-parameter遗传距离分析。并利用相关植物的ITS2序列作为内参,构建NJ系统发育进化树。由图3可知,供试的悬钩子属植物与草莓亲缘关系较近(70%的自展支持率),与苹果、梨和拟南芥分属不同的进化支。不同悬钩子植物可以分为4个亚簇。其中,簇Ⅰ由空心莓组的掌叶覆盆子A9、A29 和甜叶悬钩子GH14 3个种质资源组成,簇Ⅱ由空心莓组的山莓HH2、JF9和W5 3个种质资源组成,簇Ⅲ由悬钩子组的欧洲木莓B1-1、B2-1和B3-1 3个种质资源组成,簇Ⅳ由空心莓组的插田泡GA1、S、GB3和TW1 4个种质资源组成,分别获得87%、85%、96%、58%的自展支持率。

图3 基于ITS2序列构建的悬钩子属植物及常见植物的系统发育树Fig.3 Phylogenetic tree of plants in Rubus and common plants based on ITS2 sequences
通过对4种标准外缘序列进行比对,发现不同悬钩子植物ITS2序列在16~18和181~183位点上存在碱基差异,其他位置序列相对保守。由图4可知,掌叶覆盆子、山莓、欧洲木莓和插田泡的16~18位碱基分别为AAC、AAT、AAA和AAC,其181~183位碱基分别为CGA、CGA、CAA和TGA。因此,不同悬钩子ITS序列的16~18位、181~183碱基可作为悬钩子属植物分类的候选差异位点。由进化关系可知,GH14与掌叶覆盆子为同缘植物,在16~18位点上与掌叶覆盆子一致,但在181~183位点上由掌叶覆盆子的CGA变成了CGG,推测GH14可能是掌叶覆盆子与另一种悬钩子属植物的杂交或变异后代。遵循相同的判断依据,A29在16~18上与掌叶覆盆子一致,在124~126位点上与掌叶覆盆子不一致,而与HH2一样,HH2为山莓,推测A29可能为掌叶覆盆子与山莓的杂交后代。

图4 悬钩子属植物ITS2区域的物种鉴定Fig.4 Identification of species in the ITS2 region of plants in the Rubus
3 讨论
分子标记技术分为很多种,如RAPD标记、SCAR标记、DNA序列分析、特殊基因引物的PCR等技术,每种技术的用途不同。DNA分子标记技术与形态学标记、细胞学标记和蛋白质标记等传统的标记技术相比,具有其独特性和优越性,因为它不会受到季节、环境等条件的限制,在植物发育的不同时期,均可便捷地获得DNA样本[15]。另外,分子标记技术能够鉴别出目标DNA的基因型是否为杂交,也可为任何植物提供较为完整的遗传信息[16]。因此,DNA分子标记技术在悬钩子属植物种间种内鉴定中具有较广的应用前景,可提高悬钩子品种选育的效率。
ITS序列共包含3个部分,分别是ITS1、5.8S和ITS2,其中5.8S序列保守,ITS2应用最为广泛,特别适用于植物种属之间的系统发育分析。Chen等[17]对6 000余份样本进行测序分析,指出序列中ITS2的分辨率高达92.7%;若以属为基础,ITS2的分辨率甚至可达到99.8%。我国传统中药材由于长期贮藏引起材料中DNA部分降解,ITS2具有较高的PCR扩增和测序效率,性能稳定,广泛应用于多个科属植物及药材的鉴定中[18-19]。例如,以ITS2为基础,针对药用植物DNA条形码鉴定的方法也被2010版和2015版的《中国药典》纳入[20]。对于药用植物中,利用ITS分析可应用于药材真伪品的鉴定上,构建药材的DNA指纹图谱[21]。例如,用来自全国26个不同地方的牛蒡和4个伪品为材料,ITS序列可准确将牛蒡和伪品区别开[22]。
悬钩子属植物资源丰富,进化历程相对复杂,在进化中经历了广泛的杂交[23]、多倍化[24]和基因渐渗[25]等。因此,悬钩子属植物种间区分和进化关系亟待深入研究。笔者在13份悬钩子属种质资源基因组DNA提取的基础上,开展了其ITS序列克隆、测序和鉴定。研究发现,不同悬钩子属植物5.8S区域的序列相对保守,仅有一个兼并碱基(14位A变为G)差异。不同悬钩子属种质资源的ITS2序列差异较大,具有区别不同品系的潜在优势。NJ进化树分析表明,13份悬钩子属种质资源与同为蔷薇科的草莓亲缘关系较近,分为掌叶覆盆子组、山莓组、欧洲木莓组和插田泡组4个亚簇。针对不同亚族间ITS2序列差异碱基,挖掘到ITS2序列在16~18和181~183位点存在种间差异,可作为候选位点区分不同亚族的品系。基于以上特点,该研究鉴定的ITS2序列作为属中种间的物种鉴别是可行的。该研究的供试种质资源包括悬钩子属栽培品种及课题组收集的地方种质资源,对其ITS序列进行了克隆和分析,为今后研究该属植物的遗传多样性和系统发育奠定了基础。

