加工及干燥方式对短小蛇根草活性成分的影响
肖程雨,李朋洋,郝小龙,开国银
(1. 浙江农林大学 食品与健康学院,浙江 杭州 311300;2. 浙江中医药大学 药学院,浙江 杭州 311300)
短小蛇根草Ophiorrhizapumila为茜草科Rubiaceae 蛇根草属Ophiorrhiza植物,主要分布在福建、台湾、海南、广东、广西等省,全草可入药,具有清热解毒的功效,民间使用广泛[1-2]。喜树碱是短小蛇根草中重要的一类活性成分,具有显著的抗肿瘤活性,近几十年来以其为前体开发的抗癌药物众多,如伊立替康、拓扑替康等[3-5]。药用植物短小蛇根草,对生长环境条件要求严苛,常为森林被破坏后第一批被消灭的植物,脆弱的野生资源导致其无法作为喜树碱的替代药源植物进行利用[6]。近年来,随着短小蛇根草栽培技术研究的逐步展开,水培型短小蛇根草可以很好地适应温室生长,并且生长速度快、喜树碱产量高,这使得短小蛇根草在未来有可能成为重要的喜树碱药源补充植物[7-10]。
《本草蒙筌》中记载:“凡药藏贮,宜常提防。倘阴干、暴干、烘干未尽其湿,则蛀蚀霉垢朽烂不免为殃”[11]。干燥是决定药材质量的一个关键环节,不同的干燥方法对药材的生产效率、活性成分含量都有显著影响[12]。有研究指出,喜树碱类成分在自然光和高温条件下具有不稳定性,在喜树果的干燥工艺研究上发现,相较于阴干或低温干燥,暴晒和高温都会导致喜树果中喜树碱含量降低[13-14]。由此可见,干燥方式对喜树碱类植物有效成分含量的影响较大,适宜的加工及干燥方法将有助于短小蛇根草中喜树碱类成分的保留。另有研究发现,蛇根草属植物中的化学成分复杂,除喜树碱类化合物外,还包括黄酮类化合物、多糖类化合物等,药理研究也表明黄酮类化合物及多糖类化合物具有广泛的药理活性[15]。
为更好地推进短小蛇根草在喜树碱产业上的开发与应用,本研究以活性成分含量为指标对短小蛇根草的加工方法(杀青)及干燥方式(晒干、阴干、烘干、真空冷冻干燥、真空干燥)进行了考察,探究加工及干燥方式对短小蛇根草品质的影响,为短小蛇根草未来的产业化利用提供一定的参考依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料 本实验所采用的短小蛇根草全草采收于福建省建瓯市。本材料为野生品,生长于深山林下,2022年9 月中旬采收,正值果期,全草长在10 ~ 15 cm,生长状态相似。
1.1.2 实验仪器 高效液相色谱仪(Agilent 1260 Infinity II,安捷伦);高速中药粉碎机(LG-30,百信);超声波清洗器(DS-5510DTH,工作频率40 kHz,上超);分析天平(ME204,瑞士梅特勒多利多公司);真空冷冻干燥机(SCIENTZ-50FG/C,宁波新芝);真空干燥机(HWZ-5B,天水华圆制药设备科技有限公司);电热鼓风干燥箱(9030A,南京科迪信机械设备有限公司);多功能酶标仪(Synergy H1,美国伯腾)。
1.1.3 实验试剂 甲醇(分析纯,广东光华科技股份有限公司);甲醇(色谱纯,美国TEDIA 试剂公司);乙腈(色谱纯,美国TEDIA 试剂公司);喜树碱标准品(纯度≥98%,上海源叶生物科技有限公司);芦丁标准品(纯度≥98.00%,上海源叶生物科技有限公司);D(+)-无水葡萄糖(纯度≥99.00%,上海源叶生物科技有限公司)。
1.2 实验方法
1.2.1 样品制备 将当日采收的新鲜短小蛇根草均分为30 份,每份50 g,分别采用杀青后干燥和直接干燥的加工方法;干燥方式采用晒干、阴干、烘干、真空冷冻干燥、真空干燥5 种,每组处理做3 次重复。杀青处理及5 种干燥方式的具体参数如下:杀青处理[16]采用煮青的方式;晒干方式,将需要晒干的样品在晴朗的天气下晒至恒质量,温度变化范围为27 ~ 30 ℃,空气相对湿度变化范围为84% ~ 89%,每6 h 测定一次质量;阴干方式,将需要阴干的样品放置在通风、避光的室内进行干燥,室温恒定为25 ℃,每24 h 测定一次质量;烘干方式,将需要烘干的样品置于电热鼓风干燥箱中,60 ℃烘干,每0.5 h 测定一次质量;冷冻干燥方式,将需要冷冻干燥的样品置于真空冷冻干燥机样品室中,在冷阱温度-60℃、真空度200 Pa 条件下冻干,每2 h 测定一次质量;真空干燥方式,将需要真空干燥的样品置于真空干燥箱中,在干燥温度25 ℃、真空度0.01 Mpa 条件下真空干燥,每1 h 测定一次质量。每组处理干燥至恒质量后,进行复水性测定、含水量测定,样品粉碎后混匀过60 目筛用于活性成分的提取及检测。
喜树碱标准溶液的制备:准确称取10.0 mg 喜树碱,用少量DMSO 溶解后,用甲醇定容至20 mL,配制成0.5 mg·mL-1的喜树碱标准溶液。分别吸取0、0.2、0.4、1 .0、2.0、4.0、6.0、8.0 mL 喜树碱标准溶液于10 mL容量瓶中,用甲醇定容至刻度,用于标准曲线的绘制。短小蛇根草喜树碱供试液的制备:准确称取各样品50 mg于离心管中,加入1 mL 甲醇,超声(功率40 kHz)提取60 min,12 000 r·min-1离心5 min,取上清液过0.22 μm滤膜得短小蛇根草喜树碱提取液。
芦丁标准溶液的制备:准确称取20.0 mg 芦丁,用60%乙醇溶解后定容至20 mL,配置成1 mg·mL-1芦丁标准溶液。分别吸取0、0.2、0.4、0.6、0.8、1.0、2.0 mL 芦丁标准溶液于10 mL 比色管中,用60%乙醇溶液补至5.0 mL,加入0.3 mL 5%亚硝酸钠溶液,摇匀放置6 min,加入0.3 mL 10%硝酸铝溶液,摇匀后放置6 min,加入4 mL 4%氢氧化钠溶液,用60%乙醇定容至刻度,摇匀静置15 min,以试剂为空白参比液,在510 波长处测定吸光度,绘制芦丁的标准曲线。短小蛇根草总黄酮供试液的制备:准确称取各样品100 mg 于离心管中,加入1 mL 80%的甲醇,避光超声(功率40 kHz)提取60 min,8 000 r·min-1离心30 min,取上清液得短小蛇根草总黄酮提取液。
葡萄糖标准溶液的制备:准确称取20.0 mg 葡萄糖,用水溶解后定容至20 mL,配置成1 mg·mL-1葡萄糖标准溶液。分别吸取0、0.5、1.0、2.0、3.0、4.0、5.0 mL 的葡萄糖标准溶液于10 mL 容量瓶中,用超纯水定容至刻度,摇匀,备用,各取1 mL 于试管中,加入5%苯酚溶液0.50 mL,摇匀,加入浓硫酸5 mL,振荡混匀3 min后,立即置于水浴锅内沸水浴2 min,取出冷却至室温,以试剂为空白参比液,在490 nm 波长处测定吸光度,绘制葡萄糖标准曲线。短小蛇根草粗多糖供试液的制备:准确称取各样品100 mg 于离心管中,加入2 mL 超纯水摇晃混匀,超声(功率40 kHz)提取60 min,8 000 r·min-1离心10 min,取上清液,加入8 mL 95%乙醇,4 ℃醇沉过夜,8 000 r·min-1离心30 min,弃上清,沉淀加入1 mL 超纯水溶解得短小蛇根草粗多糖溶液,取0.1 mL于10 mL 容量瓶中,用超纯水定容至10 mL 用于粗多糖含量测定。
1.2.2 干基含水率的测定 干基含水率(Mt)的计算公式[17]为:
式中,mt为物料在t时刻的质量,单位为g;mg为物料干物质的质量,单位为g。
1.2.3 复水性的测定 取干燥后的短小蛇根草样品,加入60 ℃超纯水200 mL,恒温浸泡30 min,取出沥水5 min后称质量,复水性(X)的计算公式[18]为:
式中,N0为物料的干质量,单位为g;N为物料复水后的质量,单位为g。
1.2.4 含水率的测定 根据GB/T 5009.3—2016 食品中水分含量的测定标准,含水率(Y)的计算公式为:
式中,M为容器和样品的质量,单位为g;M1为恒质量后容器和干燥样品的质量,单位为g;M0为容器的质量,单位为g。
1.2.5 喜树碱含量的测定 采用高效液相色谱法测定短小蛇根草中的喜树碱含量。色谱条件为:Agilent ZORBAX SB-C18 反相硅胶柱色谱柱(4.6×250 mm,5 μm);流动性为乙腈(A):1‰甲酸水(B),梯度洗脱(0 ~ 25 min,30% A,70% B ;25 ~ 29 min,30% ~ 90% A,70% ~ 10% B;29 ~ 30 min,90% ~ 30% A,10%~ 70% B;30 ~ 31 min,30% A,70% B);体积流量为1.0 mL·min-1,进样量10 μL,柱温30 ℃,检测波长210 nm。以液相检测得到的峰面积值为纵坐标,喜树碱浓度为横坐标建立标准曲线,y= 59 714.122 18x+439.751 06(R2= 0.999 45),检测范围(0.01 ~ 0.40 mg·mL-1)。取0.2 mg·mL-1喜树碱标准溶液,在上述色谱条件下,连续进样6 次,得喜树碱峰面积RSD(n= 6)为0.25%,表明该方法实验精密度良好;取晒干短小蛇根草粉末6份,按照1.2.1 短小蛇根草喜树碱供试液的制备方法制备并检测,得到短小蛇根草喜树碱峰面积RSD(n=6)为2.35%,表明该方法实验重复性良好;取0.2 mg·mL-1的喜树碱标准溶液,在上述色谱条件下,分别于0、2、4、8、12、24 h 时进样,得喜树碱峰面积RSD(n=6)为0.65%,表明该方法实验稳定性良好。取上述晒干短小蛇根草喜树碱提取液,分别加入等量0.2 mg·mL-1喜树碱标准溶液,测得喜树碱的平均回收率为100.45%,表明该方法加样回收率良好。取一定量的短小蛇根草喜树碱提取液进行液相检测,将得到的峰面积代入标准曲线中,计算样品中喜树碱的含量。
1.2.6 总黄酮含量的测定 采用亚硝酸钠-硝酸铝法测定短小蛇根草中的总黄酮含量[19]。以芦丁浓度为横坐标,510 nm 波长处测得吸光度值为纵坐标建立标准曲线:y= 739.42x-1.4813,(R2= 0.999 6),检测范围在(0.02 ~0.20 mg·mL-1)。取一定量的短小蛇根草总黄酮提取液,按同样方法处理并测定其吸光度,将得到的吸光度代入标准曲线中,计算样品中的总黄酮含量,以芦丁当量表示。
1.2.7 粗多糖含量测定 采用苯酚-硫酸法测定短小蛇根草中的粗多糖含量[20]。以葡萄糖浓度为横坐标,490 nm波长处测得吸光度值为纵坐标建立标准曲线:y= 8.807 1x+ 0.000 5(R2= 0.999 8),检测范围在(0.05 ~ 0.50 mg·mL-1)。取一定量的短小蛇根草粗多糖提取液,按同样方法处理并测定其吸光度,将得到的吸光度代入标准曲线中,计算样品中的粗多糖含量,以葡萄糖当量表示。
2 结果与分析
2.1 不同干燥方式下短小蛇根草的干燥曲线及不同干燥品的复水性
如图1 所示,不同干燥方式下,短小蛇根草的干燥过程均呈现为降速干燥,其中以烘干干燥速率最快。晒干、阴干、烘干、冷冻干燥、真空干燥至恒质量所需时间分别为12.0、96.0、3.5、13.0、10.0 h,各干燥品的含水率分别为6.3%、11.3%、7.0%、5.7%、7.7%,均符合安全储存水分含量。短小蛇根草长期生长在潮湿的环境中,植物体含水量较高(约84%),但总体来看,除阴干外,其余干燥方式干燥所需时间均较短,表明在生产过程中,应以保留活性成分的多少来决定选择何种干燥方式。不同干燥品复水性的结果如图2所示,阴干组与真空冷冻干燥组在复水性上存在显著性差异(P<0.05),原因为冷冻干燥过程水分以冰晶升华的方式挥发,致使样品疏松多孔,宜于吸水,而阴干过程植物体表面因脱水而缓慢收缩,导致组织结构紧密,不利于水分的渗入。

图1 不同干燥方式下短小蛇根草的干燥曲线Fig. 1 Moisture content of O. pumila treated by different drying methods

图2 不同干燥方式下短小蛇根草复水性测定Fig. 2 Rehydration capacity of O. pumila treated by different drying methods
2.2 杀青及不同干燥方式对短小蛇根草中喜树碱含量的影响
杀青及不同干燥方式对短小蛇根草中喜树碱含量的影响如图3 所示。由图3 可知,在5 种干燥方式中,晒干组喜树碱含量最高(1.90 mg·g-1),并且显著高于其他处理组(P<0.05);阴干、烘干、冷冻干燥组喜树碱含量次之(1.78 mg·g-1),且三者之间无显著差异(P>0.05);真空干燥组喜树碱含量最低(1.63 mg·g-1),并显著低于其他处理组(P<0.05)。可以看出,暴晒对短小蛇根草喜树碱含量的影响小于其他干燥处理,而真空干燥处理对其喜树碱含量的影响要比干燥温度及干燥时间更大。杀青处理后不同干燥方式下(晒干、阴干、烘干、冷冻干燥、真空干燥)短小蛇根草喜树碱含量比不杀青的不同干燥方式处理的喜树碱含量分别降低了45.17%、0.59%、22.57%、8.62%、15.72%,除阴干组外,其余各组喜树碱含量均显著降低(P<0.05),其中以杀青-晒干组降低幅度最大,在所有处理组中含量最低(1.04 mg·g-1),这与未杀青处理组结果截然相反,表明杀青处理对短小蛇根草中喜树碱类成分在自然光下的稳定性产生了影响,杀青后喜树碱类成分在自然光下的稳定性变低,这与阴干组杀青处理前后喜树碱含量变化不显著的结果相吻合。以上结果表明,在5 种干燥方式中,晒干是短小蛇根草保留喜树碱的最佳干燥方式;杀青处理对短小蛇根草喜树碱类成分影响较大,若干燥前采取杀青处理,以阴干作为短小蛇根草杀青后的最佳干燥方式。
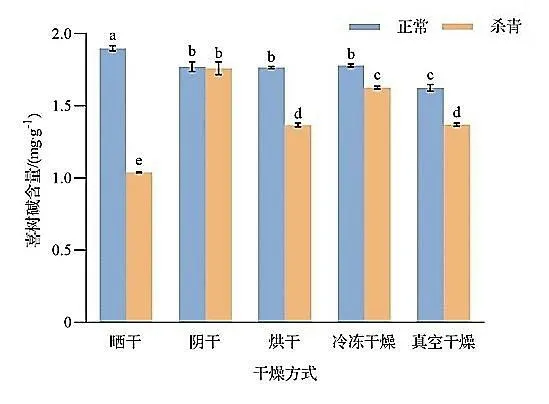
图3 杀青及不同干燥方式对短小蛇根草中喜树碱含量的影响Fig. 3 Effects of de-enzyme and different drying methods on camptothecin content
2.3 杀青及不同干燥方式对短小蛇根草中总黄酮含量的影响
杀青及不同干燥方式对短小蛇根草中总黄酮含量的影响如图4 所示。由图4 可知,在5 种干燥方式中,真空干燥组短小蛇根草中总黄酮含量最高 (1.38 mg·g-1),并且显著高于其他处理组(P<0.05);烘干组(0.87 mg·g-1)和阴干组(1.02 mg·g-1)短小蛇根草中总黄酮含量显著低于其他各组(P<0.05)。说明干燥温度和干燥时间对短小蛇根草中黄酮类化合物的含量影响较大,以高温的影响最大。杀青处理后,各干燥组短小蛇根草中总黄酮含量均显著提高(P<0.05),晒干、阴干、烘干、冷冻干燥、真空干燥处理短小蛇根草中黄酮类化合物的含量分别比不杀青干燥处理提高了6.89%、24.67%、29.36%、18.24%、7.87%,其中杀青-烘干组提高幅度最大,但总含量仍为各组中最低(1.23 mg·g-1),说明杀青后高温仍是影响短小蛇根草总黄酮含量的主要因素,这与杀青-冷冻干燥组总黄酮含量最高(1.63 mg·g-1)的结果相一致。杀青处理以快速高温的方式实现了“杀酶保苷”的效果,减少了黄酮类成分在后续加工过程中的分解。以上结果表明,杀青后冷冻干燥是保留短小蛇根草总黄酮的最佳加工及干燥方式。

图4 杀青及不同干燥方式对短小蛇根草中总黄酮含量的影响Fig. 4 Effects of de-enzyme and different drying methods on total flavonoids content
2.4 杀青及不同干燥方式对短小蛇根草中粗多糖含量的影响
杀青及干燥方式对短小蛇根草中粗多糖含量的影响如图5 所示。由图5 可知,在5 种干燥方式中,冷冻干燥组短小蛇根草中粗多糖含量最高(50.01 mg·g-1),且显著高于其他各干燥处理组(P<0.05);阴干组(46.17 mg·g-1)次之,显著高于晒干组(41.95 mg·g-1)、烘干组(41.12 mg·g-1)和真空干燥(P<0.05);真空干燥组含量最低(37.89 mg·g-1),且显著低于其他各干燥处理组(P<0.05)。以上结果表明,高温和真空处理均会影响短小蛇根草中粗多糖的含量,低温有助于短小蛇根草中粗多糖的保留。杀青处理后,不同干燥方式下(晒干、阴干、烘干、冷冻干燥、真空干燥)短小蛇根草中粗多糖含量分别降低了26.68%、6.86%、0.03%、8.14%、15.65%,以晒干组降低幅度最大,在各组中含量最低(30.76 mg·g-1),烘干组杀青前后变化不显著(P>0.05)。各干燥处理结果表明,温度是影响干燥过程中短小蛇根草粗多糖含量变化的主要原因,然而与烘干组相比,杀青-晒干组粗多糖含量降低幅度更大,这与喜树碱在杀青-晒干组的结果相一致,表明短小蛇根草中喜树碱与粗多糖在杀青过程中的变化可能存在着相关性。综上所述,低温干燥是提高短小蛇根草中粗多糖含量的最佳干燥方式。

图5 杀青及干燥方式对短小蛇根草中粗多糖含量的影响Fig. 5 Effects of de-enzyme and different drying methods on crude polysaccharides content
3 结论与讨论
短小蛇根草是一种药用价值极高的珍稀民间草药,在福建省建瓯地区会使用其晒干的全草进行煮制后用于治疗发热咳嗽。现代药理研究也表明,短小蛇根草乙醇提取物在抑制肝癌细胞的增殖、迁移,抑制淋巴瘤细胞的增殖、促进淋巴瘤细胞的凋亡方面有着显著作用[21-22]。作为拥有丰富药用历史经验的国家,短小蛇根草资源的开发不仅在喜树碱产业上具有重要的意义,在活性成分的挖掘、新药的研发方面也存在着巨大的价值。
随着短小蛇根草栽培技术的不断完善,短小蛇根草作为抗癌药物喜树碱的补充药源植物,将在喜树碱产业上得到充足的发展。药用植物采收后的加工及干燥在其生产过程中发挥着重要作用,不同的加工方式及干燥方法对药材的生产效率、活性成分含量都有显著的影响。基于本实验研究结果发现,短小蛇根草具有易于干燥的特性,这对于产地加工是较为有利的。喜树碱作为短小蛇根草中重要的活性成分,具有不稳定性,有研究表明,闭环(E 环)喜树碱具有对自然光稳定、热不稳定、紫外光不稳定的特性[13],并且闭环(E 环)的内酯结构是决定喜树碱抗癌活性的关键。通过比较不同干燥方式下短小蛇根草中喜树碱含量的差异,发现晒干是最适合保留喜树碱的干燥方式(1.90 mg·g-1),表明短小蛇根草中的喜树碱类成分对自然光的稳定性较好,这与喜树Camptothecaacuminata果暴晒后的结果不同,可能是由于短小蛇根草中的喜树碱类成分与喜树果中的喜树碱类成分存在差异,如查包甙仅存在于短小蛇根草中而不存在于喜树果中。杀青处理会导致除阴干外其余各组干燥方式下的喜树碱含量显著降低(P<0.05),其中以杀青-晒干组喜树碱含量的降低幅度最大(45.17%),在所有处理组中含量最低(1.04 mg·g-1),这与晒干组的结果相反,说明杀青处理可能导致了短小蛇根草喜树碱类成分发生了改变,对自然光的稳定性变低,这也与阴干组杀青前后喜树碱含量变化不显著相一致,若干燥前需采取杀青处理,以阴干作为短小蛇根草杀青后的最佳干燥方式(1.76 mg·g-1)。
短小蛇根草中总黄酮含量在烘干组(0.87 mg·g-1)、阴干组(1.02 mg·g-1)中的含量显著低于其他各组,表明干燥温度和干燥时间是影响短小蛇根草总黄酮含量变化的主要因素,这与姜珊等的研究结果相一致,干燥温度越高、干燥时间越长,黄酮类成分的损失越大[23]。在中药类及茶饮类领域,杀青是比较常用的一种加工方法,在亳菊Dendranthemamorifolium的加工干燥过程中,杀青后烘干会比直接烘干苯丙素类和黄酮类成分含量更高[24];青钱柳Cyclocaryapaliurus茶在微波杀青后可显著提高多糖和黄酮等活性成分的含量[25]。同样,杀青处理也可显著提高不同干燥方式下短小蛇根草中总黄酮的含量(P<0.05),其中以杀青-冷冻干燥组总黄酮含量最高(1.63 mg·g-1),是保留短小蛇根草总黄酮含量的最佳加工及干燥方式。
短小蛇根草粗多糖在冷冻干燥组(50.01 mg·g-1)、阴干组(46.17 mg·g-1)中的含量显著高于晒干组(41.95 mg·g-1)、烘干组(41.12 mg·g-1)和真空干燥组(37.89 mg·g-1)(P<0.05),表明温度是导致短小蛇根草中粗多糖含量变化的主要原因,这与川芎Ligusticumsinense多糖及火龙果Hylocereusundatus茎多糖理化特性的研究结果相一致,冷冻真空干燥是获取高品质、高含量多糖的最佳干燥方法,李振丰等的研究结果也表明高温会破坏多糖的结构,从而导致多糖含量的降低[26-28]。杀青处理会导致除烘干外其余各组干燥方式下短小蛇根草中粗多糖含量显著降低(P<0.05),其中以杀青-晒干组降低幅度最大(26.68%),在各组中含量最低(30.76 mg·g-1),这与喜树碱的杀青-晒干组结果存在一致性,表明短小蛇根草中喜树碱与粗多糖在杀青过程中的变化可能存在着一定的联系,低温干燥是短小蛇根草粗多糖的最佳干燥方式(50.01 mg·g-1)。
杀青处理及不同干燥方式对短小蛇根草的活性成分影响较大,喜树碱在晒干后含量最高,总黄酮和粗多糖在冷冻干燥后含量最高,杀青会导致喜树碱含量普遍降低、总黄酮含量显著提高、粗多糖含量普遍降低。在实际生产中,以晒干作为短小蛇根草的首选干燥方式,若遇阴雨天气,以冷冻真空干燥作为短小蛇根草的最佳干燥方式,干燥前不宜采取杀青处理。

