生物质炭和石灰氮削弱温室土壤镰刀菌与真菌群落关联度
邱虎森,刘杰云,张文正,吕谋超,王钰
生物质炭和石灰氮削弱温室土壤镰刀菌与真菌群落关联度
邱虎森2,刘杰云2,张文正1*,吕谋超1,王钰2
(1.中国农业科学院 农田灌溉研究所,河南 新乡 453002;2.宿州学院 环境与测绘工程学院,安徽 宿州 234000)
【目的】了解不同农艺措施对温室土壤真菌多样性及土壤真菌与镰刀菌菌群的相互关系的影响,探寻设施农业土壤质量提升的绿色改良措施。【方法】通过培养试验研究了单施或混合施入生物质炭和石灰氮对土壤理化、真菌群落结构和镰刀菌属丰度差异及关系。【结果】与对照相比,单施生物质炭显著提高了土壤pH值和速效钾(0.05);单施石灰氮有利于土壤pH值、铵态氮和硝态氮的提高(0.05);生物质炭和石灰氮混合施入显著提高土壤pH值、电导率、铵态氮、硝态氮量和速效钾量(0.05)。与对照相比,单施生物质炭或生物质炭与石灰氮的混合施入均显著降低土壤真菌群落香农多样性指数(0.05)。各处理真菌群落优势菌门相对丰度差异不显著。生物质炭与石灰氮混合施入后土壤镰刀菌属的相对丰度显著低于对照(0.05)。土壤镰刀菌属真菌多样性与土壤电导率、铵态氮量、真菌群落香农多样性指数均呈显著正相关(0.05)。基于网络分析结果表明,与对照相比,单施或混施生物质炭和石灰氮均能降低镰刀菌群与真菌菌群关系的复杂性。【结论】生物质炭与石灰氮的混合施入增强了镰刀菌菌群与真菌菌群的竞争关系,是一种有利于缓解温室土壤病害的较好措施。
温室;生物质炭;石灰氮;镰刀菌属;真菌群落多样性
0 引言
目前,以温室、大棚为代表的设施农业在蔬菜栽培中的作用显著。但长期相对封闭和单一的种植模式导致土壤病原菌数量增加。其中,镰刀菌属是许多植物-土壤系统的重要组成部分,某些镰刀菌能侵染多种粮食和经济作物,导致作物根腐、茎腐和穗(粒)腐等病害的发生[1-2]。【研究意义】传统的化学农药能抑制病原菌生长,同时也使病原菌产生抗药性,并灭杀了大量有益菌群,导致土壤生物区系多样性失调和群落结构的失衡,从而加重作物土传病害[3-4];另外,化学农药残留也会影响到土壤健康和农产品安全[5]。因此,探寻设施农业土壤质量提升的绿色改良措施成为目前的研究方向。
【研究进展】生物质炭作为一种由生物质原料在无氧或缺氧条件下高温裂解产生的固体产物,由于其较大的比表面积、丰富的孔隙结构和较强的吸附能力,被认为是一种新型的土壤改良剂[6]。相关研究发现,生物质炭可以改善土壤孔隙结构,提高土壤保水保肥及养分固定能力,为土壤微生物提供丰富的养分和能量来源,从而增强土壤微生物活性,提高作物的抗病能力[7-9]。另外,生物质炭可以调控土壤有机酸和氨基酸的分布,提高微生物对羧酸类和聚合物类碳源的利用能力,改善土壤微生态条件,促进如木霉菌、青霉菌等有益微生物生长,从而抑制病原菌增长[10-11]。Akanmu等[12]发现,生物质炭的添加可以降低由土壤镰刀菌引起的玉米穗腐病发生。然而,生物质炭在植物病害管理方面的前景还没有得到充分的探索。
石灰氮作为一种传统的氮肥增效剂,对土传病害的防治也具有显著作用。Bourbos等[13]的研究发现,石灰氮的施入可以有效控制温室土壤镰刀菌(Fusarium)的致病能力;石灰氮用量的增加与其对尖孢镰刀菌的抑制效果呈正比[14]。石灰氮的添加使土壤微生物群落中出现了有益于土壤控制病原菌的特征带,能够调节优化土壤微生物群落功能[15]。此外,马军伟等[16]的研究发现,石灰氮添加明显减少了土壤中真菌的数量,却显著提高了土壤真菌的多样性和丰富度[17]。虽然,生物质炭和石灰氮对设施土壤病害具有一定的抑制作用。【切入点】生物质炭和石灰氮施入引起土壤生物和非生物因素改变及其对镰刀菌属的影响尚不明确。
【拟解决的关键问题】本研究利用高通量测序技术和网络关系构建的方法,研究了高温闷棚条件下,不同农艺措施(生物质炭或石灰氮的施入)如何通过调控土壤微环境和真菌群落结构而影响土壤镰刀菌属,该研究将为合理选择改善温室土壤环境的农艺措施提供理论支撑。
1 材料与方法
1.1 试验设计
试验在中国农业科学院新乡综合试验基地日光温室内开展,土壤质地为壤土。在辣椒(品种为新查理皇,连续种植2 a)收获后,高温闷棚前,选择同一块样地打入直径10 cm,高40 cm的PVC管材,在PVC管内开展培养试验。试验共设置4个处理,每个处理设置3个重复,分别为:对照、单施生物质炭(施入量生物质炭/干土为10 g/kg)、单施石灰氮(施入量石灰氮/干土为0.3 g/kg)和施入生物质炭+石灰氮(施入量(生物质炭+石灰氮)/干土为(10+0.3)g/kg)。生物质炭产自河南商丘三利新能源有限责任公司,为花生壳在500 ℃左右条件下制成。为保证土壤的均一性,将PVC管中耕层0~20 cm土壤全部挖出,记录土质量,并计算所有PVC管中0~20 cm土壤质量均值;之后将所有挖出土壤全部过2 mm筛,并混合均匀。按照0~20 cm土壤质量均值混入生物质炭或石灰氮,回填到PVC管中压实。所有处理灌水量为100%田间持水率,然后用塑料薄膜将PVC管口密封15 d,同时封闭大棚,实现棚内高温。供试土壤(0~20 cm)与生物质炭基本理化性质如表1所示。

表1 供试土壤(0~20 cm)及生物质炭基本理化性质
1.2 样品采集与测定
1.2.1 样品采集
在闷棚结束后,采集各处理0~20 cm土壤样品,去除土壤中可见动植物残体,然后按照四分法取一部分经过液氮速冻处理后,保存在-80 ℃冰箱,用于真菌拷贝数PCR和群落多样性分析。一部分新鲜土样用于测定土壤含水率、铵态氮量和硝态氮量,剩余土壤样品风干后测定相关理化指标。
1.2.2 样品测定
采用Fast DNA®SPIN试剂盒(Qbiogene Inc.,USA)提取土壤总DNA,DNA浓度和纯度利用NanoDrop2000进行检测,利用1%琼脂糖凝胶电泳检测DNA提取质量。在设计测序引物时,在序列中添加bar-code序列以区分各个样品测序数据。用ITS1F(5'-CTTGGTCATTTAGAGGAAGTAA-3')和ITS2R(5'-GCTGCGTTCTTCATCGATGC-3')引物进行PCR扩增,扩增程序为:95 ℃预变性5 min,35个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min)。扩增体系为20 μL,10 μL 2× Taq Plus Master Mix,0.8 μL引物(5 μmol/L),1μL DNA模板,7.4 μL ddH2O。使用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extraction Kit(Axygen Biosciences, Union City,CA,USA)进行纯化,Tris-HCl洗脱,2%琼脂糖电泳检测。利用QuantiFluor™-ST(Promega,USA)进行检测定量。根据定量结果和测序量要求,取PCR产物构建测序文库。构建好的文库在Illumina MiSeq PE300测序平台测序。真菌基因实时定量PCR扩增条件为:95 ℃预变性3 min,95 ℃ 5 s,55 ℃ 30 s,72 ℃ 1 min,40个循环(PCR仪:ABI GeneAmp® 9700型)。
基于土壤农化分析方法[18],称取新鲜土样,按照水土比5∶1,采用2 mol/L KCl浸提,连续流动分析仪(Tecator FIA Star 5000 Analyzer,Foss Tecator,Sweden)测定铵态氮量和硝态氮量。土壤含水率采用105 ℃烘干法测定。土壤pH值按照水土比2.5∶1混匀静置30 min后采用Metro-pH320测定上清液。土壤电导率按照水土比5∶1震荡3 min,静置澄清后取上清液,用雷磁DDSJ-308A型电导仪测定。速效磷采用0.5 mol/L NaHCO3浸提,钼锑抗比色法。速效钾采用1 mol/L NH4OAc浸提,火焰光度法。
1.3 数据分析
数据统计在Excel 2007中完成,香农多样性的计算在QIME 1.80中完成。基于SPSS 16.0配对检验研究处理间土壤理化性质、基因拷贝数、香浓多样性和相对丰度差异。基于mantel test分析环境因子及真菌多样性与镰刀菌属菌群的相关性;基于Pearson相关性分析(相关系数>0.6,<0.05)确定OTU水平镰刀菌属与各门类真菌正负关系,并基于Cytoscape 3.8.0构建可视化微生物生态关系网络。基于Origin 8.5作柱形图。
2 结果与分析
2.1 不同处理土壤理化性质分析
研究发现(表2),与对照相比,生物质炭和石灰氮的添加并未影响土壤含水率和速效磷量(0.05),却显著提高土壤pH值(0.05)。与对照相比,添加生物质炭显著提高了土壤速效钾量,却显著降低了硝态氮量(0.05);添加石灰氮显著提高了土壤铵态氮量和硝态氮量(0.05);生物质炭和石灰氮混合施入显著提高土壤电导率、铵态氮量、硝态氮量和速效钾量(0.05)。对比发现,添加生物质炭对提高速效钾的影响显著,添加石灰氮有利于铵态氮和硝态氮的提高。
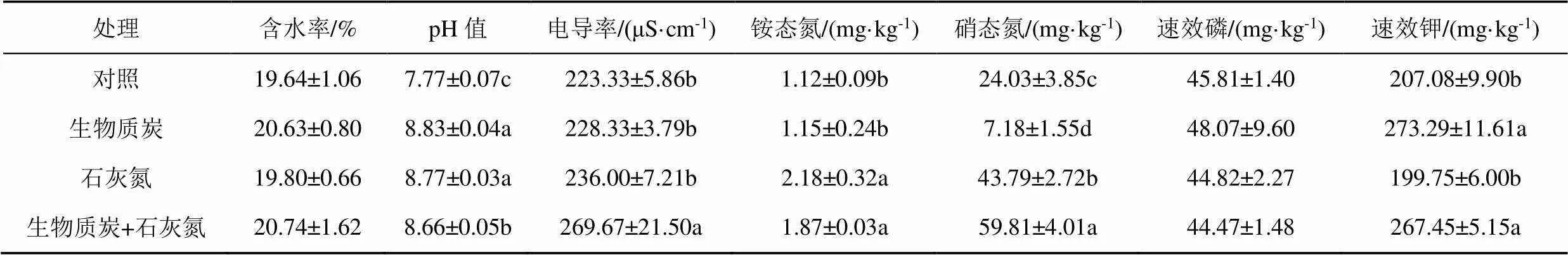
表2 不同处理土壤理化指标差异
注 表中不同字母表示各指标在<0.05水平下处理间差异显著。
2.2 不同处理间土壤真菌及镰刀菌属分析
由图1(a)(图中*表示处理间在<0.05水平差异显著,下同)可知,与对照相比,添加生物质炭显著提高土壤真菌拷贝数,却显著降低了土壤真菌群落香农多样性(0.05);单施石灰氮或生物质炭与石灰氮的混合施入对土壤真菌拷贝数的影响均不显著,但生物质炭与石灰氮的混合施入显著降低了土壤真菌群落香农多样性(图1(b),0.05)。各处理真菌群落在门类水平上相对丰度>1%的优势类群均包括子囊菌门(p__Ascomycota)、待定真菌(p__unclassified_k__Fungi)、担子菌门(p__Basidiomycota)和被孢霉门(p__Mortierellomycota)。在属的分类水平上,各处理优势属主要包括隶属于子囊菌门的枝顶孢属(g__Acremonium)、毛壳菌科(g__unclassified_f__Chaetomiaceae)、粪壳菌纲(g__unclassified_c__Sordariomycetes)、镰刀菌属(g__Fusarium)、金孢属(Chrysosporium)、g__unclassified_p__Ascomycota、g__Myceliophthora、裸囊菌科(g__unclassified_f__Gymnoascaceae)、粪盘菌科(g__unclassified_f__Ascobolaceae)和g__Cyberlindnera等优势类群;隶属于担子菌门的伞菌属(g__unclassified_c__Agaricomycetes);隶属于被孢霉门(P_Mortierellomycota)的被孢霉属(g__Mortierella)和隶属于P__unclassified_k__Fungi的g__unclassified_k__Fungi(图1(c))。组间差异分析结果发现(图2),与对照相比,生物质炭与石灰氮的混合施入显著降低镰刀菌属的相对丰度(0.05)。

图1 处理间真菌拷贝数和群落结构的差异
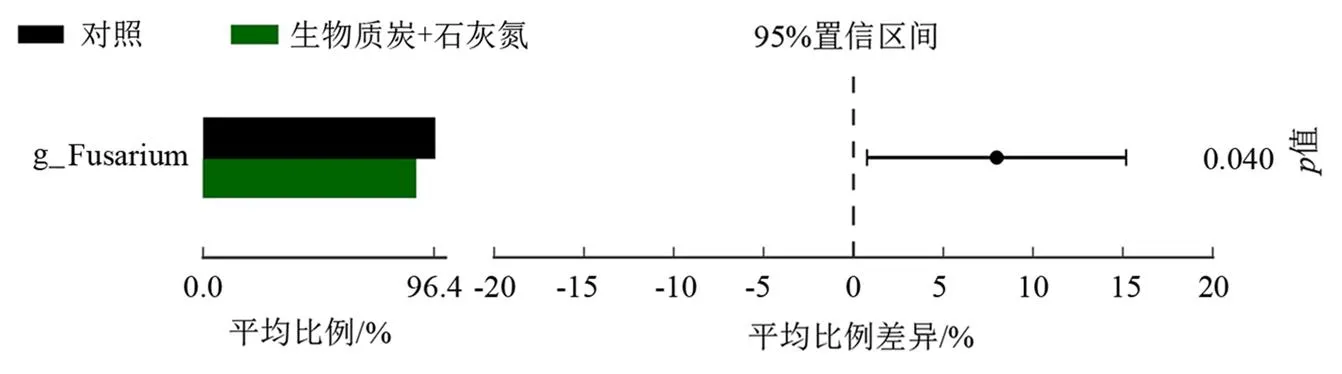
图2 不同处理镰刀菌属相对丰度的差异
2.3 环境因子及真菌群落对镰刀菌属的影响
曼特尔-亨塞尔检验的结果发现(表3),土壤镰刀菌群与土壤电导率、铵态氮量均呈显著正相关(0.05),同时与真菌群落多样性呈显著正相关。基于单因素相关性网络分析的结果发现(图3),与对照相比,单施生物质炭或石灰氮降低了镰刀菌属OTU与真菌OTU正负连接数量,并削弱了镰刀菌菌群与真菌之间的负相关关系比例;而生物质炭与石灰氮混合施入降低镰刀菌属OTU与真菌OTU正负连接数量,却增强了镰刀菌菌群与真菌之间的负相关关系。

图3 基于OTU水平镰刀菌属与真菌正负关系网络

表4 不同处理对镰刀菌属与门水平真菌正负相关性的影响
研究发现(表4),所有处理以镰刀菌属OTU与子囊菌门(P_Ascomacota)和P_unclassified_k_Fungi OTU的关系为主。与对照相比,各处理镰刀菌属OTU与P_unclassified_k_Fungi OTU正连接数百分比高于其负连接数百分比。与对照相比,单施生物质炭和和石灰氮处理降低了镰刀菌属OTU与担子菌门(P_Basidiomycota)正连接数百分比,消除了镰刀菌属OTU与担子菌门(P_Basidiomycota)负相关关系;增加了镰刀菌属OTU与被孢霉门(P_Mortierellomycota)正连接数百分比;而生物质炭+石灰氮处理消除了镰刀菌属OTU与担子菌门(P_Basidiomycota)、丝足虫门(P_Cercozoa)、(P_Chytridiomycota)、球囊菌门(P_Glomeromycota)、 被孢霉门(P_Mortierellomycota)、毛霉门(P_Mucoromycota)等门类相关OTU的联系,却增加了其与P_unclassified_d_Eukaryota OTU的正负连接数比例。
3 讨论
3.1 生物质炭和石灰氮添加对土壤理化性质的影响
研究发现热解后的生物质炭呈碱性,其表面所带有的负电荷能够与土壤中游离的氢离子结合,提高土壤pH值[19]。而石灰氮施入土壤后能够与水反应生成氢氧化钙,从而提高土壤pH值[20]。因此,与对照相比,添加生物质炭和石灰氮均能显著提高土壤pH值。与对照相比,所有添加生物质炭处理均能显著提高速效钾量。究其原因可能是由于生物质炭中含有一定量速效钾,添加到土壤中可以提高土壤速效钾量;另外,施用生物质炭可以增加土壤阳离子交换量,增加土壤中可交换性钾量[21]。虽然,生物质炭较高的比表面积和发达的孔隙结构可以吸附土壤中如硝态氮等无机离子[22],但是,生物质炭的施入也会由于提高土壤的疏松程度而促进土壤水分下移,增加硝态氮的淋失量,从而导致固定在土壤中的硝态氮量降低[23]。与对照相比,石灰氮可显著提高土壤铵态氮量和硝态氮量(0.05),可能是由于添加到土壤中的石灰氮可以逐步水解成尿素或氨,而氨是微生物硝化作用的底物,因此有利于提高土壤铵态氮量和硝态氮的量[20]。与对照相比,添加石灰氮导致土壤电导率升高,尤其是生物质炭与石灰氮混合施入处理显著提高土壤电导率(0.05)。究其原因,可能是由于石灰氮水解形成氢氧化钙,为土壤电导率的提升提供了一定量的盐基离子;另外,生物质炭所含盐基离子(如K+、Ca2+、Mg2+等)与土壤中离子的交换作用可能增加了盐基离子在土壤中的累积[22,24]。
3.2 土壤真菌和镰刀菌属真菌对生物质炭和石灰氮的响应
生物质炭添加后土壤性质和基质可利用性的改变是引起土壤微生物群落结构变化的主要原因[25-26]。由于生物质炭含有大量有机碳以及氮、磷、钾等养分元素,为真菌的生长和繁殖提供了大量的能源物质[6],因此,与对照相比,仅添加生物质炭处理显著提高土壤真菌丰度(0.05);而生物质炭与石灰氮混施并未提高土壤真菌丰度,究其原因可能是石灰氮消杀微生物的作用抵消了生物质炭对真菌生长的正面影响。与对照相比,所有添加生物质炭处理均显著降低土壤真菌香农多样性指数(0.05)。可能是由于生物炭促进某些真菌种类的快速生长,导致某些微生物生物量增加,但多样性减少。另外,生物质炭添加提高了土壤pH值,可能不利于某些真菌的生长,从而导致真菌多样性的降低[27]。各处理间主要真菌门类相对丰度差异不显著,说明生物质炭和石灰氮添加并未改变真菌优势菌门在土壤中的主导地位。
基于配对检验,与对照相比,生物质炭与石灰氮的混合施入均能显著降低镰刀菌属的相对丰度(图2),说明生物质炭配施石灰氮能够抑制土壤镰刀菌属的生长。究其原因,可能是由于一方面石灰氮分解过程中的中间产物氰胺和双氰胺对土壤微生物具有灭杀和趋避的作用,石灰氮处理有利于有益微生物占据土壤生态位,挤占病原微生物发展空间和位点,从而削弱镰刀菌属的相对丰度[16]。生物质炭可以通过吸附、转移土壤可利用微生物代谢组分(如:酚酸类物质)诱导致病菌进入生物质炭内部;生物质炭的吸附与固持作用可能会限制镰刀菌属向土壤的转移,同时,生物质炭内部的生防菌可能会通过产生活性物质抑制或杀死镰刀菌属[28-29]。石灰氮和生物质炭混合施入显著增强了二者对镰刀菌属生长的抑制作用,是一种有利于缓解温室土壤病害的较好措施。
3.3 镰刀菌群与土壤环境及真菌群落的关系
曼特尔-亨塞尔检验的结果发现,土壤镰刀菌群与土壤电导率、铵态氮量均呈显著正相关,说明在一定范围内土壤可溶性盐量的增加有利于镰刀菌群的构建。铵态氮作为微生物生长所需的氮源,其量的增高势必会对镰刀菌属菌群构建起到促进作用。高芬等[3]认为微生物群落多样性的提高有利于土壤微生物生态系统的稳定和平衡,进而通过抑制病原菌而降低土传病害的发生概率。本研究发现生物质炭和石灰氮的添加可以通过降低土壤真菌群落多样性削弱镰刀菌属群落结构稳定性。
微生物的相互作用对生态系统的功能和稳定性至关重要。真菌是土壤微生物中的一大类,在设施土壤环境中真菌种群数量及结构的变化是引起设施土壤中多种病害的重要原因。明确土壤真菌和致病菌的关系,对于寻找病害发生的关键分类群,探索如何通过调整农艺管理措施操纵微生物群落以抑制有害物种的丰度和功能具有重要指导作用[30]。基于单因素相关性网络分析发现(图3和表4),与对照相比,单施或混合施入生物质炭和石灰氮均能降低镰刀菌属OTU与各门类真菌OTU连接数量,且各处理镰刀菌属真菌与真菌互作节点及门类减少。说明生物质炭或石灰氮的添加使真菌与镰刀菌属真菌之间的相互作用减少,从而导致真菌群落结构的复杂程度降低。究其原因,生物质炭对土壤养分的吸附及其对病原菌的固持作用,或者石灰氮分解产物对土壤微生物的广谱性灭杀作用都可能会降低土壤真菌与镰刀菌属真菌的关联作用[31-32]。尤其是生物质炭和石灰氮的混合施用可能会导致土壤元素比值的改变,造成真菌与镰刀菌属真菌的竞争关系的增强。
研究发现,所有处理均以镰刀菌属OTU与子囊菌门和P_unclassified_k_Fungi OTU的关系为主。其中,子囊菌门多为腐生真菌,对降解土壤有机质(如木质素、角质素等)有重要作用,可促进土壤物质循环,这无疑为土壤微生物的生长提供必需的营养,因此镰刀菌属与子囊菌门的关系密切。与对照相比,生物质炭或石灰氮的施入使真菌与镰刀菌属互作网络节点数量减少;其中,生物质炭与石灰氮混合施入导致镰刀菌属OTU仅与子囊菌门、P_unclassified_k_Fungi和P_unclassified_d_Eukaryota这3个门类的相关OTU有关。该结果说明生物质炭或石灰氮的施入可能会通过降低镰刀菌属真菌与其他真菌的关联度破坏镰刀菌属真菌的生态功能[30, 33]。
4 结论
1)生物质炭有利于提高土壤pH值和速效钾量,石灰氮有利于提高土壤pH值、铵态氮和硝态氮量。
2)添加生物质炭提高了温室土壤真菌生物量,却降低了真菌群落香农多样性。
3)生物质炭与石灰氮混合施入可显著降低镰刀菌属的相对丰度。
4)单施或混合施入生物质炭和石灰氮均能降低镰刀菌属OTU与真菌各门类OTU的关联性,破坏镰刀菌属菌群的生态功能。
(作者声明本文无实际或潜在利益冲突)
[1] 张岳平. 镰刀菌真菌毒素产生与调控机制研究进展[J]. 生命科学, 2011, 23(3): 311-316.
ZHANG Yueping. The research advance of biosynthesis and regulation mechanism on fusarium mycotoxins[J]. Chinese Bulletin of Life Sciences, 2011, 23(3): 311-316.
[2] 蔡祖聪, 黄新琦. 土壤学不应忽视对作物土传病原微生物的研究[J]. 土壤学报, 2016, 53(2): 305-310.
CAI Zucong, HUANG Xinqi. Soil-borne pathogens should not be ignored by soil science[J]. Acta Pedologica Sinica, 2016, 53(2): 305-310.
[3] 高芬, 闫欢, 王梦亮, 等. 土壤微生物菌群变化对土传病害的影响及生物调控[J]. 中国农学通报, 2020, 36(13): 160-164.
GAO Fen, YAN Huan, WANG Mengliang, et al. Soil microbial community changes: Effects on soil-borne diseases and biological regulation[J]. Chinese Agricultural Science Bulletin, 2020, 36(13): 160-164.
[4] 李文静, 王秋霞, 李园, 等. 我国防治主要土传病害的农药登记和推广情况[J]. 农药, 2021, 60(8): 547-554, 570.
LI Wenjing, WANG Qiuxia, LI Yuan, et al. Current situation of pesticides for control of mainly soil-borne diseases registration, extension and application in China[J]. Agrochemicals, 2021, 60(8): 547-554, 570.
[5] 马畅, 刘新刚, 吴小虎, 等. 农田土壤中的农药残留对农产品安全的影响研究进展[J]. 植物保护, 2020, 46(2): 6-11.
MA Chang, LIU Xingang, WU Xiaohu, et al. Research progress in the impact of pesticide residues in farmland soil on agricultural product safety[J]. Plant Protection, 2020, 46(2): 6-11.
[6] WU P, ATA-UL-KARIM S T, SINGH B P, et al. A scientometric review of biochar research in the past 20 years (1998-2018)[J]. Biochar, 2019, 1(1): 23-43.
[7] BONANOMI G, IPPOLITO F, SCALA F. A “black” future for plant pathology? biochar as a new soil amendment for controlling plant diseases[J]. Journal of Plant Pathology, 2015, 97(2): 223-234.
[8] 王成己, 郭学清, 曾文龙, 等. 生物质炭对烟草青枯病的防控作用及应用前景分析[J]. 南方农业学报, 2019, 50(8): 1 756-1 763.
WANG Chengji, GUO Xueqing, ZENG Wenlong, et al. The prevention and control effects of biochar on tobacco bacterial wilt and its application prospects[J]. Journal of Southern Agriculture, 2019, 50(8): 1 756-1 763.
[9] 束秀玉. 施用生物质炭对西瓜幼苗枯萎病的影响及其作用机制[J]. 河南农业科学, 2020, 49(11): 91-97.
SHU Xiuyu. Effects of biomaterial carbon application on fusarium wilt of watermelon seedlings and its mechanism[J]. Journal of Henan Agricultural Sciences, 2020, 49(11): 91-97.
[10] VECSTAUDZA D, GRANTINA-IEVINA L, MAKARENKOVA G, et al. The impact of wood-derived biochar on the survival ofspp. and growth ofL.in sandy soil[J]. Biocontrol Science and Technology, 2018, 28(4): 341-358.
[11] 王光飞, 马艳, 郭德杰, 等. 生物质炭介导生防微生物抑制辣椒疫霉的作用[J]. 中国生态农业学报(中英文), 2019, 27(7): 1 015-1 023.
WANG Guangfei, MA Yan, GUO Dejie, et al. Inhibitory effect of biochar-enriched biocontrol agents on Phytophthora capsici[J]. Chinese Journal of Eco-Agriculture, 2019, 27(7): 1 015-1 023.
[12] AKANMU A O, SOBOWALE A A, ABIALA M A, et al. Efficacy of biochar in the management ofSacc. causing ear rot inL[J]. Biotechnology Reports, 2020, 26: e00 474.
[13] BOURBOS V A, SKOUDRIDAKIS M T, DARAKIS G A, et al. Calcium cyanamide and soil solarization for the control off.sp.in greenhouse cucumber[J]. Crop Protection, 1997, 16(4): 383-386.
[14] 王利静. 石灰氮对草莓再植病害病原菌的抑制作用研究[D]. 保定: 河北农业大学, 2007.
WANG Lijing. Inhibitive effect of calcium cyanamide to pathogens causing replant diseases of strawberry[D]. Baoding: Hebei Agricultural University, 2007.
[15] 王礼. 石灰氮对土壤微生物种群及黄瓜枯萎病病原菌影响的研究[D]. 杭州: 浙江大学, 2006.
[16] 马军伟, 孙万春, 胡庆发, 等. 氰胺类肥料对连作土壤微生物种群结构的影响[J]. 浙江大学学报(农业与生命科学版), 2013, 39(3): 281-290.
MA Junwei, SUN Wanchun, HU Qingfa, et al. Effects of cyanamide fertilizer on microbial community structure of continuous cropping soil[J]. Journal of Zhejiang University (Agriculture and Life Sciences), 2013, 39(3): 281-290.
[17] BONILLA N, GUTIÉRREZ-BARRANQUERO J, VICENTE A, et al. Enhancing soil quality and plant health through suppressive organic amendments[J]. Diversity, 2012, 4(4): 475-491.
[18] 鲍士旦. 土壤农化分析[M]. 3版. 北京: 中国农业出版社, 2000.
BAO Shidan. Soil and agricultural chemistry analysis[M]. 3rd ed. Beijing: China Agriculture Press, 2000.
[19] 刘杰云, 张文正, 沈健林, 等. 水分管理及生物质炭对稻田土壤含水率及pH值的影响[J]. 灌溉排水学报, 2021, 40(7): 44-50.
LIU Jieyun, ZHANG Wenzheng, SHEN Jianlin, et al. The combined effects of water management and biochar amendment on soil water content and pH of paddy soil[J]. Journal of Irrigation and Drainage, 2021, 40(7): 44-50.
[20] SUZUKI K, KASHIWA N, NOMURA K, et al. Impacts of application of calcium cyanamide and the consequent increase in soil pH on N2O emissions and soil bacterial community compositions[J]. Biology and Fertility of Soils, 2021, 57(2): 269-279.
[21] 李丽, 王雪艳, 田彦芳, 等. 生物质炭对土壤养分及设施蔬菜产量与品质的影响[J]. 植物营养与肥料学报, 2018, 24(5): 1 237-1 244.
LI Li, WANG Xueyan, TIAN Yanfang, et al. Effects of biochar on soil nutrients, yield and quality of vegetables[J]. Journal of Plant Nutrition and Fertilizers, 2018, 24(5): 1 237-1 244.
[22] 刘玉学, 吕豪豪, 石岩, 等. 生物质炭对土壤养分淋溶的影响及潜在机理研究进展[J]. 应用生态学报, 2015, 26(1): 304-310.
LIU Yuxue, LYU Haohao, SHI Yan, et al. Effects of biochar on soil nutrients leaching and potential mechanisms: A review[J]. Chinese Journal of Applied Ecology, 2015, 26(1): 304-310.
[23] 沈晨, 颜鹏, 魏吉鹏, 等. 生物质炭对土壤硝态氮淋洗的影响[J]. 农业资源与环境学报, 2018, 35(4): 292-300.
SHEN Chen, YAN Peng, WEI Jipeng, et al. Effect of biochar amendment on nitrogen leaching in soils[J]. Journal of Agricultural Resources and Environment, 2018, 35(4): 292-300.
[24] 蔡九茂, 刘杰云, 邱虎森, 等. 滴灌方式和生物质炭对温室土壤矿质态氮及其微生物调控的影响[J]. 环境科学, 2020, 41(8): 3 836-3 845.
CAI Jiumao, LIU Jieyun, QIU Husen, et al. Effects of drip irrigation patterns and biochar addition on soil mineral nitrogen and microbial regulation of greenhouse[J]. Environmental Science, 2020, 41(8): 3 836-3 845.
[25] KHADEM A, RAIESI F, BESHARATI H, et al. The effects of biochar on soil nutrients status, microbial activity and carbon sequestration potential in two calcareous soils[J]. Biochar, 2021, 3(1): 105-116.
[26] ZHANG L Y, JING Y M, XIANG Y Z, et al. Responses of soil microbial community structure changes and activities to biochar addition: A meta-analysis[J]. Science of the Total Environment, 2018, 643: 926-935.
[27] ADAMO I, CASTAÑO C, BONET J A, et al. Soil physico-chemical properties have a greater effect on soil fungi than host species in Mediterranean pure and mixed pine forests[J]. Soil Biology and Biochemistry, 2021, 160: 108 320.
[28] 崔丙健, 崔二苹, 胡超, 等. 生物质炭施用对再生水灌溉空心菜根际微生物群落结构及多样性的影响[J]. 环境科学, 2020, 41(12): 5 636-5 647.
CUI Bingjian, CUI Erping, HU Chao, et al. Effects of selected biochars application on the microbial community structures and diversities in the rhizosphere of water spinach (ipomoea aquatica forssk.) irrigated with reclaimed water[J]. Environmental Science, 2020, 41(12): 5 636-5 647.
[29] 崔二苹, 崔丙健, 刘源, 等. 生物炭对非常规水源灌溉下土壤-作物病原菌的影响[J]. 中国环境科学, 2020, 40(3): 1 203-1 212.
CUI Erping, CUI Bingjian, LIU Yuan, et al. Effects of biochar supplementation on the behavior of pathogens in soil-plant system under unconventional water resources irrigation[J]. China Environmental Science, 2020, 40(3): 1 203-1 212.
[30] YANG H W, LI J A, XIAO Y H, et al. An integrated insight into the relationship between soil microbial community and tobacco bacterial wilt disease[J]. Frontiers in Microbiology, 2017, 8: 2 179.
[31] YERGEAU E, LABOUR K, HAMEL C, et al. Patterns of fusarium community structure and abundance in relation to spatial, abiotic and biotic factors in soil[J]. FEMS Microbiology Ecology, 2009, 71(1): 34-42.
[32] 马泊泊, 黄瑞林, 张娜, 等. 秸秆生物质炭对根际土壤细菌-真菌群落分子生态网络的影响[J]. 土壤学报, 2019, 56(4): 964-974.
MA Bobo, HUANG Ruilin, ZHANG Na, et al. Effect of straw-derived biochar on molecular ecological network between bacterial and fungal communities in rhizosphere soil[J]. Acta Pedologica Sinica, 2019, 56(4): 964-974.
[33] ZHOU J Z, DENG Y, LUO F, et al. Functional molecular ecological networks[J]. mBio, 2010, 1(4): e00 169-e00 110.
Amending Greenhouse Soil Using Biochar and Lime Nitrogen Reduces the Correlation between Fungal andCommunities
QIU Husen2, LIU Jieyun2, ZHANG Wenzheng1*, LYU Mouchao1, WANG Yu2
(1. Farmland Irrigation Research Institute, Chinese Academy of Agricultural Sciences, Xinxiang 453002, China; 2. School of Environment and Surveying Engineering, Suzhou University, Suzhou 234000, China)
【Objective】Biochar and lime nitrogen have been increasingly utilized as conditioners to improve soil quality, yet their effects on soil microbial communities remain relatively unexplored. This study aims to investigate the impact of soil amendment with biochar and lime nitrogen on fungal community diversity and the correlation between fungi and. 【Method】The experiment was conducted in soil columns with biochar and lime nitrogen applied separately or in combination. Untreated soil served as the control. For each treatment, we measured physicochemical properties, fungal community structure,abundance in the soil, as well as their interactions. 【Result】In comparison to the control, application of biochar significantly increased soil pH and available potassium (<0.05). Application of lime nitrogen alone increased pH, ammonium nitrogen, and nitrate nitrogen in the soil (<0.05). Combined application of biochar and lime nitrogen significantly increased pH, electrical conductivity, ammonium nitrogen, nitrate nitrogen, and available potassium of the soil (<0.05). It was found that applying biochar alone or in combination with lime nitrogen significantly reduced the fungal Shannon diversity index (<0.05), although there were no significant differences in the relative abundance of the dominant fungal phylum between the treatments. Additionally, combined application of biochar and lime nitrogen led to a significant reduction in the relative abundance of(<0.05). The Mantel-Haenzel test revealed significant positive correlations between thecommunity and soil conductivity, ammonium nitrogen, and aroma diversity of the fungal community (<0.05). Network analysis showed that separate or combined application of biochar and lime nitrogen reduced the number of both positive and negative connections and nodes between the Fusarium community and fungal community. 【Conclusion】The combined application of biochar and lime nitrogen enhanced the competition between thecommunity and the fungal community, which is beneficial for mitigating soil pathogens.
greenhouse; biochar, lime nitrogen;; fungal community diversity
1672 - 3317(2023)10 - 0114 - 08
S154.1
A
10.13522/j.cnki.ggps.2023146
邱虎森, 刘杰云, 张文正, 等. 生物质炭和石灰氮削弱温室土壤镰刀菌与真菌群落关联度[J]. 灌溉排水学报, 2023, 42(10): 114-121.
QIU Husen, LIU Jieyun, ZHANG Wenzheng, et al. Amending Greenhouse Soil Using Biochar and Lime Nitrogen Reduces the Correlation between Fungal andCommunities[J]. Journal of Irrigation and Drainage, 2023, 42(10): 114-121.
2023-04-03
2023-06-08
2023-10-18
安徽省教育厅科学研究项目(2022AH030137,2022AH051383,SK2021A0698);国家自然科学基金青年基金项目(42007089);宿州学院博士科研启动基金项目(2020BS022,2020BS023)
邱虎森(1987-),男。博士,主要从事土壤养分循环微生物过程研究。E-mail: qiuhusen2008@163.com
张文正(1986-),男。助理研究员,硕士,主要从事生态灌区改造与建设研究。E-mail: zhangntggs@163.com
@《灌溉排水学报》编辑部,开放获取CC BY-NC-ND协议
责任编辑:赵宇龙

