紫外/一氯胺高级氧化工艺降解萘丁美酮的动力学、降解路径、毒性变化和消毒副产物生成
白云松,涂 响,杨 光*,潘 杨,刘 超
1.苏州科技大学环境科学与工程学院,江苏 苏州 215009
2.中国环境科学研究院,国家环境保护饮用水水源地保护重点实验室,北京 100012
3.中国五洲工程设计集团有限公司,北京 100053
药物与个人护理品(pharmaceutical and personal care products,PPCPs)是近年来有待解决的环境污染问题之一.非甾体抗炎药(nonsteroidal anti-inflammatory drugs,NSAIDs)是一类典型的具有消炎镇痛功能的PPCPs.由于人畜身体对药物的代谢不完全,NSAIDs可伴随生活污水医疗制药废水排放、废旧药品和医疗垃圾丢弃等途径进入土壤和水环境中[1-2].一些NSAIDs(如布洛芬、双氯芬酸、水杨酸和对乙酰氨基酚等)在地表水[3-5]、地下水[6]和污水厂进出水[7]等多种水体中频繁检出,浓度水平从ng/L 至μg/L 不等.NSAIDs 持续排放对水生生物和人类健康构成一定的威胁[8-9].萘丁美酮(nabumetone,NMT)是一种常用于缓解风湿性关节炎的NSAIDs,根据Peng 等的研究显示,胶州湾表层海水中NMT 浓度最高可达1.94 ng/L[10].另有研究显示,NMT 可以抑制小鼠的免疫反应[11],且长期接触NMT 与孕妇早产[12]、皮肤癌[13]均呈现一定的相关性.传统污水处理技术对药物类污染物的去除效果并不理想[14],为了最大限度降低风险,有必要采取新型高效的水处理工艺将之去除.
基于紫外线(ultraviolet,UV)的高级氧化工艺(advanced oxidation processes,AOPs)对去除水中PPCPs 具有良好的性能和应用前景[15].紫外/一氯胺(UV/NH2Cl)是在紫外/氯高级氧化的基础上发展而来的一种新型高级氧化工艺.一氯胺与自由氯相比具有更高的稳定性和更低的反应性,刺鼻性气味较小,消毒过程中受管制的消毒副产物(disinfection by-products,DBPs)生成量更少,且能够在供水管网中保证足够的余氯[16].但正是其高稳定性和低反应性导致了其对水中微污染物的去除性能十分受限.当前我国自来水处理厂和污水处理厂中已具备足够成熟规模的紫外消毒工艺,可在原有基础设施上加以改造,结合紫外照射与氯胺消毒的优势在去除水中药物污染物的同时表现出优良的消毒性能.结合现有相关研究[17-21]总结出UV/NH2Cl 反应体系内主要自由基的产生路径,如图1 所示,一氯胺在紫外照射下发生光解产生胺基自由基(·NH2)和氯自由基(Cl·),即式(1)[20].
Cl·可与水分子或水中其他共存物质经图1 所示的反应产生羟基自由基(HO·)和活性氯物种(reactive chlorine species,RCS,如Cl2·-、·ClOH-和ClO·等),同时·NH2可发生一系列链式反应产生活性氮物种(reactive nitrogen species,RNS,如·NO 和·NO2等)[20-21].多种共存的活性自由基相互补充,促进污染物的降解.已有学者对UV/NH2Cl 降解对乙酰氨基酚[22]、安赛蜜[23]、避蚊胺[24]和异丙安替比林[25]等PPCPs 的效能和动力学开展研究,但目前对化学结构各异的NSAIDs 在UV/NH2Cl 体系内的降解动力学和机制等方面的了解仍然有限,另外UV/NH2Cl 处理作为一种具有消毒作用的水处理工艺,还应关注药物污染物在处理前后多指标的毒性变化及消毒过程中DBPs 的生成情况.
本研究以UV/NH2Cl 高级氧化工艺作为降解手段,选择NMT 作为目标污染物,探究UV/NH2Cl 对NMT 的降解效能和影响因素,基于密度泛函理论(density functional theory,DFT)计算识别污染物的反应活性位点,结合超高效液相色谱-高分辨质谱(ultra performance liquid chromatography high resolution mass spectrometry,UPLC-HRMS)鉴定降解产物,推测UV/NH2Cl 降解NMT 可能的路径,并评估降解过程的毒性变化,最后对降解过程消毒副产物的生成特性进行分析,以期为UV/NH2Cl 高级氧化工艺处理含NMT 废水提供理论依据.
1 材料与方法
1.1 试剂与仪器
试验试剂:萘丁美酮标准品购自德国Dr.Ehrenstorfer公司,氯化铵、五水合五水合硫代硫酸钠、硫酸、氢氧化钠、氯化钠、碳酸氢钠、十二水合磷酸氢二钠、二水合磷酸二氢钠购自国药化学试剂公司;甲醇、甲酸、乙腈均为HPLC 级,购自美国Fisher Scientific 公司;天然有机物(NOM)购自国际腐殖质协会.DBPs标准品包括三氯甲烷(trichloromethane,TCM)、1,1-二氯丙酮 (1,1-dichloroacetone,1,1-DCP)、二氯乙腈(dichloroacetonitrile,DCAN)、三氯硝基甲烷(trichloronitromethane,TCNM)和二氯乙酸(dichloroacetic acid,DCAA),购自美国 J.T.Baker Chemicals 公司.试验涉及的溶液均使用Milli-Q 系统生产的超纯水(18.2 MΩ/cm)配置.一氯胺储备溶液每日试验开始前现用现配.具体操作如下:Cl 与N 质量比为4:1,将NaClO 原液缓慢滴加至NH4Cl 溶液(100 mL,25 mmol/L)中,滴加过程持续搅拌并保持溶液pH 在8.5±0.02 范围内.滴加完毕后继续搅拌40 min,期间溶液pH 不发生较大变化方可用于试验.
试验仪器:高效液相色谱仪(1260 型,美国Agilent 公司)配备二极管阵列检测器;超高效液相-高分辨质谱联用仪(Q Exactive Hybrid Quadrupole-Orbitrap,美国Thermo 公司);C18 色谱柱(Proshell,4.6 mm×50 mm,5 μm)和C18 色谱柱(100 mm×4.6 mm,5 μm);pH 计(PB-21 型,德国Sartorius 公司);磁力搅拌器(85-1 型,上海司乐仪器有限公司);便携式余氯设备(Pocket Colorimeter Ⅱ)购自美国哈希公司.
1.2 试验装置与方法
试验在一个容积为700 mL 的圆柱形硅酸盐玻璃反应器中进行,反应器中心放置石英套筒,套筒内放置一根功率为10 W 的低压汞灯.整个反应器放置于磁力搅拌器上.所有试验均在水循环系统中维持在(25±0.2) ℃条件下进行.试验开始前打开紫外线灯预热30 min,以保证获得稳定的紫外光.使用三草酸铁(Ⅲ)钾三水合物法测定紫外灯辐照强度〔0.48×10-5Einstein/(L·s)〕,使用稀H2O2溶液的光解动力学方法确定有效光程(1.88 cm).
反应溶液总体积700 mL,NMT 初始浓度5 μmol/L,使用2 mmol/L 磷酸盐缓冲溶液调节pH 为7.0.将50 μmol/L NH2Cl 加入到配置好的反应溶液的同时开启紫外灯照射.在特定时间点采集1 mL 样品转移至棕色玻璃进样瓶中,并立即用Na2S2O3溶液(100 μL,10 mmol/L)淬灭,24 h 内完成样品的检测.在探究影响因素试验时,保持其他条件不变并额外控制以下参数:使用稀NaOH 和稀H2SO4分别调节溶液pH 为5.5 和8.5、NH2Cl 投加量(10~20 μmol/L)、氯化钠(1~5 mmol/L)、碳酸氢钠(1~5 mmol/L)和腐殖酸(1~5 mg/L).分别在黑暗环境和不添加NH2Cl 的条件下以类似的流程进行单独氯胺氧化和单独紫外光解试验.以上所有样品重复测试3 次取平均值.
为便于仪器分析,选用较高的浓度进行降解产物和消毒副产物试验.NMT 初始浓度50 μmol/L,NH2Cl投加量500 μmol/L,其余条件保持不变.特定时间收集700 mL 样品转移至棕色螺口玻璃瓶中并立即用Na2S2O3溶液(1 mL,10 mmol/L)淬灭,500 mL 样品用于固相萃取,200 mL 样品用于液-液萃取.使用HLB柱(200 mg,6 mL,Waters)进行固相萃取,具体步骤如下:HLB 固相萃取柱首先使用4 mL 甲醇和4 mL 酸化去离子水(pH≈3.0)以1 mL/min 的流速活化,之后500 mL 样品以1 mL/min 的流速流经HLB 柱,然后使用10 mL 去离子水洗去柱上的干扰成分,最后使用10 mL 甲醇以1 mL/min 的流速洗脱提取物.提取物经氮吹后使用甲醇与水混合液(5:95,体积比)定容至2 mL,待高分辨质谱上样分析.消毒副产物样品使用4 mL 甲基叔丁基醚(MTBE)液-液萃取,待上机检测.
1.3 分析方法
使用高效液相色谱仪测定动力学样品中NMT浓度.进样体积100 μL,流动相A 相为超纯水,B 相为甲醇,体积比3∶1,流速1.0 mL/min,检测波长230 nm.使用UltiMate 3000 UPLC 系统与Q Exactive Hybrid Quadrupole-Orbitrap 质谱仪(Thermo Scientific,美国)联用仪配备Eclipse Plus C18 色谱柱(4.6 mm×100 mm,5 μm)测定降解产物.进样量10 μL,柱温设定为30 ℃,流动相A 相为0.1%甲酸乙腈溶液,B 相为0.1%甲酸水溶液,梯度洗脱程序见表1.Q Exactive MS 质谱仪采用负电子喷雾电离(ESI-)模式,分析的参数如下:毛细管温度为300 ℃,保护气和辅助气的速度分别为40 和15 mL/min,毛细管电压为2 800 V,质谱分辨率为70 000,扫描范围为50~600m/z.TCM、1,1-DCP、DCAN、TCNM 和DCAA 5 种DBPs 采用气相色谱法进行定量分析.具体操作流程参考美国公共卫生协会颁布的Standard Methods for the Examination of Water and Wastewater.
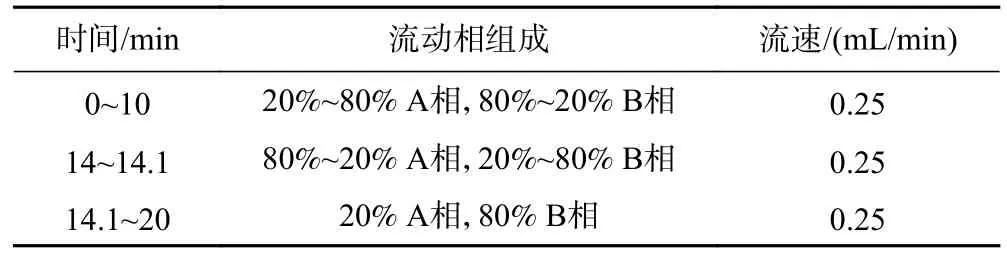
表1 超高效液相色谱梯度洗脱Table 1 Gradient elution of UPLC
1.4 毒性预测方法
使用美国环境保护局(US EPA)基于定量构效关系(quantitative structure-activity relationship,QSAR)开发的毒性评估软件工具(toxicity estimation software tool,TEST)预测NMT 及其降解产物的毒性.选用大鼠经口半数致死量(LD50)、生物累积因子、发育毒性和诱变性4 个指标评价降解产物毒性.对于无法准确确定分子结构的物质,选用毒性最强的数值绘制出降解途径的毒性变化图.
2 结果与讨论
2.1 UV/NH2Cl 对NMT 的降解效能
单独UV 光解、单独NH2Cl 氧化和UV/NH2Cl 处理3 种降解手段去除NMT 的过程如图2 所示.单独UV 光解对污染物的去除效果不明显,UV 光解300 s仅有0.62%的NMT 发生降解.参照孙玉洁等[26]的研究,依据朗德-比尔定律测得无氧超纯水中NMT 在波长254 nm 处的摩尔吸光系数(ε)为3 220 mol-1·cm-1,量子产率(ϕ)为0.001 9 mol/Einstein,说明NMT 是光惰性化合物,光转化能力较弱.NH2Cl 投加量为50 μmol/L时,单独NH2Cl 氧化处理300 s 仍未观察到NMT 明显的降解,降解效率仅为3.13%,这说明通过NH2Cl的氧化能力达到污染物降解的效果仍有限.NH2Cl 的氧化还原电位较低(E=1.13 V),氧化能力不足以破坏结构复杂有机物的化学键.UV/NH2Cl 处理150 s 后,NMT 的降解效率达到88.81%,说明UV/NH2Cl 对目标污染物具有良好的去除性能,而单独UV 光解或单独使用氧化剂氧化对某些有机微污染物的去除性能有限,如在紫外/过硫酸盐降解二苯甲酮-4[27]和紫外/氯降解普里米酮[28]的过程中存在类似的现象.3 种降解手段下NMT 浓度随时间变化趋势均符合拟一级反应动力学方程(R2>0.983),如式(2)所示.试验条件下测得NMT 的降解速率常数如表2 所示,从表2 可以看出,UV/NH2Cl 对NMT 的降解速率显著高于其余二者之和,说明UV 与NH2Cl 在降解过程中存在明显的协同作用,自由基的攻击是UV/NH2Cl 降解目标污染物的主要贡献者.

表2 不同降解手段对NMT 的降解速率常数Table 2 Degradation rate constant of NMT in different methods

图2 不同降解手段对NMT 的降解效能Fig.2 Degradation efficiency of NMT by different degradation method
式中:[NMT]t为t时NMT 浓度,μmol/L;[NMT]0为初始NMT 浓度,μmol/L;kobs为拟一级降解速率常数,s-1;t为反应时间,s.
2.2.1 NH2Cl 投加量的影响
本文研究了不同NH2Cl 投加量(10、20 和50 μmol/L)对UV/NH2Cl 降解NMT 的影响,结果如图3所示.不同NH2Cl 投加量下的药物降解过程均符合拟一级动力学方程(R2>0.992).当NH2Cl 投加量从10 μmol/L 增 至20 μmol/L 时,kobs由7.10×10-2s-1升至10.0×10-2s-1;当NH2Cl 投加量增至50 μmol/L 时,kobs为1.43×10-2s-1,说明降解速率随NH2Cl 投加量的增加而上升,但呈现出非线性增加的趋势,上升幅度逐渐趋于缓慢.在一定范围内,向反应体系内投加更多的NH2Cl 可促进产生更多的活性自由基,使降解速率增加.然而加入过量NH2Cl 对活性自由基(如HO·、Cl·和Cl2·-)存在清除作用,反应生成NHCl·,如式(3)~(5)所示[27].NHCl·的氧化较弱,氧化还原电位(E)为0.1 V.另外,过量NH2Cl 可以与NMT 竞争紫外吸收,抑制NMT 光解[29].

图3 NH2Cl 投加量对UV/NH2Cl 降解NMT 的影响Fig.3 Effects of NH2Cl dosage on degradation of NMT by UV/NH2Cl
2.2 UV/NH2Cl 降解NMT 的影响因素
2.2.2 溶液初始pH 的影响
图4 显示了不同初始pH(5.5、7.0 和8.5)对UV/NH2Cl 降解NMT 的影响,不同初始pH 条件下NMT 的降解过程均符合拟一级反应动力学方程(R2>0.993).当初始pH 为5.5 和8.5 时,NMT 的kobs值分别为1.30×10-2和1.16×10-2s-1,略低于初始pH 为7.0时的情况(kobs=1.43×10-2s-1).表明NMT 的降解受弱酸或弱碱性条件的影响程度较小,UV/NH2Cl 处理卡马西平[30]、泛影酸盐[31]、布洛芬和萘普生[32]等药物的降解速率受pH 的影响同样较为微弱.相关报道[21]可知,氯胺(包括NH2Cl、NHCl2和NCl3)光解速率几乎不受pH 的影响,因而初始pH 在5.5~8.5 范围内活性自由基的产生速率几乎保持不变.另外NMT 是一种酮类有机物,在不同pH 下能够保持稳定的分子完整性.因此初始pH 在5.5~8.5 范围内的变化对UV/NH2Cl降解过程的影响并不重要.
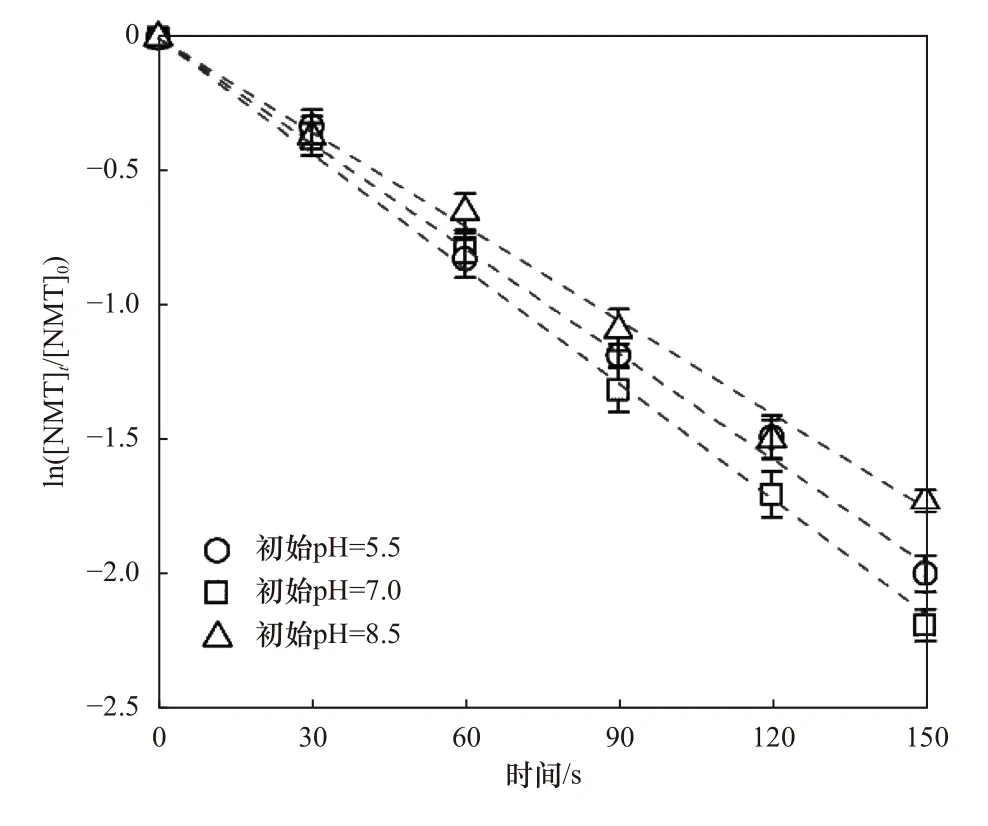
图4 溶液初始pH 对UV/NH2Cl 降解NMT 的影响Fig.4 Effects of solution pH on degradation of NMT by UV/NH2Cl
2.2.3 Cl-浓度的影响
图5 为不同Cl-浓度(1~5 mmol/L)对UV/NH2Cl降解NMT 的影响.Cl-的存在抑制了UV/NH2Cl对NMT 的降解过程,且Cl-浓度越高抑制作用越强烈.Cl-浓度由0 mmol/L 增至1 mmol/L,NMT 降解速率从1.43×10-2s-1减至1.21×10-2s-1,当Cl-浓度增至5 mmol/L 时,反应速率降至8.10×10-3s-1,降解效率仅为60.45%.在中性或碱性条件下,Cl-可与HO·和Cl·分别快速生成ClOH·-和Cl2·-,如式(6)~(8)所示[24].产生的ClOH·-和Cl2·-氧化还原电位较低且具有选择性,无法补偿优势活性组分HO·和Cl·的消耗.另外Cl2·-可与其他物质(如Cl·、Cl-、NH2Cl等)发生反应生成惰性物质,如式(9)~(11)所示[33-34].因此,Cl-对NMT 降解存在抑制作用.
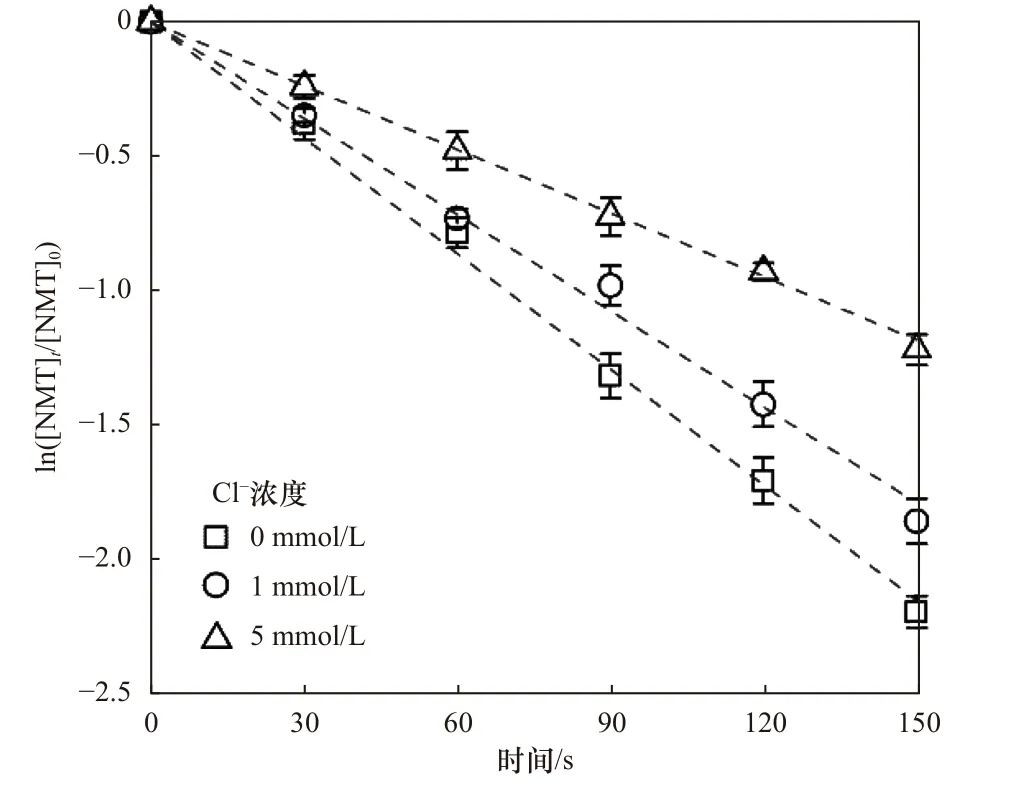
图5 Cl-浓度对UV/NH2Cl 降解NMT 的影响Fig.5 Effects of Cl- concentration on degradation of NMT by UV/NH2Cl
2.2.4 HCO3-浓度的影响
图6 显示了不同HCO3-浓度(1~5 mmol/L)对UV/NH2Cl 降解NMT 的影响.在考察HCO3-影响的过程中,添加NaHCO3后不调整溶液pH,始终保持为弱碱性.不同HCO3-浓度下NMT 和MNA 的降解过程均符合拟一级反应动力学方程(R2>0.998).在1 mmol/L和5 mmol/L HCO3-的条件下,kobs分别降至1.25×10-2和5.20×10-3s-1,与纯水条件相比,NMT 降解效率分别为84.92%和65.87%,HCO3-的存在抑制了污染物的降解.HCO3-可与HO·、Cl·和Cl2·-等自由基反应生成CO3·-,见式(12)~(14),反应速率分别为8.5×106、2.2×108和8.0×107L/(mol·s).与Cl2·-类似,CO3·-具有更高的选择性,倾向于与酚类、含氮、含硫有机物等富电子污染物反应[33],并且其氧化还原电位较低(E=1.78 V),反应活性弱于HO·和RCS[35-36],因此HCO3-对NMT 的降解具有抑制作用.

图6 HCO3-浓度对UV/NH2Cl 降解NMT 的影响Fig.6 Effects of HCO3- concentration on degradation of NMT by UV/NH2Cl
2.2.5 NOM 的影响
已有研究[23,30]表明,水中NOM 对高级氧化降解污染物存在一定程度的影响.腐殖酸是水中典型的NOM 之一,将不同浓度(1~5 mg/L)的腐殖酸添加至溶液中以探究NOM 对UV/NH2Cl 降解NMT 的影响,结果如图7 所示.不同NOM 浓度下NMT 的降解均符合拟一级动力学方程(R2>0.987).由图7 可见,NOM对目标污染物的降解存在明显的抑制作用.5 mg/L的NOM 最高可使NMT 的降解速率降至5.60×10-3s-1,降解效率降至57.40%.造成这种现象的主要原因可能是:①NOM 具有内滤效应[37],可吸收紫外照射,抑制NH2Cl 光解;②NOM 的清除作用,NOM 作为自由基清除剂可与HO·和Cl·反应,反应速率分别为2.5×104和1.3×104L/(mol·s)[38],与污染物竞争自由基,抑制反应进行.

图7 NOM 浓度对UV/NH2Cl 降解NMT 的影响Fig.7 Effects of NOM concentration on degradation of NMT by UV/NH2Cl
2.3 UV/NH2Cl 处理NMT 的降解机制与路径
2.3.1 量子化学计算
基于DFT 方法使用Gaussian 09 程序在B3LYPD3BJ/6-311+G(d)水平上优化NMT 的分子几何构型并编号,如图8 所示.为了进一步阐明自由基与污染物的反应机理,利用自然种群分析(natural population analysis,NPA)电荷分布和福井函数来推测可能的自由基反应位点.福井函数是表征各原子反应活性的函数,f+、f-和f0分别对应亲核攻击、亲电攻击和自由基攻击,函数值越大说明该原子位点越易受到攻击[39-40].根据DFT 计算结果(见表3),C2、C5、C9、C10 和O20比其他原子表现出更高的f0值,NMT 侧链取代基的邻位和间位以及酮基是主要的反应活性位点.

表3 NMT 的自然布局分析(NPA)电荷分布和福井函数Table 3 Ntural population analysis (NPA) charge distribution and Fukui index of NMT

图8 优化后的NMT 分子几何构型Fig.8 The optimized geometric configuration of NMT molecular
2.3.2 降解产物分析
图9 为使用UPLC-HRMS 方法测得UV/NH2Cl处理150 s 样品的总离子色谱图,其中保留时间为7.03 min 处的峰即为NMT.将质谱提供的精确质荷比与分子质量进行匹配,共推断出9 种NMT 降解产物,其保留时间、[M-H]-、相对分子质量和分子式如表4 所示.并且分析了产物信号强度随反应时间的变化关系(见图10),各产物浓度虽无法定量计算,但其信号强弱一定程度上仍可反映浓度的大小.反应结束后P8、P7 和P9 占主要地位.P1、P5、P4 和P2 在反应中途到达峰值后逐渐下降,可能是降解中间体;P8、P7、P9 和P6 的信号强度随时间单调上升,其生成速度大于降解速度,可认为是降解最终产物.

表4 UV/NH2Cl 处理NMT 主要降解产物质谱信息Table 4 Mass spectra information of main degradation products for NM in UV/NH2Cl treatment

图9 NMT 降解产物的总离子色谱图Fig.9 Total ion chromatogram of NMT degradation products

图10 NMT 降解产物信号强度变化Fig.10 Signal intensity of degradation products of NMT
2.3.3 降解路径分析
结合DFT 计算和UPLC-HRMS 分析结果,推断出在UV/NH2Cl 中4 条可能的NMT 降解路径,如图11 所示.对于路径I 的解析如下,首先NMT 羟基化和胺化作用生成P2,酮基转化为羧基,甲氧基转化为羟基形成羧酸类物质P6.路径Ⅱ首先在5C 发生氯取代,后续经过羟基化和去甲基反应,酮基转化为羧基生成P7.反应路径Ⅲ和Ⅳ的第一阶段相同,首先5C 受到HO·攻击发生羟基化生成P1,之后不同的是,对于路径Ⅲ,P1 的萘环上多个位点发生羟基化反应转化为P4,最后经过硝基化反应生成P8.对于路径Ⅳ,侧链的酮基转变为羧基,萘环上发生羟基化生成P5,最后经过亚硝基化反应和脱羧反应产生P9.以上4 条路径的初始阶段均与5C 的取代反应有关,DFT 结果显示5C 的f0值最高,是极大可能发生自由基取代反应的位点.结合图5 可以推断出路径Ⅲ是最主要的转化路径,通过路径I 的转化作用较弱.大多数产物经由涉及羟基化反应转化而得到,部分产物中含有Cl 和N 元素,说明反应体系内RCS 和RNS 参与了NMT 的降解过程.羟基化、去甲基化和亚硝基化是UV/NH2Cl 降解NMT 主要涉及的转化机制.

图11 UV/NH2Cl 处理NMT 的可能降解路径Fig.11 Proposed NMT degradation pathways by UV/NH2Cl treatment
2.3.4 降解产物毒性分析
UV/NH2Cl 降解NMT 的毒性变化如图12 所示.TEST 软件显示NMT 的LD50试验值为3 877.26 mg/kg,根据联合国出台的全球化学品统一分类和标签制度(GHS)的急性毒性,划分标准属于“可能有害”等级;所有NMT 降解产物LD50均小于母体,甚至P1、P4 和P5 (LD50分别为1 835.42、1 477.58 和1 186.86 mg/kg)已达到“有害”的等级,说明经过UV/NH2Cl 处理,含有NMT 的水溶液急性毒性存在升高的可能性〔见图12(a)〕;除了路径Ⅱ(即NMT→P3→P7)的生物累积性存在明显上升以外,NMT 的其他降解途径存在降低的趋势〔见图12(b)〕,UV/NH2Cl 处理在一定程度上可降低NMT 的生物累积性;NMT 及其产物均存在发育毒性,并且产物的发育毒性高过NMT 本身,可能对个体生长发育产生影响〔见图12(c)〕;所有产物的诱变性均大于母体,并且除NMT 和P3 为阴性以外其余物质均为阳性,提示这些化合物可能引起诱变〔见图12(d)〕.

图12 UV/NH2Cl 降解NMT 过程的毒性变化Fig.12 Toxicity changes during the degradation process of NMT by UV/NH2Cl
2.4 UV/NH2Cl 降解NMT 过程中消毒副产物生成
图13 展示了在UV/NH2Cl 降解NMT 及24 h 后氯胺化过程DBPs 的产生情况.试验条件下生成的TCM 和DCAA 浓度均小于GB 5749-2022《生活饮用水卫生标准》规定的限值(分别为0.06 和0.05 mg/L).本研究中采用的药物浓度和NH2Cl 投加剂量均高于饮用水厂中的实际情况,因此实际应用场景中DBPs产生风险比试验条件更低.

图13 UV/NH2Cl 降解NMT 消毒副产物的生成浓度Fig.13 Concentration of DBPs during the degradation process of NMT by UV/NH2Cl
1,1-DCP 和DCAA 是主要DBPs,浓度约占总DBPs 的30%~40%.DBPs 生成量随UV/NH2Cl 处理时间而增加.有研究[32-33]表明,在高级氧化体系内自由基对DBPs 的生成反应和降解反应同时进行,2 种反应的速率差异导致DBPs 随时间呈现升高或降低的趋势.可以得出,UV/NH2Cl 体系内活性自由基更倾向于对污染物持续的攻击,因此DBPs 浓度随时间持续上升.UV/NH2Cl 处理300 s 后TCM、DCAN 和TCNM浓度分别为9.37、7.26、1.44、0.86 和0.77 μg/L,经24 h后氯胺化分别升至3.34、2.56 和2.27 μg/L,这意味着NMT 的降解产物在后氯胺化过程中反应性更活跃,为TCM、DCAN 和TCNM 的形成提供了前体.相关研究表明,氧化剂可将含胺基(-NH2) -3 价的N 氧化为硝基(-NO2) +3 价的N[41],P2 和P6 含有胺基,极有可能为TCNM 的前体.在保证水中NMT 充分去除的前提下,尽可能缩短UV/NH2Cl 及后续氯胺化的时间是控制消毒副产物的策略之一.
3 结论
a) UV/NH2Cl 高级氧化工艺是1 种可实现对NMT高效降解的可行性工艺,NMT 降解过程符合拟一级反应动力学方程.当温度25 ℃、pH 7.0、NMT 初始浓度5 μmol/L、NH2Cl 投加量50 μmol/L 时,降解速率(kobs)为1.43×10-2s-1.
b) 降解速率随NH2Cl 投加量的增加而增加;pH在5.5~8.5 范围内对降解速率的影响较为微弱;Cl-、HCO3-和NOM 抑制NMT 的降解过程.
c) UV/NH2Cl 对NMT 的降解路径主要包括羟基化、亚硝基化和去甲基化作用,部分降解产物的急性毒性和发育毒性强于NMT 本身.UV/NH2Cl 可促进DBPs 的产生,降解产物在后氯胺化过程中可为DBPs 提供前体.实际应用中可合理控制反应时间以减少高毒性产物和消毒副产物的产生.

