光学相干断层显像在ACS 患者PPCI 支架置入后即刻评价时的应用
方 杰,光雪峰,林霄峰,戴海龙,左桐曦,赖 碁
(昆明医科大学附属延安医院心内科,云南 昆明 650051)
光学相干断层成像(optical coherence tomography,OCT)是一种新型的冠状动脉内成像技术,与冠状动脉造影(coronary angiography,CAG)等常用冠状动脉影像学技术相比,OCT 有更高的分辨率,可以更清晰地显示冠状动脉内部的结构细节和冠状动脉内支架的情况[1]。在使用直接经皮冠状动脉介入治疗(primary percutaneous coronary intervention,PPCI)治疗急性冠状动脉综合征(acute coronary syndrome,ACS)的领域,用OCT 评价靶病变的状况和优化支架的置入,正在日益受到关注;以往的研究多聚焦于置入前对靶病变的状况进行评价和如何基于评价结果制定置入策略,对支架置入后使用OCT 即刻评价并据此制定后续治疗策略的研究较少。本研究通过在ACS 患者PPCI 术中,使用OCT 即刻评价支架置入的效果,并根据OCT 检查结果决定后续治疗方法和策略,探讨在PPCI 术中使用OCT 对支架置入效果进行即刻评价的应用价值。
1 资料与方法
1.1 研究对象
选择2019 年6 月至2022 年8 月昆明市延安医院心血管内科行PPCI 的ACS 患者172 例作为OCT 指导组,在支架置入后即刻使用OCT 进行评价。从接受单纯CAG 指导的PPCI 术患者数据库中采用倾向性评分匹配方法回顾性1∶1 顺序匹配172 例患者作为CAG 指导组。排除标准:(1)右冠状动脉开口处病变和左主干病变;(2)冠状动脉搭桥术后,支架内再狭窄或闭塞;(3)预估靶血管直径≤2.5 mm;(4)预处理前靶血管狭窄 <90%,预处理后残余狭窄≥70%;(5)靶血管病变部位存在严重钙化;(6)OCT 检测前靶血管TIMI血流 < 3 级;(7)OCT 检测前血流动力学不稳定;(8)严重肾功能不全。研究方案经昆明市延安医院伦理委员会审核批准,所有样本采集均获得研究对象知情同意。
1.2 介入治疗方法
以标准的Judikins 法选择性冠状动脉造影。根据标准手术程序使用直径为2.5 mm 半顺应性球囊进行预扩张;根据患者血压,硝酸甘油100~200 µg 经指引导管注入冠脉靶血管,造影判断血管直径,按血管直径1∶1 比例置入支架。在CAG 组由术者根据支架置入后复查冠状动脉造影结果决定是否进行高压后扩张或置入第2 枚支架。在OCT 指导组,支架置入以后立即行OCT检查评价支架贴壁和膨胀的情况,观察支架内血栓负荷和支架边缘是否有夹层,并根据OCT 评价结果决定下一步治疗措施。
1.3 评价方法
1.3.1 介入术前2 组患者TIMI 血流分级情况 冠状动脉血流TIMI 分级[2]分为 4 级:0 级冠状动脉病变以近血管存在前向血流,但病变以远血管内没有血流;1 级为部分血流可以通过冠脉病变处,但是冠状动脉病变以远的血管只能被部分充盈;2 级为虽然造影剂可以完全充盈病变以远的冠状动脉但充盈耗时超过3 个心动周期,而且造影剂的清除速度明显慢于正常的冠状动脉;3 级为在3 个心动周期以内造影剂完全充盈病变以远的冠状动脉,并且造影剂能被迅速清除。
1.3.2 无复流现象(no-reflow phenomenon,NRP)的评价 NRP 为在PPCI 过程中梗死相关血管在无痉挛、血栓栓塞、内膜下撕裂及夹层等机械性梗阻情况下冠脉造影发现冠状动脉内前向血流速度明显减慢[3]。
1.3.3 存在支架膨胀不全时OCT 及CAG 的评价方法 当OCT 测量到的最小支架横截面积其与参考管腔面积的比值小于80%的情况时视为存在支架膨胀不全[4];单纯依靠CAG 无法判定是否存在支架膨胀不全,需要结合术者经验判定。
1.3.4 存在支架贴壁不良时OCT 及CAG 的评价方法 当OCT 测量到的支架梁与管壁距离≥200µm 的情况时视为存在支架贴壁不良[5];单纯依靠CAG 无法判定是否存在支架贴壁不良,需要结合术者经验判定。
1.3.5 存在需要补救的支架边缘夹层时OCT 及CAG 的评价方法 当OCT 测量发现夹层深度累及中膜、角度 > 60°且长度 > 2 mm 时,视为需要补救[6];CAG 显示支架边缘5 mm 内明显的与管壁分离或造影剂滞留时,视为需要补救。
1.3.6 存在组织脱垂时OCT 及CAG 的评价方法
根据成分不同,组织脱垂可分为支架内血栓脱垂和支架内斑块脱垂,OCT 检查显示表面为不规则且伴有强信号衰减的为血栓脱垂,表面光滑且没有明显信号衰减的组织为斑块脱垂[7];PPCI 术中,若CAG 检查发现支架内有明显的造影剂充盈缺损时,视为存在组织脱垂。
1.4 临床随访
所有患者在出院后每月门诊随访1 次,随访观察6 个月,统计临床终点事件,包括心血管死亡、心肌梗死再发、再次行靶血管血运重建、脑出血和脑梗死。
1.5 统计学处理
统计学分析使用SPSS16.0 统计软。2 组患者TIMI 血流分级情况、NRP 的发生率、支架膨胀不全发生率、支架贴壁不良发生率、支架边缘夹层发生率用n(%)描述,计数资料分析采用χ2检验,计量资料以()表示,2 组比较采用t检验。P< 0.05 表示差异有统计学意义。
2 结果
2.1 患者临床基线特征
2 组患者性别比例、年龄、高血压及糖尿病患病人数、梗死相关血管概况等临床基础情况的差异无统计学意义(P> 0.05),OCT 指导组和CAG 指导组患者具有可比性,见表1。
表1 2 组患者的临床资料 [()/n(%)]Tab.1 The clinical data of two groups of patients with ACS [()/n(%)]

表1 2 组患者的临床资料 [()/n(%)]Tab.1 The clinical data of two groups of patients with ACS [()/n(%)]
2.2 患者的介入治疗前后的结果
2 组患者术前TlMI 血流0~1 级的患者例数:OCT 指导组为96 例,计55.8%,CAG 指导组为101 例,计58.7%(P> 0.05)。球囊后扩张例数:OCT 指导组为82 例(其中38 例因为支架膨胀不全,20 例因为支架贴壁不良,24 例因为支架内组织脱垂),计47.7%,CAG 指导组为61 例,计35.5%(P< 0.05)。NRP 发生例数:OCT 组为18 例,计10.5%,CAG 指导组为33 例,计19.1%(P< 0.05)。因支架边缘夹层置入第2 枚支架例数:OCT 组为14 例,计8.13%,CAG 组为8 例,计4.65%(P<0.05)。置入支架长度:OCT 组为(26.32±6.70)mm,CAG 组为(29.05±6.76)mm(P> 0.05)。置入支架直径:OCT 组为(2.97±0.45)mm,CAG 组为(3.03±0.37)mm(P> 0.05),见表2。
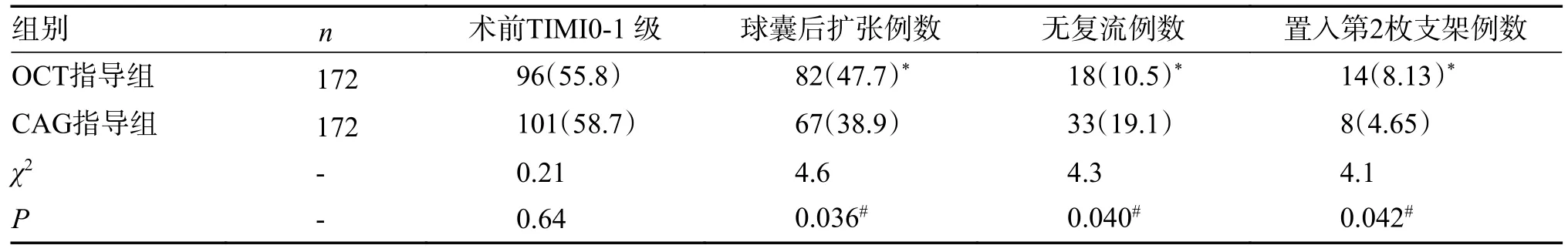
表2 2 组患者术前TIMI 0~1 级、球囊后扩张、无复流、支架边缘置入第2 枚支架发生率的比较 [n(%)]Tab.2 Comparison of TIMI0-1 incidence of dilation after stent placement NRP the placement of second stent between the two groups [n(%)]
2.3 临床随访结果
OCT 指导组和CAG 指导组6 个月随访率分别为97.5%和96.1%(P> 0.05)。6 个月临床终点事件:OCT 指导组为11 例,计6.4%,CAG 指导组为14 例,计8.1%(P> 0.05)。心血管死亡:OCT指导组和CAG 指导组各有1 例,计0.5%。再梗死:OCT 指导组为2 例,计1.2%,CAG 指导组为6 例,计3.5%(P< 0.05)。因心绞痛再次住院:OCT 指导组为组 1 例,计0.5%,CAG 指导组为4 例,计2.3%(P< 0.05),造影证实为支架内再狭窄,再次行介入治疗。出血事件:OCT 指导组为8 例,计4.7%,CAG 指导组为9 例,计5.2%(P>0.05),但均为牙龈或皮肤黏膜等轻微出血,无严重出血事件,见表3。
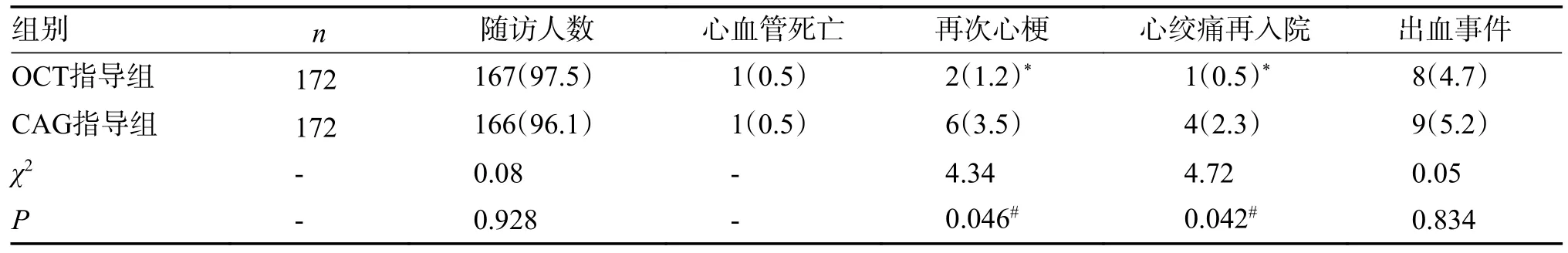
表3 2 组患者术后6 个月临床终点事件的比较 [n(%)]Tab.3 Comparison of 6-month clinical follow-up results between the two groups [n(%)]
3 讨论
PPCI 术是ACS 患者的重要抢救治疗手段,但术中发生无复流现象会增加患者主要不良心血管事件的发生率[8],而PPCI 术中过多的冠状动脉内操作是增加无复流现象发生的一个重要原因[9];支架置入后,如果存在膨胀不全、贴壁不良、组织脱垂和支架边缘夹层等异常情况会影响支架置入的效果[10],显著增加了患者的主要心血管不良事件的发生率。因此,对需要通过PPCI 进行救治的ACS 患者,以下2 者具有同等重要的意义:为避免无复流现象的发生而尽量减少“不必要的”冠状动脉内操作,为尽量改善支架置入的效果而进行“精确的”后扩张及在必要时置入第2 枚支架。与CAG、IVUS 相比,OCT 能更清晰、更明确的显示冠状动脉的管腔结构和支架,能更精确的判断支架对靶病变的覆盖情况,能更好的发现是否存在支架边缘夹层、组织脱垂、膨胀不全和贴壁不良等异常状况,从而为后续治疗方案的选择提供更准确可靠的依据;有研究报道57%的患者在使用OCT 进行检查以后改变了治疗策略[11]。
支架膨胀不全和支架贴壁不良会对血管壁附近正常的血液层流造成干扰,促进血小板和纤维蛋白的沉积,影响支架小梁的内皮化及内膜增生,使支架内血栓更容易形成[12]。有临床研究显示支架膨胀不全是导致支架置入术后血栓形成和发生再狭窄的重要原因,而最小支架内管腔面积越大支架的长期通畅性越好,与支架置入相关的不良心血管事件发生的可能性越小[13-14]。虽然在相关的影像学研究中发现支架与冠状动脉血管壁的贴合不良并不是支架内产生血栓的独立预测因子[15-16],但是在分析支架内血栓形成机制的研究中发现支架贴壁不良的情况并不少见,产生血栓的支架节段贴壁不良的严重程度和发生率明显高于无血栓的支架节段[17-18]。基于较CAG 和冠状动脉内超声检查有更高的分辨率,OCT 更容易发现支架膨胀不全和贴壁不良,而对支架膨胀不全和贴壁不良的积极处理更有利于改善患者的预后[12];发现支架存在膨胀不全和贴壁不良后,均采用高压球囊进行支架内后扩张,是本研究中OCT 指导组后扩张比例高于CAG 指导组的主要原因。由于OCT 评价可以精确判断支架内最小管腔面积不达标是因为支架膨胀不全还是因为支架内血栓脱垂所致,需要时可以在OCT 指导下尽量避开支架内血栓负荷严重的的节段,仅对膨胀不全和贴壁不良的支架节段进行精准和有针对性的后扩张,减少了由于后扩张导致血栓脱落诱发无复流现象发生的可能性,这是OCT 指导组进行支架内高压后扩张的比例虽然明显高于CAG 指导组,但OCT 指导组无复流现象的发生率却低于CAG指导组的主要原因。
OCT 的分辨率较高,微小的支架边缘夹层亦能够识别,ILUMIENⅢ研究发现OCT 比IVUS 识别出更多的支架边缘夹层[19]。在CLI-OPCI Ⅱ研究中,OCT 显示的支架边缘厚度 > 2 mm 的夹层片会导致主要不良心血管事件发生率的明显升高[20]。但在另一项OCT 研究中,发现微小的支架边缘夹层并没有增加术后1 a 内的不良心血管事件的发生率;这可能是因为某些微小的支架边缘夹层可能没有临床意义,无需处理[21-22]。在本研究中仅对累及中膜和长度 > 2 mm 且角度 > 60°的夹层给予置入第2 枚支架;通过对术后观察及随访结果的分析,微小夹层不予处理并未成为MACE 事件的独立预测因子;本研究再次提示:PPCI 术中,并非所有OCT 检查发现的夹层均需要处理。
在本研究中,随访6 个月再次心肌梗死发生率和靶血管再次血运重建发生率OCT 指导组明显低于CAG 指导组,这可能与OCT 指导下NRP 发生率更低,支架获得更充分的膨胀、支架贴壁更好和支架边缘夹层均得到及时发现和处理有关。
PPCI 术中支架置入后即刻使用OCT 进行评价可准确识别是否存在支架膨胀不全、支架贴壁不良、支架边缘夹层和支架内组织脱垂和等异常情况,而根据评价结果制定的后续治疗策略,能够在更好的优化支架置入的同时,明显减少NRP的发生率,实现了ACS 患者PPCI 个体化的精准治疗。

