不同液体培养基对茶藨子叶状层菌生长代谢的影响
孙立娇 孙迪 程显好 史晓委 赵志龙


摘要:茶藨子叶状层菌(Phylloporia ribis)是一种寄生于5年以上金银花活体根茎韌皮部的药食两用真菌,具有抗炎、抗病毒等作用。采用4种液体培养基对茶藨子叶状层菌进行人工培养,并探究不同培养基对生物量、三萜、多糖及腺苷含量的影响。结果表明:茶藨子叶状层菌在马铃薯液体培养基和忍冬马铃薯液体培养基中多糖含量较高,分别为2.910 mg/g和2.708 mg/g,在忍冬麦麸培养基中生物量为3.280 mg/g、三萜为6.426 mg/g、腺苷为3.182 mg/g,含量均高于其他三种培养基。本研究为大规模人工培养茶藨子叶状层菌提供参考。
关键词:茶藨子叶状层菌;液体培养;忍冬;代谢产物
中图分类号:Q93-335 文献标志码:A 文章编号:1002-4026(2023)05-0027-06
Effects of different liquid culture media on growth and metabolism of Phylloporia ribis
SUN Lijiao1,SUN Di2,CHENG Xianhao3,SHI Xiaowei1,ZHAO Zhilong1*
(1. College of Medicine, Linyi University, Linyi 27600, China;2. Shandong (Linyi) Institute of Modern Agriculture , Zhejiang University, Linyi 27600, China;3. School of Agriculture, Ludong University, Yantai 264000, China)
Abstract∶Phylloporia ribis, a type of medicinal and edible fungus that parasitizes the phloem of Lonicera japonica rootstock for more than 5 years, has anti-inflammatory and antiviral effects. In this study, four types of liquid media(PD, LPD,MF,LMF) were used for its artificial culture. Furthermore, the effects of different media on the contents of triterpene polysaccharide and adenosine in the biomass were investigated. The results showed that the polysaccharide contents of Phylloporia ribis were high in PD and LPD media (2.910 mg/g and 2.708 mg/g, respectively). The biomass, triterpenoid, and adenosine contents of Phylloporia ribis in LMF medium were 3.280 mg/g, 6.426 mg/g, and 3.182 mg/g, respectively, which were higher than those in the other three media. This study provides a reference for the large-scale artificial cultivation of Phylloporia ribis.
Key words∶ Phylloporia ribis; liquid culture; Lonicera japonica Thunb.; metabolism
茶藨子叶状层菌(Phylloporia ribis)属于锈革孔菌科(Hymenochaetaceae)叶状层菌属(Phylloporia),是一种寄生于5年以上忍冬科植物金银花活体根茎韧皮部的药食两用真菌[1-2]。该菌含有甾醇、有机酸、多糖、三萜和苯乙烯基吡喃酮等化学成分[3-5],其中化合物drosophilin A、crototropone及核苷类成分等具有显著的抗炎、抗病毒活性[5],多糖类化合物具有抗肿瘤[6]、促进免疫调节等药理作用[7-9],且毒理研究表明其安全无毒[9-10]。作为新资源食品以及民间常用药,广泛用于防治咽炎、扁桃体炎等口腔炎症,在医疗保健方面展现出重要的开发价值,应用前景广阔。茶藨子叶状层孔菌作为非腐生类真菌,对生长条件要求严苛,野生菌稀少,严重限制了茶藨子叶状层孔菌的深入开发。因此,茶藨子叶状层菌的人工培养是对其开发利用具有重要意义。
近年来,国内学者对于该菌的人工培养已展开初步相应研究,陈蒙蒙等[2]采用6种固体培养基人工培养,发现该菌在麦芽汁固体培养基中生长速度最快,在麦麸固体培养基中色素积累明显较多,且生物量最高,而在GPY培养基(葡萄糖蛋白胨酵母膏培养基)中培养40 d左右三萜含量最高。周丽思等[11]通过添加不同生药量忍冬茎水提取物对茶藨子叶状层菌发酵的影响进行了探究,忍冬茎水提物可显著提高菌丝体中麦角甾醇、总多糖等含量。因此,基于茶藨子叶状层菌的生长习性[1,3]以及其他真菌的人工培养研究基础[11-19],本文采用4种不同液体培养基,对该菌进行人工液体培养,探究不同液体培养基对茶藨子叶状层菌代谢的影响,为茶藨子叶状层菌的人工培养提供思路。
1 材料与方法
1.1 实验仪器
SW-CJ-2D超净工作台(苏州净化)、YXQ-75S11高压灭菌锅(上海博讯)、HNY恒温振荡培养箱(天津欧诺)、pH计、旋转蒸发仪、高效液相色谱仪(华普仪器)、Zorbax Extend-C18色谱柱、ZF紫外分光光度计(上海康华)、KQ-500DE超声波清洗机。
1.2 实验材料
供试菌株鲁东大学提供,经ITS序列鉴定,为茶藨子叶状层菌(Phylloporia ribis)。
菌丝体培养试剂:PD培养基(马铃薯葡萄糖液体培养基)、葡萄糖、麸皮、蛋白胨、磷酸二氢钾、硫酸镁、忍冬藤。
多糖含量检测剂:葡萄糖、6%苯酚、硫酸、磷酸二氢钾、磷酸氢二钾、无水乙醇、丙酮、乙醚。
三萜含量检测剂:齐墩果酸标准品(上海源叶生物科技有限公司)、95%乙醇(体积分数)、5%香草醛冰醋酸溶液(体积分数)、高氯酸、冰醋酸。
腺苷含量检测剂:腺苷标准品(上海源叶生物科技有限公司)、50%甲醇(体积分数)、甲醇(分析纯、色谱纯)。
1.3 培养基及其制备方法。
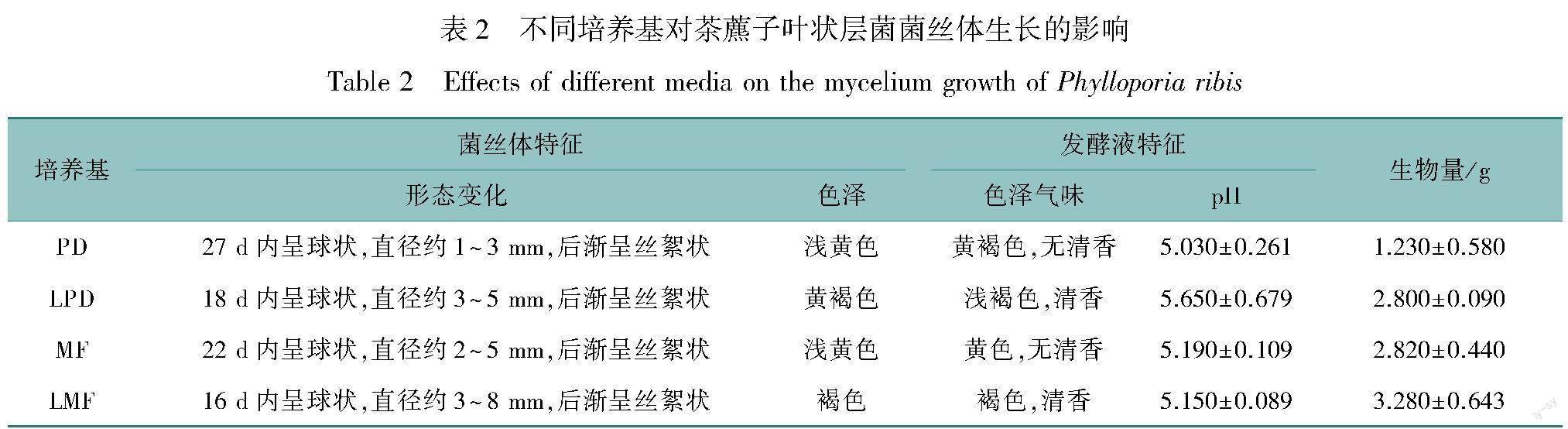
茶藨子叶状层菌液体培养基配方见表1。
液体培养基按上述配方准确称重,搅拌均匀后,以80 mL/瓶分装至250 mL的锥形瓶中,121 ℃灭菌30 min。
1.4 实验方法
1.4.1 菌种的制备
菌种的活化:取4 ℃保藏的茶藨子叶状层菌接种至PDA(马铃薯固体培养基)培养基中,置于恒温培养箱,28 ℃培养15 d。
一级摇瓶种子制备:活化菌种生长直径至5 cm时,无菌打孔器制备茶藨子叶状层菌菌块,挑取菌块接种至PD培养基中,置于恒温振荡培养箱中,220 r/min,28 ℃培养8 d。
二级摇瓶种子制备:取5 mL 一级种子培养液,接种于二级摇瓶种子PD培养基中,220 r/min,28 ℃培养7 d。
测试培养基的接种与培养:取5 mL 二级摇瓶种子培养液,接种于不同培养基中,220 r/min,28 ℃培养10 d。
1.4.2 生物量的测定
采用滤纸过滤法定期测定各培养基中茶藨子叶状层菌菌丝体生物量。发酵结束后,发酵液离心弃上清,沉淀物置于烘箱中,100 ℃烘干至恒重。蒸馏水洗涤沉淀3次,80 ℃烘干至恒重,获得菌丝生物量。
1.4.3 pH的测定
以pH计对发酵液pH进行测定,具体方法依照GB 6920—1986《水质pH值的测定玻璃电极法》[20]规定方法,同一样品重复测定3次。
1.4.4 三萜含量测定
采用香草醛-冰醋酸法测定忍冬茶藨子叶状层孔菌三萜含量[21-22]。收集菌丝烘干至恒重后研磨,称取0.5 g 菌丝粉末置于15 mL试管中,加入8 mL 70%乙醇溶液(体积分数),用超声波(42 kHz)室温提取1.5 h,收集上清液,沉淀继续用6 mL 70%乙醇根据以上条件重复提取2次,合并3次提取液,2 000 r/min离心10 min,取上清液,70%乙醇定容至20 mL,即得醇提样液。
1.4.5 多糖含量测定
采用硫酸苯酚法测定忍冬茶藨子叶状层孔菌多糖含量[22-25]。称取0.5 g 菌丝体粉末加水15 mL,沸腾2 h,浸泡过夜,纱布过滤后,残渣重复上述步骤两次,合并滤液,将所获得滤液加热浓缩至原体积的1/5,再向其中缓慢加入4倍浓缩液体积的无水乙醇,置于4 ℃冰箱中过夜醇沉,2 000 r/min离心后倾去上清液得到沉淀,依次用无水乙醇、丙酮、乙醚洗涤后再用蒸馏水溶解,最后在100 mL容量瓶中定容,即得多糖样品溶液。
1.4.6 腺苷含量测定
采用高效液相色谱法测定茶藨子叶状层菌腺苷含量[26]。取5支10 mL具塞试管,分别精确称取四种茶藨子叶状层菌菌丝粉末0.5 g,分别加入5 mL 的50%的甲醇溶液,超声(100 W,60 ℃)震蕩溶解30 min后收集上清液。收集沉淀物,重复提取2次,合并3次提取液,2 000 r/min 离心10 min,取上清液。旋干后加入甲醇5 mL溶解,压滤获得腺苷样品液[26]。色谱柱为Zorbax Extend-C18 (4.6 mm×150 mm,4 μm);流动相为甲醇-水(体积比为1∶9);流速为1 mL/min;检测波长为260 nm;进样量5 μL。
1.4.7 数据分析
采用Excel 2010软件和SPSS 21软件进行数据分析和标准差分析。所有试验重复3次,结果为(平均值±标准差)表示。
2 结果与分析
2.1 不同培养基对茶藨子叶状层菌菌丝体生长的影响
在同等培养条件下,在不同培养基中生长的茶藨子叶状层菌菌丝生长特性及生物量具有明显差别(表2)。LMF培养基的菌丝生物量最高,达到3.28 g,其他依次为MF培养基、LPD培养基和PD培养基。同时,通过检测各培养基的发酵液pH发现,茶藨子叶状层菌的适宜pH在5.0~5.3之间。
2.2 不同培养基对茶藨子叶状层菌三萜含量的影响
在三萜含量比较中,经LMF培养基培养的茶藨子叶状层菌菌丝三萜含量最高,三萜含量达到6.426 mg/g,[JP]其次是LPD培养基和PD培养基,分别为3.313 mg/g和 2.703 mg/g,经培养基LPD培养的忍冬茶藨子叶状层孔菌虽然生物量较高,但三萜成分含量最低,仅有2.333 mg/g。
在茶藨子叶状层菌三萜产量方面,产量从高到低依次为培养基LMF、培养基MF、培养基PD、培养基LPD。在所有培养基培养的茶藨子叶状层菌菌丝中,经培养基LMF培养的茶藨子叶状层菌菌丝三萜产量最高,80 mL发酵液中,达到1.928 mg,与其余三种培养基相比,具有显著差异(P<0.05),三萜产量最低的是LPD培养基培养的茶藨子叶状层菌菌丝。以茶藨子叶状层菌三萜为目标产物时,应首选培养基LMF培养基作为茶藨子叶状层菌菌丝发酵培养基。
2.3 不同培养基对茶藨子叶状层菌腺苷含量和产量的影响
在腺苷含量比较中,经LMF培养基培养的茶藨子叶状层孔菌菌丝腺苷含量最高,达到3.182 mg/g,腺苷含量由高到低依次为LPD培养基、MF培养基、PD培养基,分别为2.853、1.752、0.988 mg/g。
在茶藨子叶状层菌腺苷产量方面,产量从高到低依次为LMF培养、LPD培养、MF培养基、PD培养基。在所有培养基培养的茶藨子叶状层菌菌丝中,LMF培养中茶藨子叶状层菌菌丝腺苷产量最高,80 mL发酵液中,达到0.954 mg,与其余3种培养基相比,具有显著差异(P<0.05),腺苷产量最低的是经PD培养基培养的茶藨子叶状层菌菌丝。以高产茶藨子叶状层菌腺苷为目标产物时,应首选LMF培养基作为茶藨子叶状层菌菌丝发酵培养基。
2.4 不同培养基对茶藨子叶状层菌多糖含量和产量的影响
不同培养基对茶藨子叶状层菌多糖的含量和产量影响见表5。在多糖含量比较中,经PD培养基培养的忍冬茶藨子叶状层孔菌菌丝多糖含量最高,高达2.91 mg/g,培养LPD中的忍冬茶藨子叶状层孔菌菌丝多糖含量为2.708 mg/g,培养基MF中的忍冬茶藨子叶状层孔菌菌丝多糖含量为2.498 mg/g,经培养LMF培养的忍冬茶藨子叶状层孔菌菌丝生物量、三萜含量以及腺苷含量均最高,但其多糖含量仅有2.311 mg/g,相较其他培养基,多糖含量最低。
在茶藨子叶状层菌多糖产量方面,产量从高到低依次为培养基PD、培养基LPD、培养基MF、培养基LMF。在所有培养基培养的茶藨子叶状层菌菌丝中,培养基PD中茶藨子叶状层菌菌丝多糖产量最高,80 mL发酵液中,达到0.873 mg,[JP]与培养基LPD中的菌丝相比差异不明显,不具有统计学意义,与培养基MF、 培养基LMF相比,具有显著差异(P<0.05),多糖产量最低的是经LMF培养基培养的茶藨子叶状层菌菌丝。以高产茶藨子叶状层菌多糖为目标产物时,应首选培养基PD培养基作为茶藨子叶状层菌菌丝发酵培养基。
3 讨论
综上实验结果发现,添加忍冬茎叶水提液的培养基更适合茶藨子叶状层菌的发酵培养,LPD与LMF培养基中菌丝体生物量明显增加,其菌丝疏松,有利于菌丝高效利用发酵液中的营养物质与溶解氧,从而生长速度提高。同等条件下培养60 d,LMF培养基产出的菌丝生物量、腺苷含量以及三萜含量最高,菌丝干重高达164.0 mg,三萜含量高达0.64%,是GPY培养基的1.65倍左右,腺苷含量高达0.32%,综合生物量、三萜、多糖以及腺苷等多个指标来看,适宜茶藨子叶状层菌发酵的培养基由高到低依次为LMF、LPD、MF、PD。虽然人工菌丝培养取得一定进展,但茶藨子叶状层菌的产量较低,仍未达到大规模生产的要求,还需要进一步探索。
参考文献:
[1]张小青,戴玉成. 中国真菌志第二十九卷 锈革孔菌科[M]. 北京:科学出版社,2005: 169-170.
[2]陈蒙蒙, 程显好, 孙磊, 等. 茶藨子叶状层菌固体培养特性[J]. 食用菌学报, 2015, 22(4): 37-39. DOI: 10.16488/j.cnki.1005-9873.2015.04.007.
[3]范轶欧, 陈敏, 周雯, 等. 茶藨子叶状层菌研究概况及开发利用[J]. 辽宁中医药大学学报, 2013, 15(1): 91-94. DOI: 10.13194/j.jlunivtcm.2013.01.93.fanyo.055.
[4]刘玉红, 徐凌川, 王建平, 等. 茶藨子叶孔菌化学成分的研究[J]. 中药材, 2005, 28(11): 998-999. DOI: 10.13863/j.issn1001-4454.2005.11.014
[5]于秀玲, 白丽君, 李琳, 等. 茶藨子叶状层菌化学成分及其体外抗病毒活性[J]. 中成药, 2020, 42(7): 1777-1781. DOI: 10.3969/j.issn.1001-1528.2020.07.019.
[6]牟玥静, 方磊, 李佳, 等. 茶藨子叶状层菌的化学成分及抗肿瘤活性研究进展[J]. 中国药房, 2016, 27(4): 542-544.
[7]王薪. 环棱褐孔菌水溶性提取物的化学成分研究[D]. 济南: 山东中医药大学, 2002: 1-8.
[8]LIU Y H, WANG F S. Structural characterization of an active polysaccharide from Phellinus ribis[J]. Carbohydrate Polymers, 2007, 70(4): 386-392. DOI: 10.1016/j.carbpol.2007.04.019.
[9]盧连华, 姚文环, 徐凌川, 等. 茶藨子叶孔菌(金芝)的急性毒性和遗传毒性研究[J]. 环境与健康杂志, 2011, 28(9): 830-831. DOI: 10.16241/j.cnki.1001-5914.2011.09.023.
[10]卢连华, 姚文环, 谢玮, 等. 茶藨子叶孔菌大鼠90d喂养试验研究[J]. 毒理学杂志, 2013, 27(2): 103-106. DOI: 10.16421/j.cnki.1002-3127.2013.02.005.
[11]周丽思, 陈彤垚, 曾旭, 等. 不同生药量忍冬茎水提物对茶藨子叶状层菌发酵菌丝体生长和代谢产物的影响[J]. 食用菌学报, 2021, 28(3): 78-85. DOI: 10.16488/j.cnki.1005-9873.2021.03.010.
[12]韩树,张云,王俊儒. 栽培忍冬茎叶活性成分含量测定及其抑菌活性研究[J].河 南 农 业 科 学,2012,41(3):133-136.
[13]韩树. 忍冬茎叶化学成分及其抑菌活性的研究[D]. 杨凌: 西北农林科技大学, 2008.
[14]鲁思爱. 忍冬藤的化学成分及其药理应用研究进展[J]. 临沂大学学报, 2012, 34(3): 132-134. DOI: 10.3969/j.issn.1009-6051.2012.03.037.
[15]秦国培. 茶藨子叶状层菌的深层发酵及其菌丝质量标准研究[D]. 济南: 山东中医药大学, 2011.
[16]侯晓梅, 陈敏青, 张慧蕾, 等. 中药提取物对灰树花深层发酵的影响[J]. 食品科技, 2013, 38(9): 185-188. DOI: 10.13684/j.cnki.spkj.2013.09.033.
[17]景思佳, 张蕾, 刘洋, 等. 11种樟科树枝水提物对樟芝液体培养的比较[J]. 浙江林业科技, 2019, 39(5): 17-23. DOI: 10.3969/j.issn.1001-3776.2019.05.003.
[18]胡彩香. 阿魏提取物对阿魏菇菌丝生长及生物活性影响的研究[D]. 乌鲁木齐: 新疆农业大学, 2009.
[19]吴红娟, 鲁耀邦, 肖锦仁, 等. 松根液对发酵茯苓菌丝产量和多糖成分的影响[J]. 中国中医药信息杂志, 2010, 17(2): 40-41. DOI: 10.3969/j.issn.1005-5304.2010.02.017.
[20]国家环境保护局. 水质pH值的测定玻璃电极法:GB/T 6920—1986[S]. 北京:中国标准出版社,1987.
[21]国家药典委员会. 中华人民共和国药典2015年版三部[M]. 北京: 中国医药科技出版社, 2015.
[22]陈飞, 马闽卉, 梁运祥, 等. 不同品种灵芝固态发酵菌丝体多糖和三萜含量的比较[J]. 食品科技, 2011, 36(9): 19-22. DOI: 10.13684/j.cnki.spkj.2011.09.031.
[23]丁霄霄, 李凤伟, 商曰玲, 等. 灵芝多糖的复合酶法提取工艺优化[J]. 食品研究与开发, 2020, 41(5): 34-39. DOI: 10.12161/j.issn.1005-6521.2020.05.006.
[24]李晓红, 邹昀员, 田易玲, 等. 苯酚-硫酸法测定茶藨子叶状层菌发酵菌丝多糖含量[J]. 山東中医杂志, 2013, 32(5): 346-348. DOI: 10.16295/j.cnki.0257-358x.2013.05.038.
[25]张惟杰. 复合多糖生化研究技术[M]. 上海: 上海科学技术出版社, 1987.
[26]左言美, 程显好, 朱萌, 等. 锰离子胁迫对蛹虫草菌丝体内虫草素、腺苷含量的影响[J]. 中国药学杂志, 2013, 48(16): 1363-1368. DOI: 10.11669/cpj.2013.16.008.

