miR-544靶向DUSP13抑制神经胶质瘤细胞增殖、周期分布和凋亡
何占彪,王睿君
(1.内蒙古医科大学附属医院 放疗科,内蒙古 呼和浩特010050;2.内蒙古自治区神经系统疾病临床医学研究中心,内蒙古 呼和浩特010050)
胶质母细胞瘤(Glioblastoma,GBM)是胶质瘤中恶性程度最高的肿瘤,呈浸润性生长,生长速度极快[1]。GBM患者的预后极差,中位生存期不到1.5年,5年生存率低于10%[2]。微小RNA(miRNA)是一类高度保守的编码小分子,通过miR-RISC复合物靶向mRNA的3’非翻译区(UTR)的结合,从而抑制靶基因表达而发挥生物学功能[3]。异常表达miRNAs影响细胞增殖、凋亡和癌症进展。多项研究证实miRNAs可以作为癌症诊断、预后的标志物和治疗的靶点[4-5]。据报道在GBM患者中存在大量的miRNA异常表达,与GBM患者的预后,分期及细胞增殖相关[6]。本研究分析miR-544在胶质母细胞瘤组织和细胞中的表达,探究其对U87细胞增殖、凋亡和细胞周期分布的影响,报道如下。
1 材料和方法
1.1 材料
收集2021年1月至2022年1月内蒙古医科大学附属医院神经外科经病理证实的20例GBM患者手术切除的癌组织和癌旁组织样本共20对。手术切除后立即将样本放入液氮中,储存在-80℃冰箱中。研究经医院伦理委员会批准。
1.2 细胞、实验试剂及仪器
人神经胶质母细胞瘤细胞T98G、U138、U87和正常胶质细胞NHAs(上海细胞研究所,中国);DMEM培养基(Gibco,美国);胎牛血清(FBS,Gibco,美国);miR-544 mimics和阴性对照组(NC),pcDNA3.1-DUSP(双特异性磷酸酶)13重组过表达质粒和对照空载体由上海吉马生物公司合成。TRIzol试剂( Invitrogen,美国);逆转录试剂盒(Fermentas,德国);SYBR Green Master Mix(Life Technologies,CA,美国);抗体购于美国 Abcam 公司。
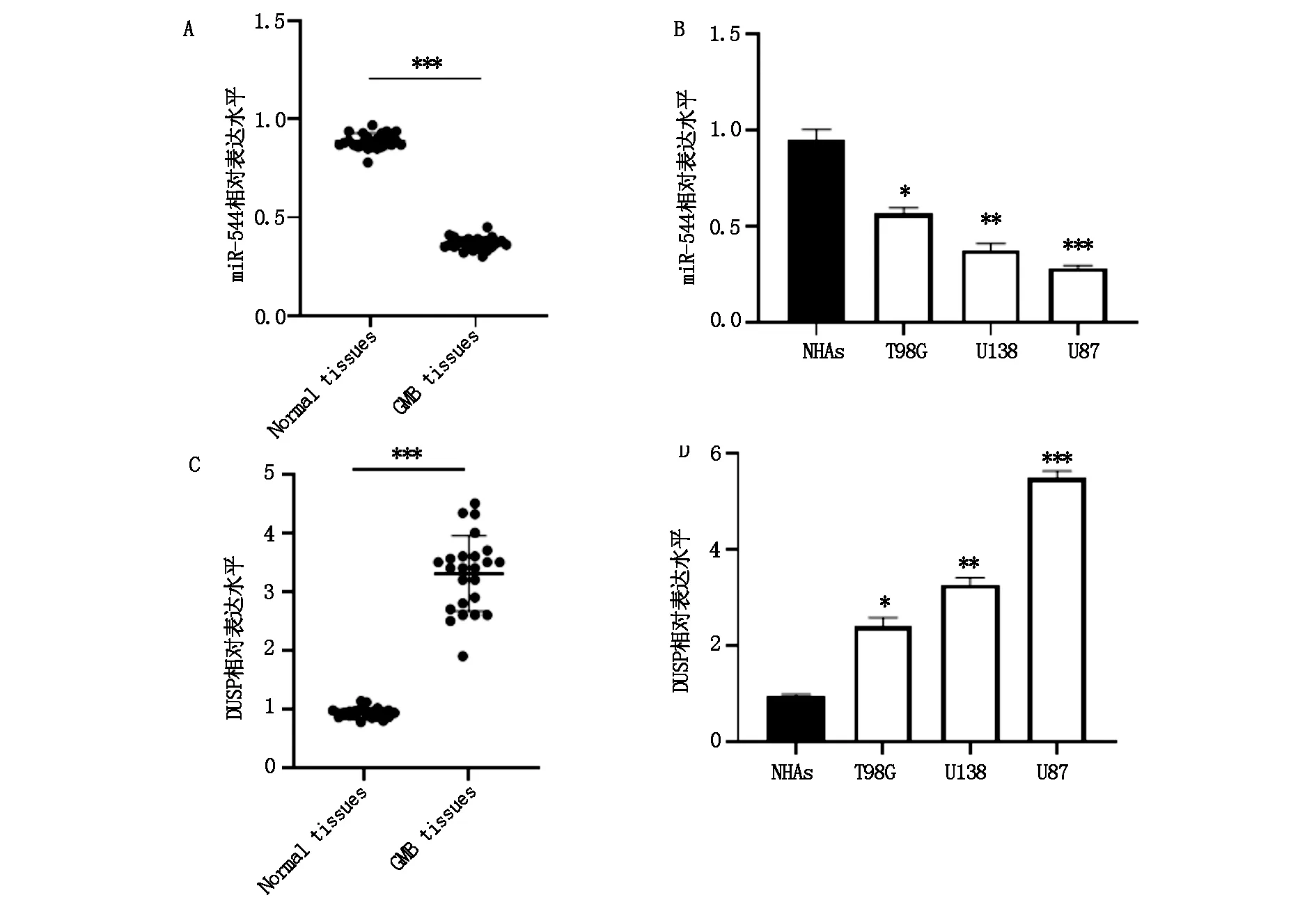
图1 miR-544和DUSP在GBM患者组织和细胞中表达比较
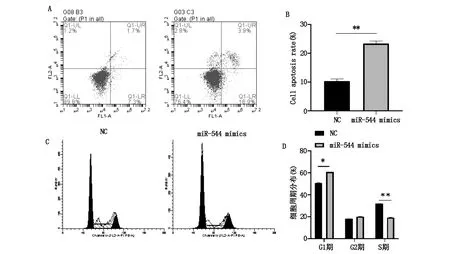
图3 miR-544对细胞凋亡,细胞周期分布的影响

图4 miR-544与DUSP在神经胶质母细胞瘤中的调控关系
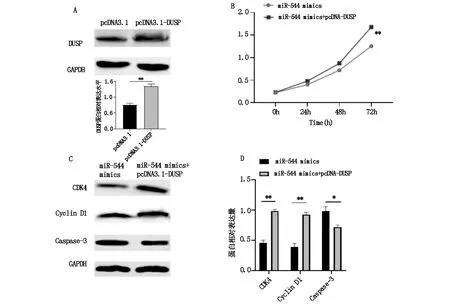
图5 过表达DUSP13对细胞增殖能力的影响

图6 过表达DUSP13对细胞凋亡、细胞周期分的影响
1.3 细胞培养
T98G、U138、U87、NHAs细胞在添加10%胎牛血清,50 U·mL-1青霉素和50 μg·mL-1链霉素的DMEM中保存,并在37℃、5% CO2细胞培养箱中培养。将对数生长期的细胞接种在6孔板中,当细胞密度达到80%时进行接下来的实验。采用Lipofectamine 2000转染试剂盒将 pcDNA3.1-DUSP13重组过表达质粒和对照空载体分别转染到U87细胞中,转染48 h收集细胞进行接下来的实验。
1.4 实时定量PCR(RT-qPCR)检测
按照试剂盒使用说明,使用Trizol试剂提取RNA。用SuperScriptTMIII第一链合成系统将总mRNA(1 μg)逆转录为cDNA。采用SYBR Green Real-time PCR Master Mixes进行RT-qPCR,U6或GAPDH作为内部对照。采用2-ΔΔCT方法对结果进行分析。
1.5 Western blot检测蛋白表达
利用RIPA裂解缓冲液将细胞均质化,并将50 μg的全细胞裂解物通过SDS-聚丙烯酰胺凝胶分离并转移到硝酸纤维素膜上。然后用5%脱脂牛奶TBST中封闭膜1 h,然后在4℃下用所示抗体探针过夜。将HRP偶联的山羊抗兔再培养1 h,用增强化学发光试剂观察其条带。GAPDH作为内参。
1.6 CCK-8检测细胞增殖
CCK8测定根据试剂盒使用说明(WST-8,Dojindi Labs,Kuamoto,Japan)进行。U87细胞以3000个细胞/孔的密度接种在96孔板中,并用乙醇处理。24、48、72和96 h后,将10 μl CCK8溶液添加到板的每个孔中,并将孔温育2h。使用Multiscan MS分光光度计(瑞典斯德哥尔摩Labsystems)评估450 nm处的吸光度值。
1.7 克隆形成实验
将500个对数生长阶段的细胞接种到含有10 ml培养基的培养皿中。细胞在37℃、5%CO2和100%湿度下生长2周,不改变培养基。然后,用4%多聚甲醛固定细胞,用Giemsa染色30 min,并在显微镜下计数菌落。
1.8 流式检测细胞凋亡与周期
细胞被胰蛋白酶化,悬浮在PBS中,并在室温下用FITC Annexin V(1∶500)染色15 min。在进行分析之前,向细胞中加入4 μg·mL-1PI,并用流式细胞仪进行凋亡能力分析。将细胞用70%乙醇固定并重新悬浮在PBS中。随后,将50 μg·mL-1碘化丙啶(PI)和0.2% Triton X-100添加到细胞中,在4℃下再孵育30 min,并用流式细胞仪进行细胞周期分析。
1.9 荧光报告基因分析
合成预测靶基因的3’-UTR靶位点和突变体,克隆到pmirGLO双荧光素酶miRNA靶表达载体中。U87细胞接种于96孔板,12 h后用Lipofectamine 2000共转染0.2 μg的质粒、5pmol的miR-544 mimics或5pmol的scramble序列。转染48 h后收集细胞,根据试剂盒使用说明书,使用双荧光素酶报告系统分析萤火虫和海肾荧光素酶活性。
1.10 统计学分析
采用Graphpad统计分析软件对实验数据进行统计分析。计量资料采用平均值±SD,组间差异的显著性采用t检验,多组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 miR-544和DUSP在GBM患者组织和细胞中表达情况
胶质母细胞瘤组织中miR-544表达水平与癌旁组织比较显著降低(图1A),DUSP表达水平与癌旁组织相比显著升高(图1C),差异具有统计学意义(P<0.05)。胶质母细胞瘤细胞系T98G、U138、U87中miR-544表达水平与正常脑胶质细胞NHAs相比显著降低(P<0.05,图1B),DUSP表达水平与NHAs相比显著升高,(P<0.05,图1D)。选择表达差异较大的U87细胞进行接下来的功能实验研究。
2.2 过表达miR-544对U87增殖、细胞周期分布、细胞凋亡的影响
miR-544 mimics组细胞miR-544表达水平显著高于NC组(P<0.05,图2A),表明转染miR-544 mimics能够上调miR-544表达。CCK-8检测细胞活力结果显示:与NC组相比,miR-544 mimics组细胞增殖能力显著降低(P<0.05,图2B)。克隆形成实验结果显示:与NC组相比,miR-544 mimics组细胞克隆形成能力显著降低(P<0.05,图2C和2D)。采用流式细胞仪检测miR-544 mimics对细胞凋亡和周期的影响。与NC组相比,miR-544 mimics组显著诱导细胞凋亡(P<0.05,图3A和3B);与NC组相比,miR-544 mimics组G1期细胞比例显著增加,S期细胞比例显著降低(P<0.05,图3C和3D),miR-544 mimics抑制了细胞周期的进展。
2.3 miR-544靶向调控DUSP靶基因
在胶质母细胞瘤U87中过表达miR-544,Western blotting检测结果表明:与对照组相比,miR-544 mimics组的DUSP表达显著减少(见图4A和4B)。TargetScan 预测miR-544和DUSP之间的结合位点(见图4C)。双荧光素酶报告基因检测证实在WT组中miR-544 mimics组的荧光素酶活性显著降低,差异具有统计学意义(P<0.05),结果见图4D。
2.4 过表达DUSP13可逆转miR-544对U87细胞增殖、凋亡,周期分布的影响
过表达DUSP13组细胞DUSP13蛋白表达水平显著高于NC组(P<0.05,图5A),表明转染DUSP13能够上调DUSP13蛋白。CCK-8实验结果显示:与miR-544 mimics组相比,miR-544 mimics+pcDNA0DUSP13组细胞增殖能力显著增加(P<0.05,图5B)。Western blotting检测结果表明:与miR-544 mimics组相比,miR-544 mimics+pcDNA0DUSP13组细胞周期相关蛋白CDK4、CCND1的蛋白表达水平增加,Caspase-3蛋白水平降低,差异具有统计学意义(P<0.05,图5C和5D)。
采用流式细胞仪检测DUSP13对细胞凋亡和周期的影响,与miR-544 mimics组相比,miR-544 mimics+DUSP13过表达组显著抑制细胞凋亡(P<0.05,图6A和6B);与miR-544 mimics组相比,miR-544 mimics+DUSP13过表达组G1期细胞比例显著减少,S期细胞比例显著升高(P<0.05,图6C和6D)。
3 讨论
GBM是最常见的恶性脑肿瘤,尽管近年来采用多种先进的手术治疗、放疗和化疗等综合治疗,GBM患者的中位生存期仍约1年,预后较差。越来越多的证据表明miRNA在GBM进展中发挥重要作用[7]。研究显示miR-595可通过靶向SOX7促进GBM细胞增殖[8]。据报道,miR-181b与GBM进展相关[9]。先前有研究发现miR-544在骨肉瘤、肝癌、胃癌和结直肠癌中发挥癌基因的功能[10-11]。然而,miR-544在乳腺癌中发挥肿瘤抑制因子的作用,抑制肿瘤进展[12]。这种功能上的差异可能具有组织特异性。本研究检测了miR-544在GBM中的表达,并鉴定了miR-544作为GBM中肿瘤抑制基因的作用。通过CCK-8、克隆形成实验和流式细胞术实验发现在GBM细胞中过表达miR-544显著抑制了细胞的增殖,阻滞细胞周期,促进癌细胞凋亡。以上结果表明miR-544在GBM中发挥肿瘤抑制作用。
miRNA通过与靶基因mRNA的3’UTR结合来调控靶基因的表达,是基因表达调控的经典方式[13]。本研究通过targetscan预测发现miR-544与DUSP13的3’UTR可能存在相互作用,并通过突变位点的荧光素酶报告基因实验证实了miR-544与DUSP13之间的靶向结合。本研究发现DUSP13在GBM中表达显著增加。miR-544与DUSP13的表达呈负相关。在GBM细胞中过表达DUSP13显著促进细胞的增殖,抑制凋亡。因此,DUSP13在GBM中发挥促癌基因的作用。因此,DUSP13可能是miR-544在GBM中的作用靶点。
DUSP是一种负责将底物上丝氨酸和酪氨酸残基去磷酸化的蛋白家族[14]。DUSP包含DUSP1~DUSP13等家族成员,参与肿瘤的发生和发展过程[15]。其中 DUSP13基因编码两种亚型:DUSP13B和DUSP13A。DUSP4和DUSP13的共同表达促进了转化生长因子β-1介导的肺癌的迁移、侵袭和化疗耐药[16]。功能实验表明,过表达miR-544显著抑制U87细胞的增殖,阻滞细胞周期进展,诱导细胞凋亡。过表达DUSP13逆转了miR-544对GBM细胞增殖、细胞周期分布、凋亡的作用。通过荧光素酶报告基因证实DUSP13是miR-544靶基因,miR-544在GBM中功能部分是通过DUSP13调控的。
本研究仍存在一些局限性。首先,未来需要研究miR-544表达的上游调控机制。其次,miR-544有很多预测的靶点,其他靶基因是否也参与miR-544的作用尚不清楚。未来将进一步探究miR-544及DUSP13如何在GBM进展中发挥作用。
综上,本研究结果揭示了MiR-544通过靶向抑制DUSP13进而促进GBM细胞增殖,而miR-544靶向调控DUSP13是其参与增殖过程的作用机制之一。

